1800MHz电磁辐射对大鼠听性脑干反应及海马超微结构的影响
2019-06-26罗小莉钟时勋章碧云杨红红左汶奇
罗小莉 钟时勋 章碧云 杨红红 左汶奇
重庆医科大学附属第一医院,耳鼻咽喉科(重庆400016)
根据《中国统计年鉴2018》记载,截止2017年底,中国手机用户已达到14.17亿户[1]。手机电磁辐射(Electromagnetic radiation,EMR)造成的潜在健康风险已经引起了社会广泛关注。衡量EMR强度的常用指标有频率和比吸收率(Specific absorption rate,SAR)。1800MHz为全球移动通信系统常用频率[2];而SAR是反应手机EMR被物体吸收的程度,国际非电离辐射防护委员会建议通信频率下职业暴露于人体头部的SAR不应超过10w/kg,公众不应超2w/kg[3]。
头部及耳部是手机电磁辐射的主要效应器官。海马不仅参与记忆、学习、行为调节,也参与感觉、嗅、触觉等信息的加工,有研究证实海马不仅是听觉刺激的响应区,也是听觉信息传递的控制区,听觉信息可通过听觉通路传递到海马CA3区[4-6]。
有研究表明长期使用手机会增加不孕不育率,引起听力下降及耳鸣,增加胶质瘤和听神经瘤的发病风险[7-12]。有报道对小鼠进行间断3月的手机EMR其听性脑干反应(Auditory brainstem response,ABR)阈值升高[13],也有文献报道,急性及慢性暴露不会引起听力的改变[14]。我们前期研究发现耳蜗螺旋神经节细胞暴露于1800MHz频率,4w/kg辐射强度下,有自噬小体生成及细胞超微结构改变[15],表明手机电磁辐射在一定强度和一定条件下,可以引起耳蜗螺旋神经节细胞超微结构的损伤。
综上,关于手机电磁辐射对听觉系统的影响仍存在较大的争议。在前期离体研究的基础上,课题组拟在动物模型上进一步探讨手机电磁辐射对听觉系统的慢性和急性损伤,明确手机电磁辐射引起生物学效应的具体机制。我们设定成年SD大鼠慢性辐射暴露组(1800MHz,2、4w/kg,1h/d,48d)和急性辐射暴露组(1800MHz,2、4、10w/kg,48h),观察辐射后ABR阈值、活性氧簇(reactive oxygen species ROS)含量及海马CA3区超微结构改变等变化情况。
1 材料与方法
1.1 实验动物及分组
选取耳廓反射灵敏且ABR≤45dB,无中耳疾病的成年SD大鼠,雌雄不分,体重320-450g,由重庆医科大学动物实验中心提供,将筛选后的56只大鼠随机分8组,每组7只。具体分组如下:对照组(Control):不做任何处理的大鼠;急慢性假辐射组(Sham-A、Sham-C):置于辐射箱中不开辐射源;2、4w/kg慢性辐射组(E2C、E4C):暴露于手机辐射源中每天1小时,连续48天;2、4、10w/kg急性辐射组(E2A、E4A、E10A):暴露于手机辐射源中连续48小时。
1.2 试剂
大鼠ELISA试剂盒(基因美,JYM1051Ra)。
1.3 实验设备
辐射系统组成:辐射源(70MHz-8GHz,National Instruments,USRP-2900,美国);功率放大器(最大16w,恒智微波,中国);喇叭天线(A-INFO,中国);辐射系统控制软件(可按需设定1800MHz和2-16w的稳定输出功率及时间,重庆大学);自制铁皮动物辐射箱(长宽高为60、60、80厘米,重庆大学);内置木箱(长宽高为40、40、60厘米,重庆大学)。重庆大学信息物理社会可信服务计算教育部重点实验室负责组装辐射系统并完成相关检测,频率与功率均达到实验要求;实验过程中辐射源相关数据持续发送至该实验室,辐射强度及频率稳定符合实验要求。辐射时采用软件控制辐射源,无需人员现场操作,避免了不必要的职业暴露。
1.4 实验动物的ABR测定和取材
ABR阈值测试仪器采用美国INTELLEGENT HEARING的诱发电位仪,大鼠腹腔注射1%戊巴比妥钠麻醉剂40mg/kg,参考电极置于测试耳耳廓后,记录电极置于颅顶,地极置于对耳耳廓后,刺激声为tone burst,频率为4、8、16、24、32KHz,相同刺激强度叠加1024次,最大刺激强度为90dB SPL,依次递减20dB SPL,快接近阈值时再以10dB、5dB下降,判断标准为能重复出可分辨的ABRⅡ波的最低刺激强度记录为阈值。
与ABR麻醉方式相同,剖开腹腔,找到腹主动脉取血,取血后3000转离心15 min取上清液冻-80℃备用,以生理盐水心脏灌注至清亮液体后换为2.5%戊二醛继续灌注,待颈僵直后迅速断头,取出大脑找到海马区切片,确定CA3区,切块送透射电镜。取出的血清离心后的上清液予以ELISA试剂盒(武汉基因美,JYM1052Ra)测ROS含量了解氧化应激程度,在酶标包被板上设标准品孔10孔,加 入 浓 度 为 3000pg/ml、2000pg/ml、1000pg/ml、500pg/ml、250pg/ml的标准品稀释液各两孔,待测样品孔中加样品稀释液与样品,经加酶、温育、洗涤、显色、终止后,于450nm波长下测定吸光度。
1.5 统计分析
采用SPSS 20.0软件处理全部数据及作图,ABR与ELISA均采用单因素方差分析检验,P<0.05为统计学有差异。
2 结果
2.1 ABR
Control、Sham-A、Sham-C、E2C、E4C、E2A、E4A、E10A的大鼠在同一频率(4KHz、8KHz、16KHz、24KHz、32KHz)不同辐射强度下的听阈差异没有统计学意义(P>0.05)(图1)。
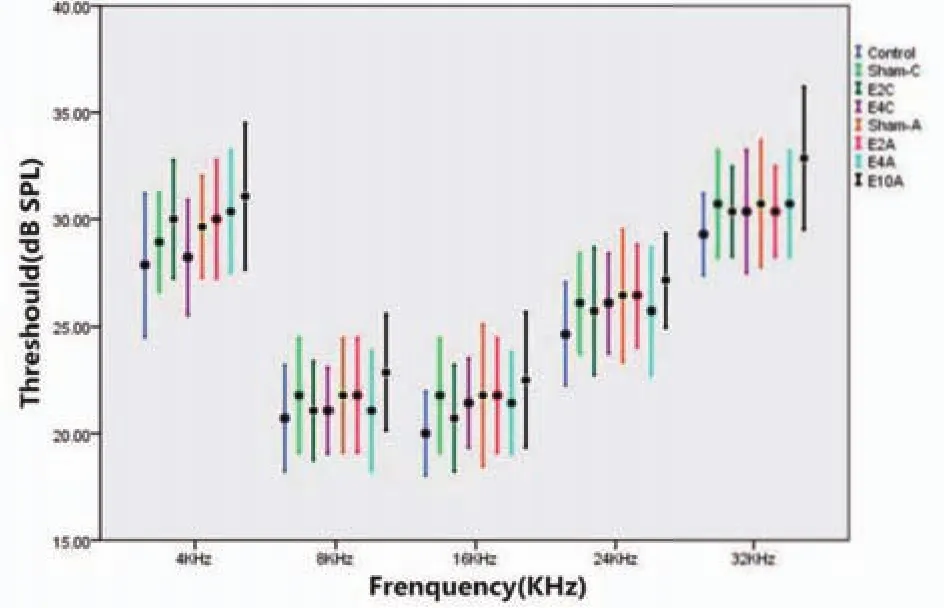
图1 ABR听阈的变化Fig.1 Changes ofABR hearing threshold
2.2 ELISA
采用ELISA法测定血清ROS水平,对照组与E4C、E2A、E4A,Sham-C与E2A、E4A,E2C与E2A、E4A,E4C与E4A,Sham-A与E2A、E4A有非常显著的差异,E10A明显高于其他各组(P<0.01);E4C与Sham-A也有差异(P<0.05)。在急性辐射组及E4C组中体内ROS的升高比其他组更明显(图2、表1)。
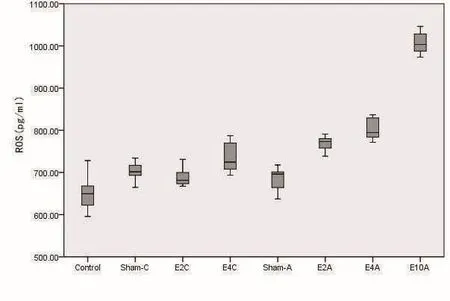
图图2 ROS浓浓度度水水平平Fig.2 Serum ROS levels
2.3 透射电镜
图3为CA3区取材部位。电镜下见对照组、Sham-C、Sham-A组大鼠海马神经元线粒体结构清楚,含量相对丰富;神经胶质细胞线粒体结构清楚,含量相对丰富;神经髓鞘完整光滑。E2C、E4C、E2A、E4A、E10A组中除E2C组外均可见神经元线粒体体积肿胀、嵴减少甚至部分出现空泡样变,E10A组可见核内空泡、线粒体空泡样变、细胞核内电子密度减低;辐射组除E2C组外神经胶质细胞线粒体体积肿胀、嵴减少甚至部分出现空泡样变,E10A组细胞胞浆水肿明显;辐射组神经髓鞘均出现节段性脱髓鞘改变,髓鞘板层分离,以E4A、E10A组最明显(图3、4)。
表1浓度差异对比表Table 1 Contrast table of concentration difference
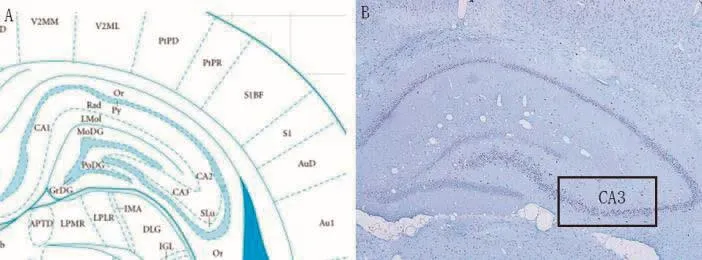
图3 海马组织CA3区(B图甲苯胺蓝染色×50)Fig.3 CA3 area of Hippocampam tissue(B toluidine blue staining×50)
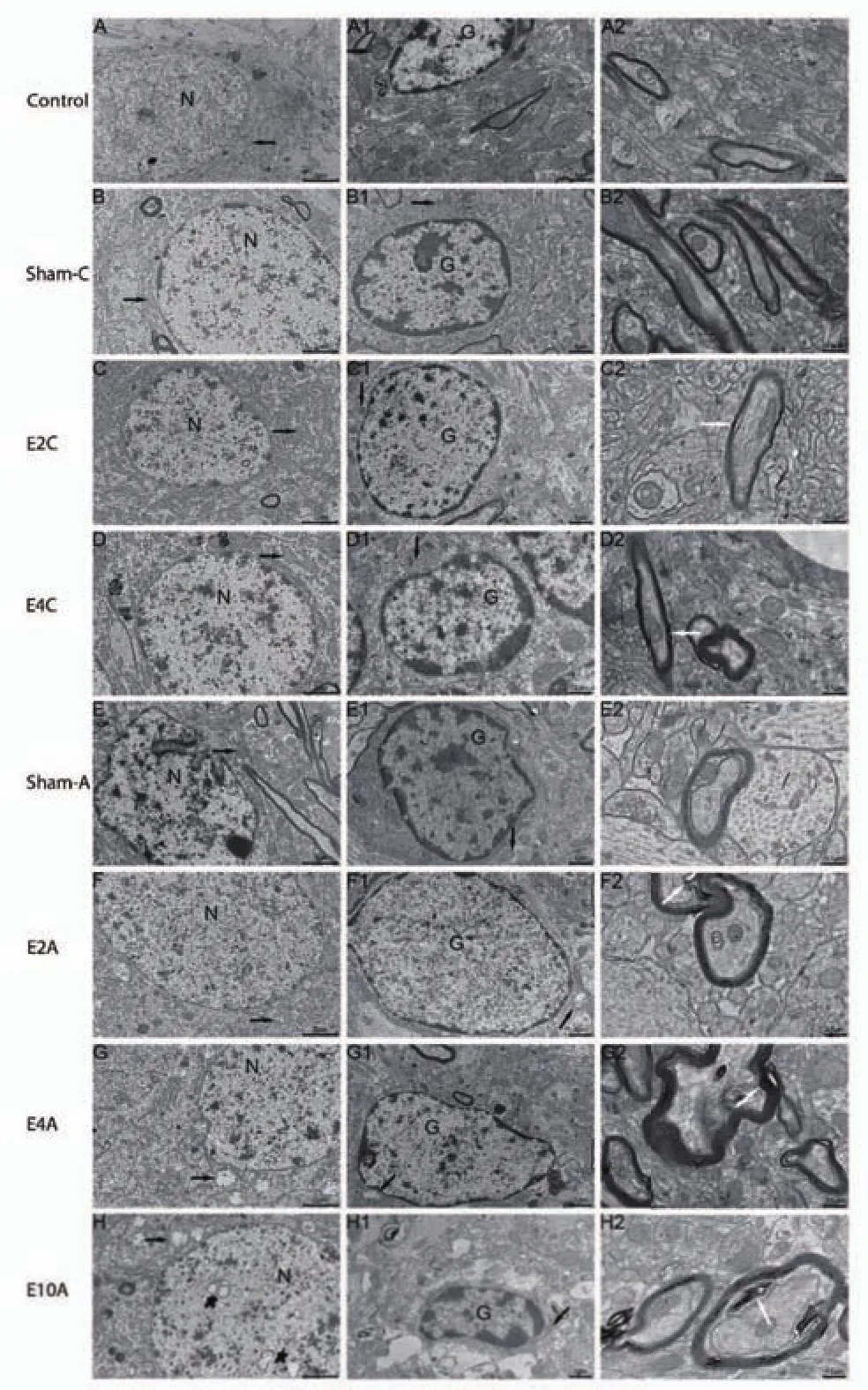
图4海马组织超微结构的改变Fig.4 Ultrastructural changes in hippocampus
3 讨论
手机EMR引起的生物学效应目前研究的重点有热效应及非热效应。头部暴露于EMR的安全限值为2w/kg,大于4w/kg时可产生热效应,职业暴露时达到了10w/kg,我们的实验模拟暴露于1800MHz频率时2w/kg、4w/kg、10w/kg的3种状态,因引起热效应的器官主要在外部皮肤,人类有颅骨的外部抵挡,能够穿透颅骨的热能有限,热能经由颅骨传达到大脑内部时热能减少明显仅会引起大脑温度微弱的升高,故热效应对脑组织的影响甚微[3,8,16];过量ROS的产生是引起氧化应激非热效应产生的主要机制[17,18],ROS的产生主要在线粒体内,线粒体是产生三磷酸腺苷的主要产生场所,提供了大部分细胞生命活动所需要的能量,氨基酸、脂肪酸、糖的最终氧化发生在线粒体,并通过电子传递氧化磷酸化过程完成能量转换,ROS水平依赖于ROS生成和消除之间的动态平衡,当线粒体内ROS清除率小于生成率时,就会造成ROS的蓄积,导致氧化应激的出现[19-21]。氧化应激会影响细胞的脂质、酶、蛋白质及DNA等,导致细胞结构损伤或死亡,当达到不能代偿程度时,最终导致正常组织的病变[22-25]。在本研究中,我们推测E4C、E2A、E4A、E10A组较其他组的ROS含量的升高的原因为前一次辐射造成的影响尚未消除或完全消除时,就再次暴露于EMR,导致了生物学效应的叠加而出现累积作用,E4C组的SAR值较E2C组高,机体需要更长时间代偿辐射对机体的影响,累积作用也更明显。
Galloni[26]报道暴露于900MHz手机EMR下大鼠耳蜗外毛细胞功能未见明显影响;Mora[27]对20名健康男性、Gupta[28]对67名使用手机超过1年的健康成人行ABR检查,未见明显差异;Kayabasoglu[29]对新生及成年大鼠进行EMR,辐射前后的耳声发射未见明显变化。但也有研究指出暴露于手机EMR下小鼠听觉皮层甘胺酸受体表达降低,小鼠ABR阈值有升高,表明手机EMR对小鼠听觉中枢有损伤[13]。我们的研究发现,无论急性暴露组还是慢性辐射组,在2、4、10w/kg辐射强度下ABR的阈值均没有明显的改变,这也和部分研究结果相吻合。听阈的改变可能与辐射时间、强度、频率有一定的联系,故我们需要进一步延长模型暴露的时间。
透射电镜是观察细胞损伤和凋亡的重要手段。神经元是中枢神经系统的基本结构和单位。神经胶质细胞具有支持神经网络形成、调节信息传递、帮助神经元存活等功能,大脑中一半以上的细胞是神经胶质细胞,有时神经胶质细胞的细微变化将直接导致疾病。髓鞘是神经冲动及传导的重要结构,并且具有神经修复功能,髓鞘出现病变会影响神经元的功能传导。上述这些结构对维持机体正常活动及抵御病变起到了重要作用。海马是听觉信息的重要感知区,也是大脑内介导应激反应的重要脑区之一,故海马神经元组织在氧化应激时极易受损。有文献报道暴露于手机EMR后小鼠与大鼠海马神经元细胞数量及核直径均减小,人类中枢神经系统对EMR暴露产生了强烈的神经胶质反应,小鼠大脑皮层神经髓鞘损伤,大鼠心肌细胞线粒体变性、肌原纤维减少、肌浆网扩张、核周空泡化[14,20,30,31,32]。我们研究发现,电镜下E4C、E2A、E4A、E10A组可见神经元线粒体与神经胶质线粒体水肿,并且所有辐射组均可见髓鞘组织的损伤,我们的结果与Ammari[33]报道一致,SAR值越大脑组织损害越重。
2011年,世界卫生组织国际癌症研究中心将射频辐射列为可能的人类致癌物(2B组)。我们在辐射大鼠海马组织中发现神经元、胶质细胞与髓鞘的损伤,这些病变是否与听神经瘤及胶质瘤等疾病的发病有关目前尚无定论,在人类上述肿瘤发生率的增加均在手机暴露10年后,我们通过本实验想检测射频辐射是否能诱发脑肿瘤,但我们的模型排除了这一假设,在显微镜下,我们无法找到射频辐射导致肿瘤发生的直接证据。Tang[34]报道大鼠接受900MHz的电磁场辐射28天,电镜下海马组织出现细胞水肿和神经元细胞器变性,并且大鼠认知功能出现损害,而暴露14天的大鼠虽有超微结构改变但认知功能改变却并不明显,证实暴露时间是重要的参考条件。结合我们的实验结果可以做出以下推断,线粒体损伤的出现早于神经细胞,超微结构的改变早于症状的出现,这也和人类疾病的发生规律相一致。
在该实验中,我们没有束缚大鼠活动以减少动物本身情绪的变化引起的应激干扰,我们设计的辐射源在辐射箱底呈均匀的SAR值,大鼠在辐射箱能自由活动、进食及饮水,这种不是高度标准化的暴露更接近于人类使用移动电话时的真实状态。
综上,我们认为手机电磁辐射产生生物学效应的主要机制是激活氧化应激系统(即ROS系统),过量生成的ROS可以引起听觉中枢海马组织超微结构的损伤,然而动物模型听阈未见明显的改变,我们推测可能是超微结构损伤后组织仍处在自我修复或者代偿过程中,或模型暴露的时间或强度仍不足以导致听阈改变,故课题组拟进行下一步研究来论证。
