中性粒细胞明胶酶相关脂质运载蛋白在肿瘤生物学行为中的研究进展
2019-06-25苏泽鑫杨炳生刘正伟林荔军
苏泽鑫,杨炳生,刘正伟,林荔军
(南方医科大学珠江医院关节骨病外科,广州 510282)
脂质运载蛋白(lipocalin,LCN)家族是一群由小分子量的细胞外分泌性蛋白组成的超家族,最早于1987年被Pervaiz和Brew[1]发现并命名。LCN家族成员的平均长度约为175个氨基酸残基,虽然其家族成员一级结构的相似性仅为25%,不同成员的氨基酸序列具有极大的多样性,但它们都具有高度相似的三级结构,即由8个方向平行的β折叠构成的8链β-桶状结构[2],其共同特点是能作为载体结合并转运一系列小疏水分子,如脂肪酸、类固醇、信息素和前列腺素等。自1996年起,LCN家族被认为广泛分布于人体器官组织中并参与相应的生理功能[3]。中性粒细胞明胶酶相关脂质运载蛋白(neutrophil gelatinase associated lipocalin,NGAL)作为LCN家族的重要成员,过去将其单纯归类为转运蛋白。但有研究表明,NGAL在多种细胞过程中发挥调节细胞生长、代谢、凋亡、分化等作用[4]。另外有研究发现,NGAL也介导多种肿瘤的生成、进展、侵袭和转移过程[5]。目前,有关NGAL在肿瘤中的作用已成为研究热点,因此全面深入地了解NGAL在肿瘤发生与进展中的作用十分重要。现就NGAL在肿瘤生物学行为中的研究进展予以综述。
1 NGAL概述
NGAL由位于染色体基因座9q34.11的一段包含7个外显子与6个内含子的基因所编码,是一种含有198个氨基酸序列的分泌性糖蛋白。其N端为310-螺旋,C端为α螺旋,中间为保守的8链β-桶状结构,三者共同构成NGAL的三级结构。与LCN家族的其他蛋白成员相比,NGAL的8链β-桶状结构更大,与配体结合的结构域更浅,且NGAL的β-桶状结构封闭末端的β4-β5环附近有游离的巯基,可以与配体结合形成二硫键,从而调节蛋白的活性和功能,这也是NGAL与基质金属蛋白酶-9(matrix metalloproteinase-9,MMP-9)前体相结合的结构基础[6]。
最初NGAL被鉴定为分子量为25 000的糖蛋白,其能与高疏水亲和力铁载体(血小板活化因子、细菌性肠螯合素和内源性儿茶酚胺等)结合,因此最早认为NGAL作为抗细菌免疫因子存在,可通过耗竭铁抑制细菌生长并介导炎症反应[7-8]。进一步研究发现,NGAL在体内存在3种分子形式:单体(25 000)、二硫键连接的同源二聚体(46 000)和二硫键连接的异二聚体(135 000)[9]。其中,NGAL的同源二聚体(46 000)可在人中性粒细胞中与MMP-9通过二硫键共价结合,从而在不同组织器官中发挥不同的生物学功能[10]。通常NGAL在人体内主要在炎症或损伤期间的中性粒细胞和其他细胞类型中表达,且NGAL在体内的合成主要来源于粒细胞成熟过程早期的髓细胞阶段,而外周血中的成熟粒细胞缺少NGAL的信使RNA表达[11]。因此在人体正常外周循环中,仅能检测到极低水平的NGAL表达,而NGAL的表达水平在外周血中性粒细胞中升高,这预示着机体处于某种病理状态,如炎症、感染、肿瘤等。
2 NGAL在机体中的调控作用
据报道,NGAL在机体多种病变过程中存在异常表达,包括炎症反应[12]、肾脏与肝脏损害[13-14]及肿瘤[15]。目前,NGAL的蛋白表达水平已被证明在多种肿瘤中异常高表达,包括乳腺癌[16-17]、结肠癌[18]、肺癌[19]、卵巢癌[20]等。然而一项研究表明,NGAL在口腔癌的原发恶性和转移肿瘤组织中表达下调[21]。大量研究表明,NGAL的高表达与高度恶性肿瘤的复发倾向和预后不良相关[15, 22-23]。Cymbaluk-Ploska和Chudecka-Glaz[24]研究认为,NGAL可用于子宫内膜癌患者手术治疗前的肿瘤分期评估。此外,Roli等[25]针对NGAL作为癌症预后和诊断标志物潜在价值的荟萃分析结果显示,生物体液(血清和尿液)中的高NGAL水平可用于预测结直肠癌和乳腺癌患者的无病生存率,但其预后和诊断准确性在其他人类肿瘤中仍不确定,如胰腺癌、状腺癌、肝癌、肺癌、食管癌、口腔癌和肾癌。研究认为,NAGL的异常表达主要通过调控肿瘤细胞增殖与凋亡、血管生成、侵袭与迁移及化疗药物敏感性等在肿瘤中发挥重要作用,而NGAL在不同肿瘤中的功能调控机制不同,见表1。
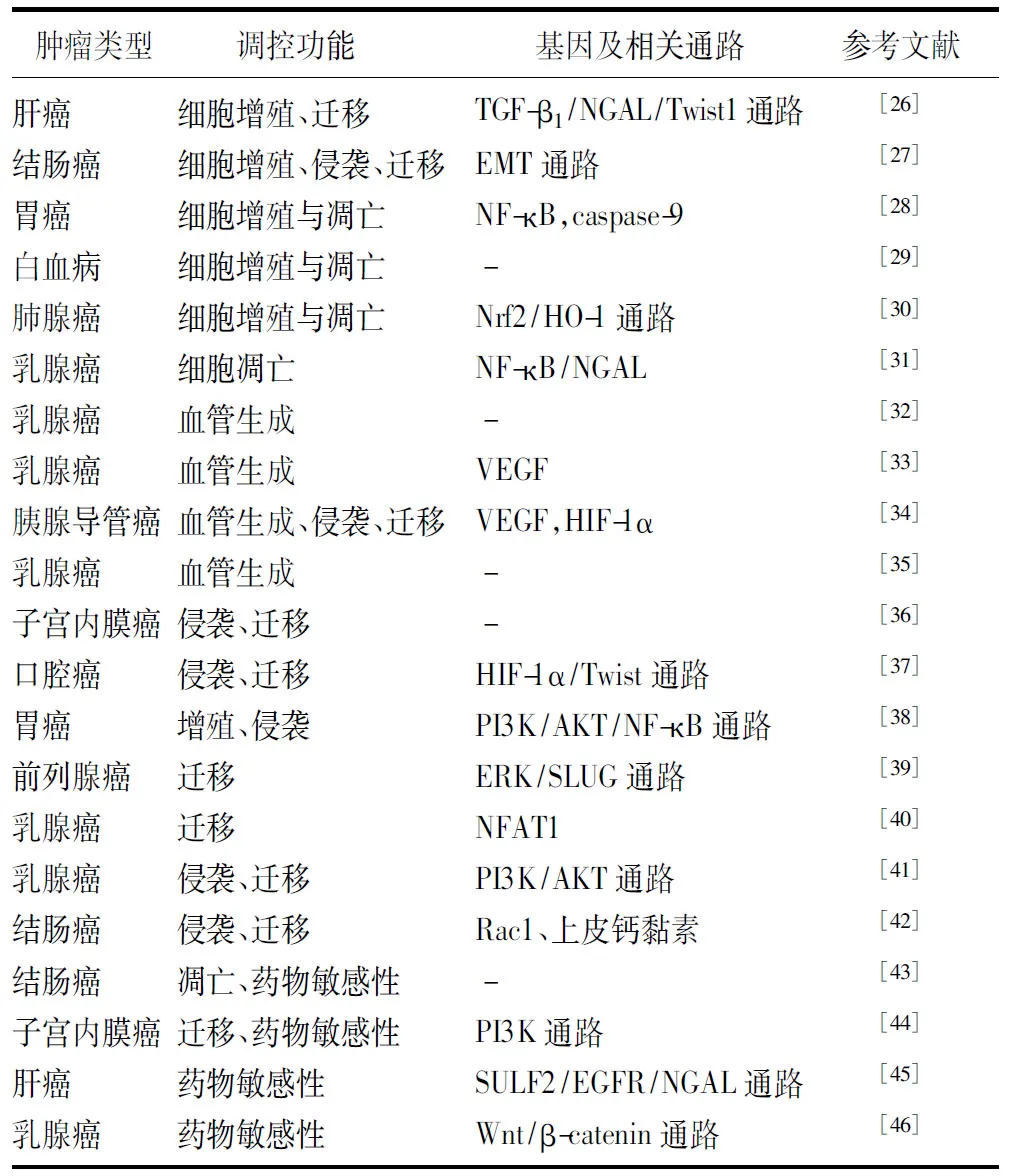
表1 NGAL在不同肿瘤中调控的生物学行为及相关机制
NGAL:中性粒细胞明胶酶相关脂质运载蛋白;TGF-β1:转化生长因子-β1;EMT:上皮-间质转化;NF-κB:核因子κB;caspase-9:胱天蛋白酶-9;Nrf2:核因子E2相关因子2;HO-1:血红素加氧酶1;VEGF:血管内皮生长因子;HIF-1α:缺氧诱导因子1α;PI3K:磷脂酰肌醇-3-激酶;AKT:蛋白激酶B;ERK:胞外信号调节激酶;NFAT1:活化T细胞核因子1;Rac1:Ras相关的C3肉毒杆菌毒素底物1;SULF2:硫酸酯酶2;EGFR:表皮生长因子受体;Wnt/β-catenin:Wnt/β联蛋白;-:未报道
2.1 调控肿瘤细胞增殖与凋亡 肿瘤细胞无限增殖的生长特性是肿瘤发生的始动环节,研究表明,NGAL在不同肿瘤中对肿瘤细胞增殖与凋亡具有不同的调控模式[26-28]。Wang等[26]研究认为,NGAL能通过转化生长因子-β1/NGAL/Twist1通路下调肝细胞癌细胞株的上皮-间质转化,并抑制肿瘤细胞的增殖。Kim等[27]通过对结肠癌细胞株HT-29、DLD-1、SW480、HCT116和SW620的体外细胞实验认为,NGAL的高表达对肿瘤细胞的增殖具有抑制作用,且能进一步抑制肿瘤细胞的迁移。而Han等[28]在对胃癌MGC-803细胞株的研究中发现,沉默NGAL基因可导致细胞处于G0/G1期的数量增加,S期和G2/M期百分比降低,且NGAL的下调通过调控核因子κB相关通路抑制MGC-803细胞的增殖,从而促进细胞凋亡。
Leng等[29]对人慢性髓系白血病的研究发现,NGAL的表达在小鼠动物模型体内促进肿瘤生成的同时,对体内正常造血细胞也起到了促进凋亡的作用,从而进一步促进肿瘤的进展。Song等[30]对肺腺癌的研究表明,NGAL可通过激活核因子E2相关因子2/血红素加氧酶1途径并诱导血红素加氧酶1和超氧化物歧化酶1的表达预防氧化应激,进一步抑制裸鼠体内肿瘤的生长。研究表明,NGAL基因的启动子区域含有许多转录因子的结合位点,如核因子κB,而核因子κB作为调控细胞增殖凋亡重要信号通路的调控因子,在影响肿瘤的发生发展中发挥重要作用。Nanashima等[31]报道,磷脂酶A2Ⅳc(Pla2g4c)基因敲除小鼠可通过介导核因子κB/NGAL通路的表达诱导小鼠体内乳腺肿瘤细胞凋亡,抑制成瘤作用。以上研究结果表明,NGAL对肿瘤增殖的调控作用可能与组织特异性密切相关。可见,NGAL在肿瘤细胞中的调节网络具有一定的复杂性。虽然体外实验发现,NGAL在不同肿瘤细胞中的调控增殖行为存在差异[26-28];但大部分体内实验表明,NGAL对肿瘤的增殖具有促进作用,提示NGAL可能是肿瘤治疗中一个新的潜在治疗靶点[29-31]。
2.2 调控肿瘤血管生成 肿瘤的发生和增殖需要持续的氧气和营养供应,且肿瘤的血管生成对于恶性实体瘤的生长和进展十分重要。然而由于肿瘤组织生成的新生血管为不完整的薄弱管状结构,具有较高的渗透性,有助于肿瘤细胞迁移入血从而发展为远处转移,所以抑制肿瘤的血管生成对肿瘤的治疗具有重要作用[47]。文献报道,乳腺癌患者肿瘤组织和尿液中的NGAL水平均升高,且其升高水平与乳腺癌的进展相关,提示NGAL可作为乳腺癌的诊断和预后标志物[32]。Guo等[33]研究证明,NGAL可通过升高血管内皮生长因子水平刺激新血管形成,且通过对NGAL基因的瞬时敲低或干扰小RNA沉默也可导致乳腺癌细胞肿瘤血管生成减少。Leung等[34]对胰腺导管癌BxPC3和HPAF-Ⅱ细胞株的研究发现,NGAL可通过胞外信号调节激酶通路调节血管生成相关基因缺氧诱导因子1α和血管内皮生长因子的表达。Meka等[35]分析了NGAL启动子甲基化状态与乳腺癌患者微血管形成的关联,结果发现67.2%(43/64)的乳腺癌患者NGAL启动子为非甲基化状态,32.8%(21/64)的患者NGAL启动子为甲基化状态;而NGAL启动子非甲基化状态与肿瘤细胞的侵袭性表型和平均微血管密度升高有关。这些结果表明,NGAL通过促进肿瘤内的血管生成调控肿瘤微环境的改变,从而促进肿瘤的生长和血行转移。
2.3 调控肿瘤侵袭、转移 目前在肿瘤的临床治疗中,虽然系统性治疗方法(新辅助化疗、手术、辅助化疗等)降低了恶性肿瘤相关病死率,但肿瘤的转移率高仍与大部分肿瘤的临床预后差有关。因此,如何抑制和治疗肿瘤的转移是目前肿瘤研究的难点与热点。Mannelqvist等[36]研究发现,NGAL的表达程度与子宫内膜癌的恶性程度、远处转移率和生存预后显著相关。Zhang等[48]对138例肝细胞癌的肿瘤组织进行免疫组织化学染色发现,NGAL的表达水平与肝细胞癌的肿瘤TNM分期、复发率均显著相关。Lin等[37]研究发现,NGAL的基因及蛋白表达水平与口腔癌患者的分期及淋巴结转移呈正相关,提示NGAL在肿瘤的进展和转移中起重要作用。
研究显示,NGAL通过多种信号转导通路发挥介导肿瘤侵袭和转移的作用[4]。虽然NGAL最早被发现能与MMP-9结合,但有研究表明NGAL与MMP-9结合形成的复合物可阻止MMP-9的自身降解,并进一步增加MMP-9的活性;另外,MMP-9本身可降解细胞外基质和基膜,因此NGAL和MMP-9/NGAL复合物的形成有助于肿瘤的进展、侵袭和转移[49]。Koh和Lee等[38]研究表明,胃癌细胞中NGAL的上调可通过磷脂酰肌醇-3-激酶/蛋白激酶B/核因子κB通路促进MMP-9的表达,从而促进肿瘤的转移。Ding等[39]研究发现,NGAL可通过介导胞外信号调节激酶/SLUG通路诱导细胞的上皮-间质转化,上皮-间质转化作为肿瘤侵袭和转移的基础关键机制之一,进一步促进了前列腺癌的侵袭和转移。Gaudineau等[40]对乳腺癌的研究表明,活化T细胞核因子1可诱导下游NGAL的表达,而NGAL的高表达进一步促进乳腺癌细胞的迁移。此外,NGAL还可通过下调小鼠乳腺癌细胞磷脂酰肌醇-3-激酶/蛋白激酶B通路的表达促进肿瘤的肺部转移[41]。Hu等[42]研究发现,沉默NGAL减少了结肠癌细胞株KM12C和DLD1的侵袭行为;同时,该研究还进一步证明NGAL可通过影响Ras相关的C3肉毒杆菌毒素底物1和上皮钙黏素的亚细胞定位调节细胞迁移行为。相反,部分研究则认为NGAL在肿瘤侵袭和迁移中具有保护性的调控作用[27, 50-51]。Feng等[50]在结肠癌的研究中认为,NGAL的上调会抑制核因子κB通路的表达,从而抑制结肠癌细胞株的侵袭和迁移。Kim等[27]研究认为,NGAL在发生转移的结肠癌组织中低表达,在未发生转移的结肠癌组织中高表达,提示NGAL的高表达与结肠癌的转移具有相关性。此外Lee等[51]研究发现,NGAL可通过抑制c-Jun氨基端激酶和磷脂酰肌醇-3-激酶/蛋白激酶B信号通路的表达进一步抑制肝细胞癌HCC细胞株的增殖与侵袭。
2.4 调控肿瘤化疗药物敏感性 虽然手术治疗是实体恶性肿瘤的主要治疗手段,但化疗仍是肿瘤治疗的重要辅助方法,而化疗耐药是影响肿瘤患者预后的一个重要原因,目前已有不少学者对NGAL在化疗耐药性中的作用进行了研究。有研究认为,NGAL不会影响乳腺癌和结直肠癌细胞中的阿霉素耐药性[52]。但在其他药物的研究中,Yu等[53]认为NGAL可通过介导血管内皮生长因子-α的表达增加肾癌细胞对舒尼替尼的药物敏感性。有关结肠癌细胞长春新碱耐药的研究表明,与非耐药株细胞系相比,耐药株细胞系的NGAL蛋白表达减少;同时该研究还观察到,当小干扰RNA下调NGAL的表达后,肿瘤细胞的凋亡被显著抑制,但对其细胞周期没有显著影响[43]。顺铂作为一种传统的抗癌化疗药物,在各种肿瘤治疗中发挥重要作用。Monisha等[21]研究表明,NAGL敲除的口腔鳞状细胞癌细胞通过上调AMP活化的蛋白激酶/p53/DNA损伤修复基因1通路的表达,导致口腔鳞状细胞癌细胞对顺铂的耐药性明显增加,同时也促进了口腔鳞状细胞癌细胞的增殖、迁移。而Miyamoto等[44]研究认为,NGAL表达增加可提高子宫内膜癌细胞对顺铂的耐药性,并促进其肿瘤迁移。Yoon等[45]通过药物基因组学数据分析发现,肝癌患者中索拉菲尼耐药人群的NGAL表达更高,且进一步实验证明其耐药性通过硫酸酯酶2/表皮生长因子受体/NGAL通路进行调控。Kim等[46]结合生物信息学分析发现,由RNA聚合酶Ⅱ延长因子3诱导的5-氟尿嘧啶耐药乳腺癌细胞株的基因芯片表达谱中,NGAL的表达较非耐药株增加,沉默NGAL的表达后,耐药细胞株则重新恢复对5-氟尿嘧啶的药物敏感性。上述研究表明,NGAL在不同肿瘤对不同药物的敏感性中发挥重要调控作用,提示NGAL也可能成为肿瘤药物治疗中的一个潜在突破点。
3 小 结
NGAL作为LCN家族重要的组成因子,广泛参与人体生理病理及肿瘤发生发展的调控环节。目前认为,NGAL参与肿瘤细胞的增殖、凋亡、血管生成、侵袭与迁移等生物学进程,且通过调控肿瘤对化疗药物的敏感性影响肿瘤的治疗并影响肿瘤患者的预后。然而,目前对NGAL的肿瘤相关性机制研究仍不全面,部分研究在NGAL对不同肿瘤中的调控作用得出了矛盾的结果,提示NGAL的肿瘤调控作用具有组织特异性及复杂性。随着科学技术的发展和肿瘤研究的深入,更多关于NGAL在肿瘤中的调控作用将会被挖掘并深入探讨,未来以NGAL为靶点的生物靶向治疗将成为肿瘤研究突破的新热点,并为肿瘤诊断、治疗及预后评估提供新方向。
