食源性甾醇类化合物生物活性及应用
2019-06-25谢建华袁兰兰申明月
贾 硕,张 帆,周 寰,谢建华,袁兰兰,申明月,*
(1.南昌大学食品科学与技术国家重点实验室,江西南昌 330047;2.南昌大学图书馆,江西南昌 330031)
甾醇类化合物是以环戊烷全氢菲(甾核)为基本骨架的一大类化合物,广泛存在于生物体组织内,只能由乙酰辅酶A合成或通过从外界摄取,在生物体生命过程中起着重要的作用[1]。自然界中甾醇存在形式不一,以游离态或结合态的形式存在,通过C-3位衍生为甾醇糖苷、甾醇酯等多种化合物。根据甾核化学式(图1)C-4位所连甲基的数目,甾醇可大致分为4-无甲基甾醇、4-甲基甾醇和4,4-二甲基甾醇三类,其中4-无甲基甾醇是目前研究最多的一类[2]。根据其来源又可分为动物甾醇、植物甾醇和菌类甾醇[3]。食源性甾醇是从可食用的植物、菌菇中获得的甾醇类化合物的统称。表1中列举了一些常见的食源性甾醇。
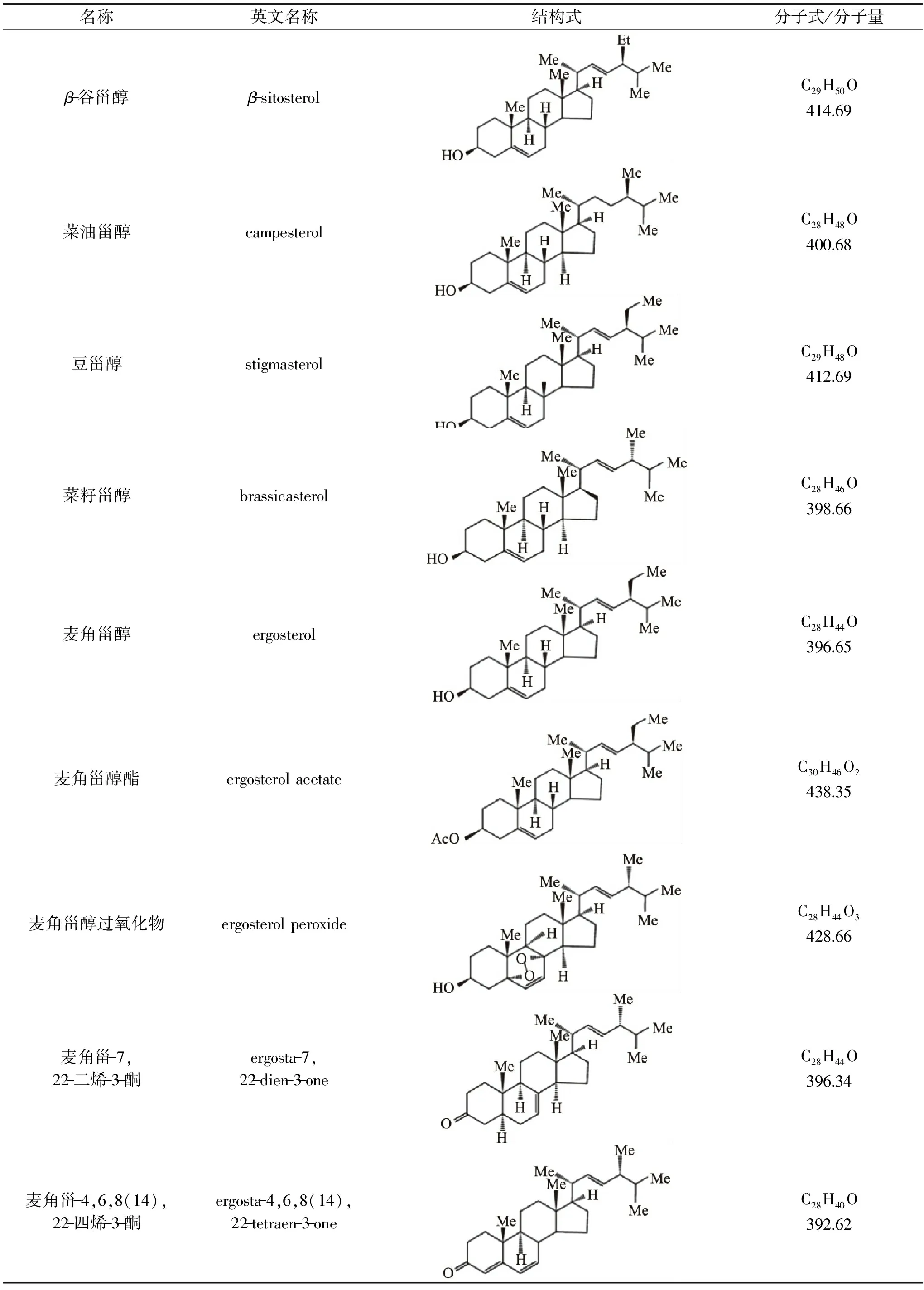
表1 常见的食源性甾醇Table 1 Common food-derived sterols
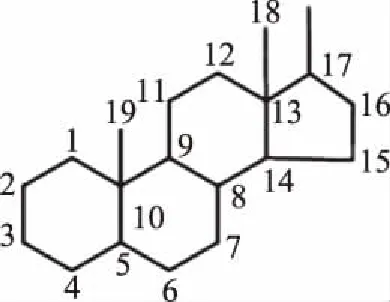
图1 甾核结构式
食源性甾醇广泛存在于可食性植物的花、果、叶、种子和根茎等部分中[4],根据植物种类或不同部位的区别,甾醇种类及相对含量也会有一定差别[5]。例如玉米、小麦、大麦和燕麦等谷物中谷甾醇含量较高,且多以结合态的形式存在。目前从植物体中已经分离鉴定出超过40种的植物甾醇,并以谷甾醇、菜油甾醇和豆甾醇等最为常见[6],这三种甾醇含量总和约占总植物甾醇含量的98%[7]。相较于植物体,甾醇类化合物在真菌中更为广泛地存在,同样与维持细胞形态与正常生理功能密切相关;同时,在不同真菌中的甾醇类型及含量存在着明显差异[8]。菌类甾醇多为C28结构,在绝大多数真菌的甾醇成分中,麦角甾醇及其衍生物的含量占主导地位[9]。
食源性甾醇类化合物是重要的天然甾体,具有多种独特的生物学活性及功能。早在2000年,美国食品药品监督管理局(FDA)就通过了决议,允许添加了甾醇和(或)其衍生物甾烷醇酯的食品贴上“有益健康”的标签。关于甾醇类化合物的生理功能的研究,最开始主要集中在其降胆固醇功效及其机理上,后来发现甾醇还具有抗癌、免疫调节、抑菌等生理功能[10]。本文综述了食源性甾醇的相关研究成果,对其主要生理活性及应用进行了归纳,并对相关研究报道进行了简要的分析和评述,以期为食源性甾醇的深入研究提供参考。
1 食源性甾醇类化合物的生物活性
1.1 降胆固醇作用
早在1951年,Peterson[11]就提出了植物甾醇能够降低血浆胆固醇水平,发现喂养含有豆甾醇饲料的实验组雏鸡血浆及肝脏中的胆固醇含量低于未加豆甾醇的对照组。植物甾醇及其衍生物能够降低血清中低密度脂蛋白胆固醇(LDL-C)的含量,而对其他脂蛋白不造成影响[12]。关于食源性甾醇类化合物特别是植物甾醇降低胆固醇的研究经过以下几个时期[13]:观察时代[11]。植物甾醇能抑制肠道胆固醇吸收,导致血清胆固醇浓度降低,但并没有进行深入研究;胶束时代[14]。提出了微胶束理论,认为甾醇是通过形成微胶束后才可以穿过肠上皮细胞,被人体吸收。由于胆固醇与植物甾醇结构相似,存在竞争关系,所以植物甾醇可以挤掉胶束中胆固醇,从而增加体外胆固醇的排出量;转运时代[15]:随着ABCG5/ABCG8和NPC1L1等不同的甾体转运蛋白及其调控机制的发现,植物甾醇被认为能够使ATP结合盒亚家族G成员(ABCG5/8)和胆固醇酰基转移酶(ACAT)表达量增加,导致胆固醇吸收减少。新发现的时代[16]:最近有学者提出肠道胆固醇排泄(TICE)是甾醇介导的降胆固醇作用的可能机制。
关于食源性甾醇类化合物降胆固醇的作用机理,存在多种假说[17],目前被接受的主要的解释理论有以下四种:(a)根据甾醇的疏水特性,进入小肠后能够竞争性取代小肠内腔微胶束中的胆固醇,造成胆固醇浓度下降,减少肠道对胆固醇的吸收,而使粪便胆固醇排出增多,进而降低体内胆固醇的累积和吸收,这与胶束理论一致。在体外模拟胆汁的条件下也取得了同样的效果,植物甾醇的添加能有效取代胶束中的胆固醇,且豆甾醇活性略强于谷甾醇[18]。与植物甾醇类似,菌类甾醇和胆固醇也具有一定的结构相似性,它们可能通过与人肠中的细胞受体竞争性结合来减少胆固醇的吸收[19]。(b)小肠内只有被ACAT催化酯化后的胆固醇才能进入血循环,而由于结构差异性使得食源性甾醇难以被ACAT酯化,大部分又重新由ABCG5/8等转运体泵回肠腔。因此,游离甾醇能够上调肠细胞ABCG5/8转运体的表达[20],使被吸收的胆固醇重新回到小肠内腔,从而使胆固醇的净吸收含量降低。另外,通过抑制ACAT的活性进而使胆固醇吸收减少作为潜在的降胆固醇方式也被认为具有一定的可行性;通过向高胆固醇膳食小鼠饲料中添加植物甾醇,能使受试动物肝脏ACAT活性相较对照组降低12%,同时小鼠极低密度脂蛋白(VLDL)和低密度脂蛋白(LDL)胆固醇也有显著降低(34%和41%)[21]。(c)干扰乳糜微粒形成机制:甾醇类化合物可通过抑制肝细胞载脂蛋白B(ApoB)的生成和减少VLDL中胆固醇的含量来影响血液中LDL的形成,可增加脂蛋白受体(LDLR)的表达量进而清除了LDL胆固醇[22]。根据家族性高胆固醇血症患者的临床试验结果,植物甾醇能与辛伐他丁或辛伐他丁/依泽替米贝发挥协同效应,对受试患者血浆中总胆固醇、LDL胆固醇、甘油三酯及ApoB能发挥出更显著的降低作用[23]。(d)甾醇类化合物可通过调控胆固醇合成及代谢中关键酶的活性,如植物甾醇能增强胆固醇合成限速酶的活性,同时可降低乙酰基-辅酶A羧化酶和苹果酸酶的活性,抑制胆固醇的酯化酶ACAT的活性。胆固醇-7α-羟化酶(CYP7A1)是胆固醇向胆酸转化的关键酶,根据实验组小鼠肝脏中相关指标的测定结果,植物甾烷醇能促进肝脏X受体α(LXRα)及其靶基因CYP7A1的表达,对胆固醇代谢有一定的促进作用[24]。双孢菇中甾醇提取物能够降低高胆固醇血症大鼠的7胆固醇水平并抑制3-羟基-3-甲基-戊二酰辅酶A还原酶的活性[19]。
虽然假说机制很多,但食源性甾醇降低胆固醇并不是简单的单个机制作用产生的生理活性,可能是多重过程复杂的相互作用。
1.2 抗癌作用
近年来,食源性甾醇的抗癌活性引起人们关注[25]。最新的流行性病学研究发现,摄入植物甾醇能使多种癌症包括乳腺癌、胃癌、结肠癌、前列腺癌和卵巢癌等的患病几率降低[26]。Mendilaharsu等[27]对乌拉圭的463名新诊断的原发性肺癌患者和对照组465名非肺癌住院患者进行了病例对照研究,发现植物甾醇摄入量与罹患癌症的风险呈负相关。De等[28]调查了120名确诊患有胃癌的患者和360名非肿瘤性疾病患者的植物甾醇摄入量,研究其对胃癌患病率的影响,结果显示总甾醇摄入量与胃癌发病率呈反比关系。Mccann等[29]发现在较高的豆甾醇摄入量(423 mg/d)下发生卵巢癌的风险降低。纽约膳食研究机构发布的调查报告指出菜油甾醇、β-谷甾醇和豆甾醇的摄入都能减少卵巢癌的发病率[26]。
体内外实验研究证实植物甾醇确实存在抗癌功效[30]。Llaverias等[31]用一种遗传性乳腺癌的小鼠模型研究了膳食中植物甾醇对肿瘤发病影响,结果表明小鼠乳腺增生性病变和肿瘤负担减少,同时植物甾醇摄入对小鼠体内脂肪氧化表现出抑制作用。
体外实验研究表明β-谷甾醇和豆甾醇能够抑制小鼠黑色素瘤细胞B16F10的生长,并显示出对凋亡的诱导作用[32]。Heleno等[33]发现,双孢菇的甾醇提取物和麦角甾醇比植物甾醇表现出更高的肿瘤细胞抑制活性,该提取物对人乳腺癌细胞MCF-7,大细胞肺癌细胞NCI-H460,人子宫颈癌细胞HeLa及人肝癌细胞HepG2细胞系具有很强的抑制作用。从灵芝子实体中分离得到的三种甾醇组分(真菌甾醇、9(11)-脱氢麦角甾醇过氧化物以及Demethylincisterol A3)能抑制12-O-十四烷酰佛波醇-13-乙酸酯(TPA)诱导的爱泼斯坦病毒早期抗原(EBV-EA)活性,IC50值分别为370、235和293(mol ratio/32 pmol TPA)[34]。利用赤芝中获得的三种甾醇组分(灵芝萜烯酮醇、麦角甾-7,22-二烯-3β-醇、过氧化麦角甾醇)对人肝癌细胞株BEL-7402、人胃癌细胞株MGC-803进行体外抗肿瘤实验,发现以上三种化合物具有显著的抗肿瘤效应,并对正常细胞系HUEBV无明显毒性;进一步研究表明,灵芝萜烯酮醇和麦角甾-7、22-二烯-3β-醇对抑制BEL-7402细胞增殖表现出协同效应[35]。
尽管现有实验研究结果与流行性病学的调查结果之间存在一致性,但关于甾醇类物质的抗肿瘤机制至今仍未完全阐明。目前关于其抗肿瘤机制的解释主要有:抑制致癌物的产生、癌细胞的生长、入侵、转移和促进细胞凋亡等[36]。此外,虽然甾醇类化合物的大部分抗癌作用已经在体外实验和动物实验中得到确认,但仍需要经过人体试验证实,才能将其作为抗肿瘤药物。
1.3 抗炎作用
炎症与多项疾病联系密切,一般的炎症反应是宿主对外来挑战或组织损伤有益的自我保护反应,最终使得身体机能恢复正常。然而长期的炎症反应会对身体有损伤,能诱发多种疾病,如关节炎、哮喘、多发性硬化症、炎症性肠病和动脉粥样硬化等[37]。
研究发现从松针层孔菌子实体分离得到的麦角甾-4,6,8(14),22-四烯-3-酮、麦角甾-7,24(28)-二烯-3-醇和5,8-环二氧麦角甾-6,22-二烯-3-醇,对于脂多糖(LPS)诱导的巨噬细胞RAW 264.7中一氧化氮的产生有显著抑制作用,其中麦角甾-7,24(28)-二烯-3-醇的IC50为15.1 μmol/L。同时这些物质均表现出对诱导性一氧化氮合酶(iNOS)和环氧化酶-2(COX-2)的蛋白质和mRNA表达的抑制,且存在剂量-效应关系[38]。从多花罗汉松中分离得到的麦角甾醇能显著降低由LPS诱导的急性肺炎病理变化,并表现出对促炎性细胞因子,包括肿瘤坏死因子-α(TNF-α)和白细胞介素-6(IL-6)等的抑制作用,说明其作用机理可能与对核因子-κB(NF-κB),COX-2和iNOS通路的抑制有关[39]。
Valerio等[40]长期研究β-谷甾醇的抗炎活性,并且取得了较好的研究成果,实验通过植物甾醇防治实验性自身免疫性脑脊髓炎(EAE)的能力来验证其作为抗炎物质的潜力,结果表明植物甾醇可以通过减少小鼠脑中巨噬细胞的存在和炎症活性来降低疾病发病率。其进一步研究表明[41],β-谷甾醇是通过抑制促炎细胞因子和趋化因子的释放,从而抑制信号传导及转录激活因子(STAT1)信号通路,从而具有一定的抗炎活性。此外,β-谷甾醇还可以抑制NF-κB向细胞核的易位,Yoo等[42]对从海藻中提取的岩藻甾醇进行抗炎活性研究,发现岩藻甾醇可通过下调mRNA转录从而抑制多种细胞因子的表达;另外岩藻甾醇减弱了LPS诱导的NF-κB转录活性,同时减弱了丝裂原活化蛋白激酶通路,表明其抗炎作用与NF-κB和分裂原激活蛋白激酶p38信号传导通路有关。
1.4 免疫调节作用
植物甾醇具有很好的免疫调节功能,Bouic等[43]在1996年首次肯定了β-谷甾醇和其糖苷混合物的免疫调节活性,通过体内外实验结果发现,受试马拉松运动员在摄取β-谷甾醇和其糖苷混合物后,CD3+和CD4+细胞增加,IL-6及皮质醇降低,炎症抑制较轻。同时,β-谷甾醇和其糖苷混合物能够调节T细胞活性,增强NK细胞的细胞毒性能力。Navarro等[44]发现β-谷甾醇能够抑制嗜中性细胞渗入组织,减少β-葡糖醛酸酶和超氧化物的产生,表明其体外调节活性与补体系统的经典途径密切相关。孟海波等[45]研究发现米糠甾醇能提高大鼠巨噬细胞的吞噬率、吞噬系数、碳廓清指数、促进B淋巴细胞增殖及分化,在中剂量及低剂量组中可观察到血清溶血素的释放增加,各剂量组大鼠脾脏指数均有提高,表明米糠甾醇对大鼠体液免疫改善有显著作用。通过预先对小鼠饲喂蒲公英甾醇,能显著降低由致死剂量LPS诱导的内毒性休克的死亡率,抑制炎性细胞因子(IFN-γ,IL-1β,IL-6,TNF-α)和介质(NO、前列腺素PGE2)分泌,并对肺组织损伤具有一定的预防作用[46]。
1.5 其它
除降胆固醇、抗肿瘤、抗炎和调节免疫活性外,食源性甾醇还有许多其他生理功能,例如抗氧化功效、表面活性剂、类激素等[47]。研究发现植物油富含的甾醇在煎炸条件下能保护油脂中的脂肪酸,使其不被氧化降解。燕麦油脂中分离出的Δ5-燕麦甾醇、Δ7-燕麦甾醇和β-谷甾醇等能够阻止不饱和脂肪酸在髙温条件下发生氧化降解[48]。
另外,甾醇还具有抑菌活性。研究发现玉米须甾醇能够明显抑制金黄色葡萄球菌、志贺氏菌、毛霉和青霉等生长[49]。其抑菌机制可能是玉米须甾醇能够使菌体体内电解质出现渗透,从而使细胞膜的通透性发生变化;细菌体内蛋白质的含量下降;还原糖的消耗速度变慢[49]。文冠果种仁甾醇同样表现出对细菌的可溶性蛋白质合成及还原糖利用能力的抑制作用,对四种微生物的抑制强度顺序为金黄色葡萄球菌>鼠伤寒沙门氏菌>枯草芽孢杆菌>大肠杆菌[50]。
2 在食品领域的应用
食源性甾醇在食品领域中的应用最早始于1995年,植物甾烷醇酯最早被应用于人工黄油的工业生产[51]。而我国在2002年颁布的《卫生部关于进一步规范保健食品原料管理的通知》中指出,植物甾醇作为保健食品的植物性原料中功能成分,被列为“可用于保健食品的物品”和“既是食品又是药品的物品”[52]。随着相关研究的不断完善,目前已有大量以食源性甾醇作为有效成分的功能性食品,按照分类又可分为油脂类、保健品以及饮品类(表2)。
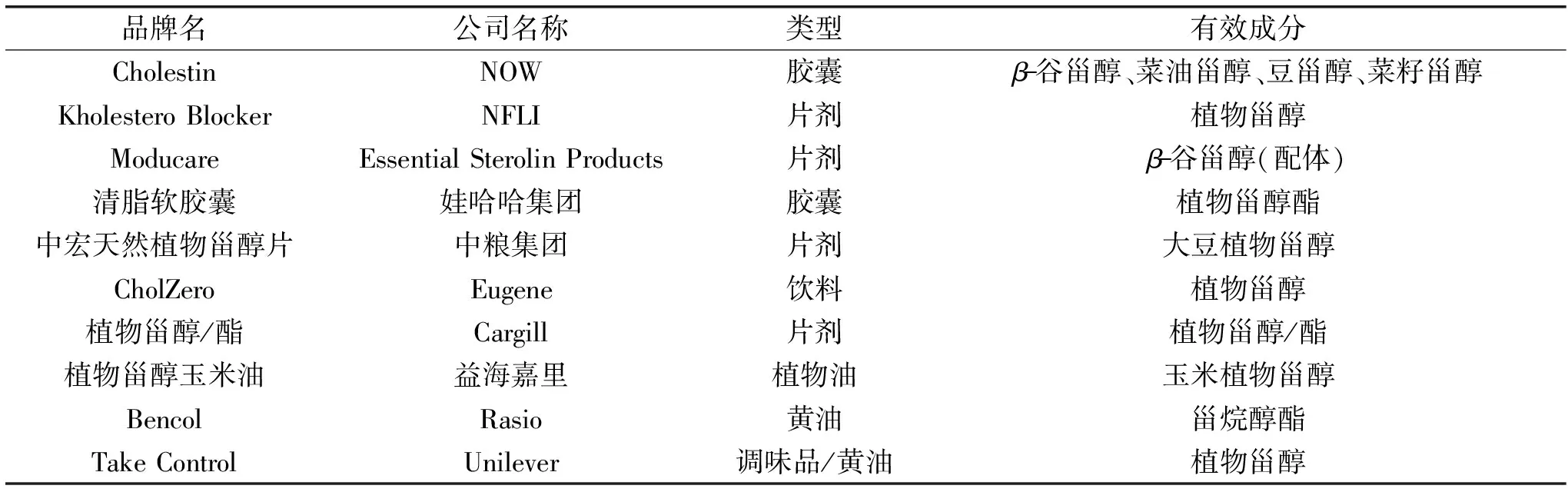
表2 以食源性甾醇作为活性成分的部分功能性食品Table 2 Partial functional foods with food-derived sterol(s)as active ingredients
然而,甾醇因其独特的物理性质几乎不溶于水且生物利用度相对较低[53];因此一般会将甾醇通过化学修饰如酯化后添加到产品中,其它方式如通过微胶囊化技术将其它物质作为载体如羟丙基-β-环糊精或乳清蛋白分离物、菊粉和壳聚糖的混合体系也能提高甾醇在水体系中的溶解程度[54-55]。目前已有向果汁、巧克力、发酵乳等添加植物甾醇类化合物的相关研究[56]。迄今除外源性甾醇类物质本身外,添加这类化合物的产品在储存期内相较于未添加的产品在主要营养成分的含量方面更加稳定。总体而言,植物甾醇及其衍生物的添加对产品营养价值和货架期的延长具有一定的积极作用。
目前,有关菌类甾醇应用于食品中的报道也在逐年增加。双孢菇甾醇提取物与麦角甾醇表现出与植物甾醇相似的抗氧化活性,能保护酸奶免受氧化,延长产品货架期[33]。此外,向发酵乳制品中添加姬松茸子实体的甾醇提取物能显著提高其抗氧化能力,而对其营养成分无明显影响[57]。
Grasso等[58]人发现添加植物甾醇后,火鸡肉质在剪切力、脂质氧化、L值和持水能力方面受到了显著影响,其感官差异、颜色、质地和风味的综合评价结果表明植物甾醇的添加对产品整体影响较小。购买意愿和支付意愿指标的数据显示,尽管甾醇添加后肉的感官评价弱于非添加肉,但在标明富甾醇的信息后该食品的可接受程度有显著提高,说明目前人们对于甾醇添加食品的接受程度也越来越高[59]。
3 结语
一般认为,植物油在食源性甾醇摄入来源中占据重要地位,除此之外,谷物、蔬果、菌菇类中都含有较为丰富的甾醇类物质。而在油脂加工废料如脱臭馏出物中甾醇含量较高,在工业生产上被作为甾醇提取的主要来源。食源性甾醇在自然界分布广泛,并且具有显著的生理活性,包括但不限于降胆固醇、抗癌、抗氧化能力等。目前对其活性的研究尚不够完善和深入,并且关于其生理活性的作用机理尚未完全阐明。因此通过更加完善的方式评估和验证其机理深入进行实验研究与临床数据的评价,才能进一步推动其在食品、医药甚至其他领域的更广泛应用。
另一方面,我国油脂产业规模较大,但同发达国家相比甾醇资源的开发利用方面相对落后,油脂及菌菇类生产加工废料的直接丢弃造成该资源的严重浪费。因此,合理高效地利用这类天然产物会是今后相关产业发展的一个方向。
