冷藏温度对振动胁迫下猕猴桃细胞膜脂氧化及活性氧成分的影响
2019-06-25吴琼,周然
吴 琼,周 然
(上海海洋大学食品学院,农业部冷库及制冷设备质量监督检验测试中心(上海),上海 201306)
商业运输中,公路运输是最重要的一种运输方式,而在运输易腐货物时最常用的是卡车运输[1]。在中国,猕猴桃、枇杷和梨等多采用长途运输,但由于冷链运输体系的不完善[2],运输过程中振动胁迫逆境会对运输货物产生损伤,造成商品货架期短、腐烂率高的现象,产生较大的经济损失。猕猴桃(Actinidia chinensis)又名奇异果,因果皮表面覆盖满绒毛而得名。猕猴桃具有极高的营养价值,果实中维生素C最高,素有“维生素C之王”的美称[2]。我国猕猴桃生产主要集中于陕西秦岭、河南伏牛山和湖南湘西山区等三个主要区域,种植面积和产量均为世界第一位[3]。
冷库贮藏是一种常用的食品保藏方法,温度一般在冰点以上,主要作用是尽量延缓它们的生理代谢进程,保持其新鲜度,常用来贮藏采后果蔬,被认为是最有效的方法之一。然而,也不是所有果蔬都能通过冷藏的方式来延长货架期,比如有些热带和亚热带水果及部分果蔬,如果在它们的冰点以上3~10 ℃内贮藏则极易发生冷害现象,这类果蔬被称为冷敏性果蔬,它们的果实细胞对低温(一般低于10~20 ℃)非常敏感,低温会破坏它们正常的生理活动,破坏内部细胞膜结构性,从而降低果蔬贮藏品质。除了低温温度及低温持续时间决定了果蔬是否会发生冷害,果蔬自身对低温的适应和应激能力也决定了冷害现象的发生与否[17]。目前国内外研究者对果蔬冷害机理虽已做了大量研究,但尚无定论。因此,探索猕猴桃在冷藏条件下品质变化机制,以寻找出其最适贮藏条件和控制方法具有重要的理论和现实意义。
振动胁迫是机械在运作的振动过程中对其承载的物体的胁迫作用,从而使物体发生某些程度上的变化。振动胁迫作用常出现在果蔬经长途从种植地运送至销售地的过程中,尤其是各种公路运输。振动胁迫涉及到水果果实的物理特性、成熟衰老机制、抗逆性机制等许多方面,因此振动胁迫在果品运输过程中造成的影响不可忽视。另外,由于猕猴桃是呼吸跃变型果实,为延长其销售货架期常需要在未完全成熟时采摘,若可以运用振动胁迫来催熟果实,就可以控制其成熟时间及成熟度,从而更好地食用猕猴桃。所以研究振动胁迫在果品采后生理和品质变化中的影响对于建立猕猴桃采后保鲜、运输方法、销售系统有着尤其重要的应用价值和现实意义。
近年来,各国科学家对水果运输过程中的影响有了深入的理解。肖丽娟等[4]通过模拟运输实验,研究振动对猕猴桃贮藏品质的变化。Behnam等[5]研究在运输过程中振动对果蔬的影响,对悬挂系统和行驶速度进行研究,得出了果蔬的运输过程中垂直方向的振动远大于水平的振动。本文以典型的后熟型水果猕猴桃为研究对象,通过测定研究不同贮藏温度下经相同振动处理后的猕猴桃果实品质特性、活性氧代谢及膜脂氧化等的变化规律,同时从细胞膜组织损伤造成细胞膜透性变化的角度出发,结合测定电解质外渗率的变化规律,为进一步探讨猕猴桃果实最适贮藏温度,探寻振动胁迫对猕猴桃果实品质影响机理,减少和防止猕猴桃果实发生冷害,降低和控制振动胁迫对猕猴桃果实贮藏品质造成的损伤提供理论和实验依据。
1 材料与方法
1.1 材料与仪器
“海沃德”猕猴桃 上海果园,七成熟,纸箱规格为50 cm×50 cm×24 cm的瓦楞纸箱,尽可能平稳地运至实验室,色泽相近,大小统一,成熟度一致,无病虫害,无人为损伤;甘露醇、三氯乙酸(TCA,AR)、硫代巴比妥酸(TBA,BR)、Tris-HCl缓冲液 上海沪试;聚乙烯吡咯烷酮(PVP) GR,上海沃凯化学试剂有限公司;邻苯三酚 Sigma-254002。
YSZD-YTF型振动台试验系统 上海毅硕实验仪器厂;UV2100型可见紫外分光光度计 上海尤尼柯仪器有限公司;JY30001型电子天平、CY-2型硬度计 河南华中化验仪器设备有限公司;H2050R台式高速冷冻离心机 湘仪离心机仪器有限公司;DDB-6200型电导率仪 上海精密科学仪器有限公司。
1.2 实验方法
1.2.1 处理方法与分组 有研究表明,运输中果蔬所受的振动胁迫有来自垂直、水平和前后运动三个方向[6],因此本试验的模拟振动中采取了垂直、水平加前后三个方向的三维振动方式来对猕猴桃进行振动胁迫处理。利用振动台设定输入振动频率,根据以往研究结果得出,运输振动处在低频的时候对果实品质影响程度最大[7]。并且,以往研究振动胁迫对果实品质影响的作用大多是用振动的加速度来表现,然而,无论以何种方式研究振动胁迫对果实品质的影响,最终造成的损伤都是以位移为表现形式的,所以本试验将以5 mm振动位移对猕猴桃果实的品质变化进行研究。频率的选定根据阳小成[7]的研究得出的结论,故选定3 Hz为本试验的振动胁迫处理频率。本文对猕猴桃的振动胁迫处理选定为振动10 h。
模拟振动台上根据实际包装,利用塑料网托包好猕猴桃果实,然后装入规格为瓦楞纸箱,每箱40个。
为了研究不同冷藏温度对采后海沃德猕猴桃果实品质特性、活性氧成分及细胞膜脂氧化的影响机制,温度的选择根据前人的研究总结得出,0 ℃是猕猴桃果实长期贮藏有可能会发生冷害的贮藏温度[17],而8 ℃是日常生活中人们家庭常用的冰箱贮藏水果的温度。将采收来的猕猴桃分为三组,每组63个猕猴桃,共189个。统一进行1h的振动胁迫处理后,分别贮藏于0、4、8 ℃的冷库中,冷库温度波动范围为±0.03 ℃,贮藏28 d,并每7 d测定一次指标。
1.2.2 失重率测定 三个冷藏组每组选择3个大小、外观、成熟度相同的猕猴桃,在贮藏期内进行5次失重率测定,作为平行样取平均值。
失重率(%)=(采收当天的质量-测量当天定时的质量)×100/采收当天的质量
1.2.3 硬度测定 参考秦宗权等[8]的方法。用硬度计检测,单果重复10次。
1.2.4 丙二醛(Malondialdehyde,MDA) 参照Wang等[9]的方法。取5.000 g果肉,冰浴研磨后,经4 ℃转速10000 r/min冻离心20 min得到上清液,取上清液分别在450、532、600 nm波长下测定光密度值。并按下式计算MDA含量。
MDA含量(μmol·g-1)=[6.45(ΔOD532-ΔOD600)-0.56×ΔOD450]×V×(A/a)/W
式(1)
式中:A-反应液总量(6.25 mL);V-提取液总量(15 mL);a-测定提取液量(0.25 mL);W-材料量(5 g)。
1.2.5 脂氧合酶(Lipoxygenase,LOX) 参考曹健康等[10]的方法。称取10 g果肉,加入0.5 g PVP(聚乙烯吡咯烷酮)以及0.05 mol/L磷酸缓冲溶液(pH=7.0),于研钵中冰浴研磨。置于4 ℃ 12000 r/min离心15 min,取上清液。测定酶提取液在234 nm处的吸光值并在15 s后开始记录变化值(每30 s记录一次,连续6次)。每组样品重复三次。并按下式计算酶活性。

式(2)
式中,ΔOD234-每分钟反应液吸光度的变化值;V-样品提取液总体积(mL);VS-所取样品提取液体积(mL);m-样品质量(g)。

式(3)
式中,n-根据标准曲线得超氧阴离子的物质的量(μmol);V-样品提取液体积(mL);Vs-使用的提取液体积(1 mL);t-样品与羟胺反应的时间(min);m-样品质量(g)。
1.2.7 过氧化氢(H2O2) 参考Chomkitichai等[11]的方法。称取5 g果肉,加入5 mL 1%(w/v)的三氯乙酸(TCA),于4 ℃冰浴研磨并12000 r/min离心20 min取上清液,与2.4 mL 10 mmol/L的磷酸钾缓冲液(pH7.0)和0.1 mL 1 mmol/L的KI混合。390 nm吸光度下,以H2O2做标准曲线,测定吸光度。标准曲线为y=0.6741x-0.0018,R2=0.991。
1.2.8 超氧化物歧化酶(Superoxide dismutase,SOD) 参考张中林等[12]的方法。取5.000 g果肉,加入Tris-HCl缓冲液在4 ℃下冰浴研磨后,置于4 ℃ 12000 r/min冷冻离心30 min,得到上清液。测其体积,并于4 ℃保存。测定并记录酶液在420 nm波长下吸光值。

式(4)
式中,ΔOD420-样品在420 nm处每分钟吸光值的变化值。
1.2.9 过氧化氢酶(Catalase,CAT) 参考Hong等[13]的方法。称取2.000 g果肉,移取10 mL 0.05 mol/L磷酸缓冲液(pH=7.0),于研钵中冰浴研磨后,4 ℃冷冻离心15 min得到上清液,即为酶提取液,4 ℃保存。在分光光度计上测定在240 nm处吸光度值以测定酶活性,重复三次。酶活性按下式计算。
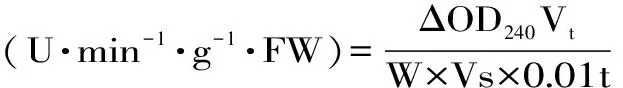
式(5)
式中,ΔOD240-吸光值的变化值;W-样品鲜重(g);t-反应时间(min);Vt-酶提取液总体积(mL);Vs-测定所用样品液体积(mL)。
1.2.10 电导率(Relative electrical conductivity) 电导率的测定方法按照Zhou等[14]的方法稍作修改。用14.5 mm的打孔器,对猕猴桃果实进行打孔,去皮后取质量约2.5 g果肉。在所取果肉中加入30 mL的甘露醇溶液(0.8 mmol)浸泡1 h后,用电导率仪测定第1次电导率值。测定结束后,将其沸水浴5 min,待冷却后放入测定第2次电导率值。相对电导率计算方法如下:

式(5)
1.3 数据处理
试验过程中,指标测定3次平行,数据间的Duncan法进行方差分析和多重比较差异性分析使用SPSS 20.0,使用Origin Pro V8.6软件绘制曲线。
2 结果与分析
2.1 不同冷藏温度对振动后猕猴桃果实失重率的影响
由图1可知,猕猴桃在冷温贮藏的过程中失重率逐渐增加,这是由于猕猴桃随着贮藏时间的增加,成熟度逐渐上升,果实处于衰老状态,果实失去较多水分,导致失重率增加。另外,可以从结果中看出,0 ℃贮藏下的猕猴桃失重率要高于4 ℃的,这可能是由于0 ℃贮藏下的猕猴桃果实随着贮藏时间的增加发生了冷害,冷害使得猕猴桃果实表面发生凹陷,果肉木质化,遂导致失去更多水分从而失重率增加。参考顾海宁等[15]研究方式,以失重率5%作为猕猴桃储藏期终点,同时从图1中看出,8 ℃贮藏下的猕猴桃在经过振动胁迫处理后,在贮藏中期14 d的时候失重率就已经达到了5%,而4 ℃贮藏下的猕猴桃在贮藏期最后28 d的时候失重率还未达到5%。说明冷藏温度影响猕猴桃失重率升高的顺序为8 ℃>0 ℃>4 ℃。

图1 冷藏温度对猕猴桃失重率的影响
2.2 不同冷藏温度对振动后猕猴桃果实硬度的影响
果实硬度是反映果实质地的重要指标,也是反映果实成熟衰老的重要指标之一[16]。本文的实验材料是七成熟的海沃德猕猴桃,属于猕猴桃中耐贮藏的品种之一,而七成熟的猕猴桃硬度达14~15 kg·cm-2[17],图2结果显示,猕猴桃硬度随着贮藏时间的延长而降低,而硬度变化呈现先快速下降后缓慢下降的趋势,这说明猕猴桃在贮藏的过程中,随着贮藏时间的延长,果实不断成熟软化。而从图2中也可以看出,8 ℃冷藏组的下降趋势均较0 ℃快,在28 d时,0 ℃冷藏下的果实硬度分别是4、8 ℃的1.54、2.38倍,这说明冷藏温度会显著影响猕猴桃在贮藏过程中的硬度(p<0.05),低温抑制生理软化,减缓猕猴桃的成熟衰老,其中经振动胁迫处理后8 ℃贮藏温度能使猕猴桃果实快速软化。

图2 冷藏温度对猕猴桃硬度的影响
2.3 不同冷藏温度对振动后猕猴桃果实MDA含量的影响
MDA含量的增加标志着植物细胞膜透性增加和被破坏[18]。由图3可见,贮藏过程中,猕猴桃的丙二醛含量逐渐上升。贮藏7 d后,8 ℃组猕猴桃的丙二醛含量高于0、4 ℃组的猕猴桃。丙二醛常用来作为植物细胞膜脂质过氧化的生化指标,可以反映植物细胞膜结构的完整性[19-20]。自由基作用于脂质产生的丙二醛会引起核酸、蛋白质等生命大分子的交联聚合,还会导致细胞膜的流动性和通透性发生改变,进一步造成细胞膜的结构和功能改变,所以具有细胞毒性[20]。由于猕猴桃在采摘后脱离母体正常的生长条件,在贮藏期间丙二醛的含量会随着时间的增长而增加。说明振动胁迫处理后的猕猴桃在冷藏温度下时,其组织会产生较多丙二醛,而0 ℃冷藏温度下猕猴桃果实产生的丙二醛量相对最少。在28 d,8 ℃下的猕猴桃果实细胞内MDA含量显著高于4 ℃组和0 ℃组(p<0.05)。
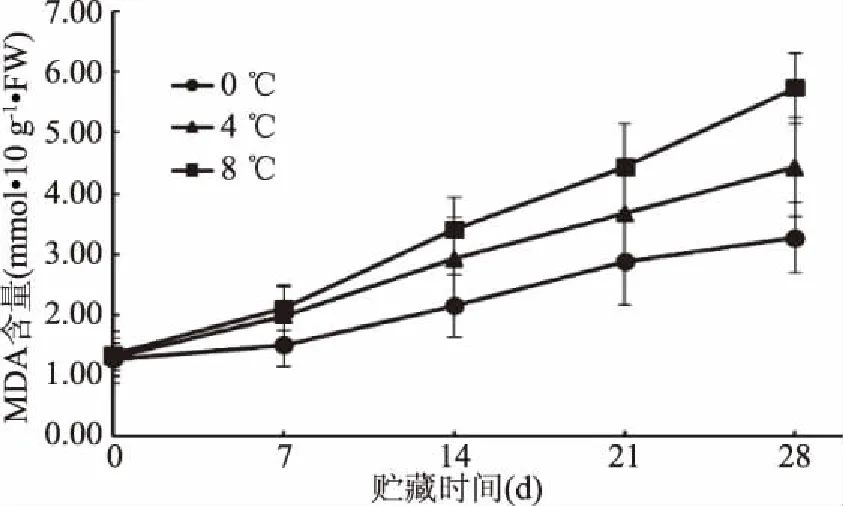
图3 冷藏温度对猕猴桃MDA含量的影响
2.4 不同冷藏温度对振动后猕猴桃果实LOX活性的影响
图4结果表明,随着贮藏时间延长LOX活性也不断升高。根据陈昆松等[21]的研究结果,20 ℃下贮藏果实的LOX活性随着后熟进程持续上升,其活性与果实硬度的变化呈极显著负相关;0 ℃贮藏果实中的LOX活性被强烈抑制,果实后熟软化进程被明显延缓,可知冷藏能够明显延长果实货架期。如图4所示,经振动胁迫处理后的猕猴桃LOX含量增长趋势相近,但是猕猴桃果实在各冷藏温度下的LOX活性始终是8 ℃>4 ℃>0 ℃。LOX活性随猕猴桃在贮藏过程中ROS含量水平的增加而增加。ROS通过提高LOX活性来诱导猕猴桃膜脂质过氧化,从而增加MDA含量[22]。实验结果说明较低的冷藏温度能够明显地延缓猕猴桃细胞被破坏的时间,减缓猕猴桃细胞损伤的程度,使得果实膜脂氧化变缓,从而达到猕猴桃果实保鲜的效果。

图4 冷藏温度对猕猴桃LOX活性的影响
2.5 不同冷藏温度对振动后猕猴桃果实产生速率的影响


图5 冷藏温度对猕猴桃产生速率的影响
2.6 不同冷藏温度对振动后猕猴桃果实H2O2含量的影响


图6 冷藏温度对猕猴桃H2O2含量的影响
2.7 不同冷藏温度对振动后猕猴桃果实SOD活性的影响
超氧化物歧化酶(SOD),在植物体内起着十分重要的抗氧化作用,它广泛分布在各种植物的体内[25]。SOD因其独特的生理活性担负着植物体内清除ROS的重要职责。在植物体内,SOD水平的高低象征着植物的衰老与死亡[26],在贮藏期内随着果实的成熟衰老SOD呈现先上升后下降的趋势,SOD活性上升到顶峰时,代表果实内抗氧化活动在此时最活跃。对三组冷藏温度下猕猴桃果实进行SOD活性测定的结果如图7所示,猕猴桃中SOD的活性随贮藏时间增加先升高后下降。从0 d开始三组温度的猕猴桃SOD的活性均升高,到储存14 d达到峰值,其中8 ℃下的猕猴桃SOD活性增长最迅速,14 d以后又开始下降。0 ℃组的SOD活性明显低于同时期8 ℃组的SOD活性(p<0.05),也略低于4 ℃组,且0 ℃下的果实内SOD活性变化幅度最小,推测在贮藏期间,果实可能发生了冷害,SOD活性被抑制,这对果实储存期间的抗氧化作用非常不利。

图7 冷藏温度对猕猴桃SOD活性的影响
2.8 不同冷藏温度对振动后猕猴桃果实CAT活性的影响
过氧化氢酶(CAT)是植物体内以H2O2为底物的酶,通过分解H2O2,降低因该自由基的积累对细胞膜造成的损伤,以此发挥其抗氧化作用,是植物防御体系的关键酶之一[27]。如图8所示,贮藏期间的猕猴桃CAT活性先增高后降低,再由图8和图7可知,CAT的活性变化趋势与SOD完全一致,这与冯武[30]研究结论一致。在冷藏温度下,猕猴桃中CAT活性在7 d上升到峰值,因CAT在植物体内的作用是催化分解H2O2,所以在H2O2产生速率最快的0~14 d也是CAT活性最高的时期。同一贮藏时间,8 ℃下的猕猴桃CAT活性均显著高于其他冷藏组(p<0.05)。结果表明,冷敏水果猕猴桃中CAT的活性对冷藏温度很敏感,并且随着温度的降低而活性降低。

图8 冷藏温度对猕猴桃CAT活性的影响
2.9 不同冷藏温度对振动后猕猴桃果实相对电导率的影响
电导率是评价细胞膜完整性的指标,在贮藏过程中,细胞膜遭到破坏后,细胞质渗出,导致电导率变化。相对电导率的大小体现了细胞膜渗透性的变化,在贮藏期间,随果实逐渐成熟衰老,细胞膜渗透性逐渐增大。在猕猴桃贮藏期间果实细胞电导率随着时间增加而逐渐升高,表示细胞破裂,细胞功能遭到破坏,细胞膜完整性降低,从而致使果实的衰老[28-29]。而由图9可见振动胁迫处理后的猕猴桃电导率上升速度8 ℃下的较0 ℃下的快(p<0.05),且8 ℃下猕猴桃的电导率一直高于另两组,表明较高的贮藏温度会导致猕猴桃电导率上升,且在未发生可见机械损伤时,也会加速细胞膜完整性的破坏,致使水果加速衰老。在28 d时,猕猴桃的细胞膜破坏,电导率渗透,而8 ℃贮藏下猕猴桃果实的相对电导率较上升更为显著(p<0.05)。

图9 冷藏温度对猕猴桃相对电导率的影响
3 结论
本研究发现,经振动胁迫处理后,猕猴桃在冷藏期间会产生抗逆反应,抗逆反应主要在于加速生理生化反应,促进酶活性,产生活性氧成分,进而破坏细胞膜完整性。试验通过测定LOX活性、MDA含量和相对电导率发现,LOX活性和MDA含量的变化趋势相同,相对电导率的升高又与ROS水平的增加相符。并且相对电导率的升高代表果实细胞膜渗透率升高,MDA是膜脂过氧化反应的生物标志物,推断出LOX会催化膜脂过氧化生成 MDA,果实氧化成熟导致了细胞膜被破坏。而LOX活性随猕猴桃在贮藏过程中ROS水平的增加而增加,所以ROS的产生能提高LOX活性来诱导猕猴桃膜脂质过氧化,从而使MDA含量增加。这也说明猕猴桃在贮藏期间膜脂不断被破坏,而实验结果表明适宜的冷藏温度能够抑制ROS产生,同时抑制LOX的活性,防止膜脂过氧化,从而抑制更多MDA的产生,保护细胞膜通透性。在这项研究中,猕猴桃中ROS的增加和过量产生都可能导致膜脂过氧化和膜的破坏,导致细胞破裂,电解质外渗,电导率不断增加,从而加速猕猴桃成熟腐烂,降低其货架期,导致经济损失。研究结果表明:贮藏期间,冷藏温度下猕猴桃果实呼吸乙烯被明显抑制,失重率升高,可溶性固形物含量升高,硬度降低,但在0 ℃和4 ℃下这些变化要比8 ℃下幅度小,说明冷藏减缓了猕猴桃的呼吸成熟机理。贮藏28 d时,0 ℃贮藏下的猕猴桃的电导率显著低于4 ℃和8 ℃(p<0.05),MDA的含量也不断增加且0 ℃下的增长最慢,脂氧合酶峰值0 ℃下最低,而活性氧产生也被明显抑制,其中0 ℃较4、8 ℃对猕猴桃细胞膜变化的抑制作用更为显著(p<0.05)。说明冷藏温度会影响猕猴桃贮藏期间的膜脂氧化,所以在采后运输过程中,尽量减少猕猴桃受到道路运输振动的时间,并且做好冷链运输措施,适宜的冷藏温度会延缓细胞膜完整性的破坏,最终延缓猕猴桃的成熟衰老。
通过研究不同冷藏温度下经振动胁迫后猕猴桃果实贮藏品质的变化机制,为采后海沃德猕猴桃果实寻找最适贮藏保鲜温度提供理论依据和应用参考,也为今后可以通过适度的振动胁迫处理来控制猕猴桃果实达到最适食用成熟度提供数据基础和可能性。
