三相萃取法纯化枸杞多糖
2019-06-25文沛瑶杜梦扬吉文丽
文沛瑶,杜梦扬,吉文丽,*
(1.西北农林科技大学林学院,陕西杨凌 712100;2.西北农林科技大学风景园林艺术学院,陕西杨凌 712100)
枸杞是一种传统的名贵药材,富含多糖、蛋白质、维生素等多种活性成分,枸杞多糖是枸杞中的主要活性成分,具有抗氧化、抗衰老、抗肿瘤,调剂免疫等功效[1]。枸杞多糖的提取纯化过程是其开发利用的一个关键步骤,高效的多糖提取纯化方法可提高枸杞资源的利用率。
多糖的传统纯化方法为乙醇沉淀法,此法虽能提取出大量的多糖,但是往往存在醇沉不彻底的缺点,致使原料利用率降低,其次醇沉过程也存在耗时长、乙醇使用量大等问题[2]。因此,寻求一种高效分离多糖的纯化方法显得十分必要。三相萃取技术常用于蛋白的分离纯化,若将其使用在枸杞多糖分离纯化方面,可有效避开醇沉工艺,使其提取优势更为明显。三相萃取法原理是通过在粗提液中加入无机盐和有机溶剂使其形成三相,上相为有机层,主要是色素、脂类等极性较小的物质,中间相为蛋白质层,下相为水层,主要是一些水溶性物质[3-6]。此外,体系中无机盐和有机溶剂都可回收,且具有操作简单、高效、体系容量大、可连续操作、条件温和等特点[3,6]。因此,三相萃取法可作为绿色高效纯化枸杞多糖的一种思路。
针对乙醇沉淀法的不足以及三相萃取法的特性,本文采用叔丁醇-(NH4)2SO4-提取液三相体系萃取枸杞多糖,探索多糖的萃取规律,为以后的工业化应用提供理论依据。
1 材料和方法
1.1 材料与仪器
枸杞 青海德令哈;无水乙醇、叔丁醇、(NH4)2SO4、苯酚、硫酸、芦丁、葡萄糖、盐酸、氢氧化钠、亚硝酸铝 均为分析纯,购于天津科密殴化学试剂有限公司;考马斯亮蓝G-250、牛血清蛋白 均购于上海索莱宝生物科技有限公司。
TU-1810紫外可见分光光度计 北京普析通用仪器有限责任公司;FA1204B电子分析天平 上海天平仪器厂;FX超声波清洗仪 济宁丰鑫超声设备有限公司;R213B旋转薄膜蒸发仪、SHB-3循环真空泵 上海申生科技有限公司;PHB-4 pH计、C-MAG MS4磁力搅拌器 上海精密仪器仪表有限公司;TGL-16M冷冻离心机 湘仪离心机仪器有限公司;WJX-200高速多功能粉碎机 上海缘沃工贸公司;FD8-3T立式冷冻干燥机 GOLD-SIM公司;TENSOR II傅里叶变换近红外光谱仪 德国Bruker Optics公司。
1.2 实验方法
1.2.1 枸杞多糖提取液的制备 将10 g干枸杞原料按料液比1∶30 (g/mL)加入蒸馏水,研钵捣碎,50 ℃下水浴搅拌提取30 min,连续提取3次,过滤,合并3次滤液,滤液经50 ℃、0.07 MPa下旋转蒸发仪浓缩至300 mL。浓缩液供三相萃取法和乙醇沉淀法分离多糖使用,其中乙醇沉淀法条件为四倍浓缩液体积乙醇沉淀24 h,得到枸杞多糖A。
1.2.2 三相萃取体系 取10 mL枸杞水提取液分别加入一定量的(NH4)2SO4,然后加入一定体积的叔丁醇配制所需三相体系。磁力搅拌5 min使两相充分混匀,调节pH至一定值,以4000 r/min离心5 min加速相分离过程,于一定的温度下静置60 min,分层如图1所示,上相主要为叔丁醇,含有部分黄酮以及一些色素,脂类杂质;中间相主要为蛋白质;下相主要是(NH4)2SO4和枸杞多糖[7],此时获得枸杞多糖B。使用移液器将三相各层的溶液分别吸出存于微量量筒中测定体积,测定完毕后用水稀释各相溶液,上相、中间相、下相检测指标分别为黄酮、蛋白质和多糖浓度。蛋白、多糖层通过分子透析除去无机盐后冷冻干燥用于红外光谱检测和抗氧化实验。

图1 三相体系萃取枸杞活性成分的分层情况
1.2.3 萃取条件的单因素实验
1.2.3.1 提取液中(NH4)2SO4添加量的确定 取10 mL提取液加入(NH4)2SO4使其质量浓度为10%、20%、30%、40%、50%后加入15 mL叔丁醇,在萃取温度为25 ℃,pH6条件下萃取60 min后测定各相的相应指标,考察提取液中(NH4)2SO4添加量对体系中三种化合物的萃取率影响。
1.2.3.2 叔丁醇添加量的确定 取10 mL提取液加入(NH4)2SO4使其质量浓度为20%后加入5、10、15、20、25 mL的叔丁醇,在萃取温度为25 ℃,pH6的条件下萃取60 min后测定各相的相应指标,考察叔丁醇添加量对体系中三种化合物的萃取率影响。
1.2.3.3 萃取温度的确定 取10 mL提取液加入(NH4)2SO4使其质量浓度为20%后加入10 mL的叔丁醇,在萃取温度为20、25、30、35、40 ℃,pH6的条件下萃取60 min后测定各相的相应指标,考察萃取温度对体系中三种化合物的萃取率影响。
1.2.3.4 萃取体系pH的确定 取10 mL提取液加入(NH4)2SO4使其质量浓度为20%后加入10 mL的叔丁醇,在萃取温度为35 ℃,pH4、5、6、7、8的条件下萃取60 min后测定各相的相应指标,考察萃取体系pH对体系中三种化合物的萃取率影响。
1.2.4 正交试验 根据单因素试验结果,选取影响较大的因素设计正交试验,确定最佳的萃取多糖的条件。
1.2.5 多糖、蛋白质、黄酮含量的测定 多糖含量检测采用苯酚硫酸法测定[1],蛋白质含量(由于中间层含量较少,可吸出稀释定容测定)检测采用考马斯亮蓝G-250 染色法[8],黄酮含量检测采用NaNO2-Al(NO3)3比色法[9]。


式中,Cc、Cp、Cf分别是提取液多糖、蛋白质、黄酮的浓度,V0是提取液体积;Ct、Cm、Cb分别是萃取液上相黄酮浓度,中间相蛋白质浓度,下相多糖浓度,Vt、Vm、Vb分别是上相、中间相、下相体积。
其中Cc=2.14 mg/mL,CP=0.46 mg/mL,Cf=0.37 mg/mL,V0=300 mL
1.2.6 红外光谱 分别取1.2.1中乙醇沉淀多糖(多糖A)和1.2.2下相中的多糖(多糖B),以10000 Da分子以上的多糖为研究对象,过10000 Da分子膜透析无机盐,截留后液体冷冻干燥24 h,条件为冻干制品温度-25 ℃,解析温度35 ℃,称取0.2 g冻干样品溴化钾压片后进行红外扫描,条件为扫描波长范围为4000~400 cm-1,分辨率为2.0 cm-1。
1.2.7 DPPH自由基清除活性的测定 分别取多糖A和多糖B过10000 Da分子膜透析后的冷冻干燥,称取0.2 g冻干样品加入10 mL水稀释用于测定其抗氧化活性。将2 mL的0.05~2 mg/mL不同浓度的多糖溶液与2 mL的0.25 mmol/L DPPH-乙醇溶液混合,混匀后静置30 min,以无水乙醇为参比,于517 nm处测定吸光值分别为A,维生素C为阳性对照[10]。每个样品三组重复,取平均值。样品对DPPH自由基的清除率则为:
DPPH自由基清除率(%)=(A1-A2)×100/A1
式中:A1为加入多糖溶液反应后的A值,A2为蒸馏水代替多糖样品液后的A值。
1.3 数据处理
上述方法中多糖、黄酮、蛋白质得率实验每组重复三次,取平均值,采用Excel软件作图,多糖的红外表征采用Origin 8软件作图。
2 结果与讨论
2.1 单因素实验


图2 (NH4)2SO4添加量对三相体系中枸杞多糖、蛋白质、黄酮萃取率的影响
2.1.2 叔丁醇添加量对体系中三种化合物的萃取率影响 与其他有机溶剂相比,叔丁醇更适合三相萃取体系,而且大多数关于三相萃取法分离蛋白质的有机溶剂都选用的是叔丁醇[3,12,14]。因此,本研究以叔丁醇为有机相,研究了其添加量对各个活性成分萃取效果影响。由图3可知,随着叔丁醇添加量的增加枸杞多糖的萃取率是先增大后减小,在叔丁醇添加量为10 mL时枸杞多糖的萃取率最大为92.73%。与此同时,可溶性蛋白质萃取率随叔丁醇的添加量增加而下降,在叔丁醇添加量为5 mL时萃取率最大为85.11%。这一现象可能是由于增加叔丁醇和(NH4)2SO4的含量引起相互作用的结果。然而叔丁醇的含量过低不利于三相体系的稳定性,使其成相困难,添加适量的叔丁醇可以增加沉淀蛋白的浮力,使蛋白质在中间阶段更加稳定,进一步降低了下相的可溶性蛋白质含量[13,15]。黄酮萃取率随着叔丁醇的添加量增加而增加,在研究范围内当添加量到25 mL时,其萃取率最大为80.75%。根据多糖萃取率最高的原则,体系中叔丁醇添加量为10 mL较为合适。
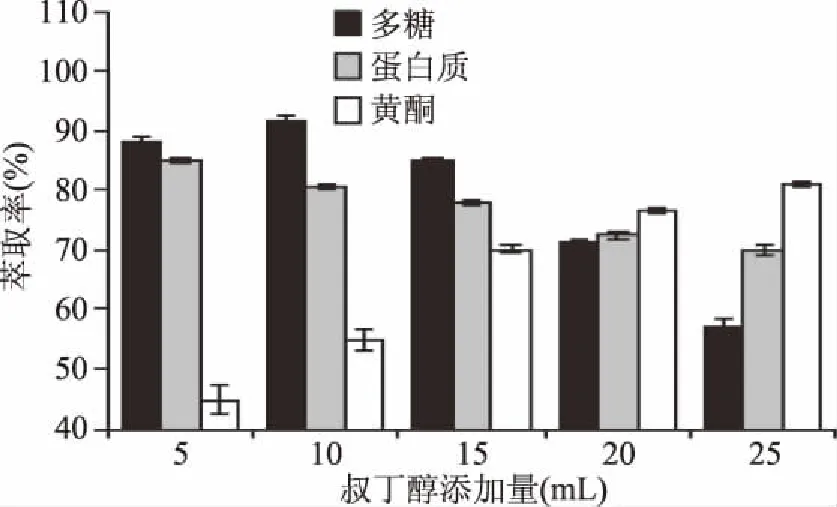
图3 叔丁醇添加量对三相体系中枸杞多糖、蛋白质、黄酮萃取率的影响
2.1.3 萃取温度对体系中三种化合物的萃取率影响 图4研究了温度在20~40 ℃范围内对各活性成分的影响,结果显示随温度增加多糖和蛋白质的萃取率先增大后减小,黄酮萃取率缓慢增加而且幅度不大,当温度为35 ℃时多糖萃取率最大为93.76%,30 ℃时蛋白质萃取率最大84.32%,40 ℃黄酮萃取率最大为53.80%。在较低的范围内升高温度有利于三相萃取体系的萃取效果,可能是因为随着温度的升高大量的羟基的暴露促进了更多的氢键或链接形成,从而使多糖的亲水性增强,从而在下相更集中[16]。因此综合考虑选择萃取温度为35 ℃为宜。

图4 萃取温度对三相体系中枸杞多糖、蛋白质、黄酮萃取率的影响
2.1.4 萃取体系pH对体系中三种化合物的萃取率影响 图5显示了pH对枸杞多糖和可溶性蛋白质、黄酮的萃取率影响,当pH从4~6时,多糖和可溶性蛋白质的萃取率在较低的阶段逐渐增加,并且pH为6时多糖到达最佳萃取率94.89%。然后随着pH的进一步增加到7时,蛋白质的萃取率最大为82.56%。黄酮在这一pH变化范围的萃取率变化较小,随着pH增大有轻微的降低趋势,在pH4时其萃取率最大为52.30%。调整三相萃取体系的pH可能会影响到离子化的大分子(尤其是蛋白质),从而改变它们的表面电荷[3,17],综合考虑,体系pH为6最为合适。

图5 萃取体系pH对三相体系中枸杞多糖、蛋白质、黄酮萃取率的影响
2.2 正交试验
根据单因素实验结果可知,各单因素的变化对三种化合物的萃取率都有一定的影响。综合考虑选10 mL提取液中(NH4)2SO4添加量、叔丁醇添加量、温度、萃取体系pH来设计四因素三水平正交试验。
从表1中可以看出,提取液中(NH4)2SO4添加量、叔丁醇添加量、温度、pH对三相体系萃取多糖都具有一定的影响,其影响因素大小顺序为提取液中(NH4)2SO4添加量、温度、叔丁醇添加量、pH。其最佳萃取条件是:A3B2C2D2,即:提取液中(NH4)2SO4添加量为30%、叔丁醇添加量为10 mL、温度为35 ℃、pH为6。

表1 正交试验的因素水平表Table 1 Factors and levels of orthogonal array design

表2 正交试验设计及结果Table 2 Design and results of orthogonal experiment
2.3 验证试验
根据正交试验确定的最佳萃取条件,进行3次平行试验,此时多糖的萃取率可达95.31%±0.72%,蛋白质萃取率可达83.45%±0.77%,黄酮萃取率可达50.66%±0.46%。
2.4 红外光谱
FTIR图谱显示,在3420 cm-1附近的吸收峰是糖类分子间或分子内的O-H 键伸缩振动[18],两种枸杞多糖的红外光谱很相似且具备多糖特征吸收峰,这说明两种多糖的结构基本一致[19]。1612 cm-1附近为羧基的羰基C=O伸缩振动,可能是羧酸或羧酸盐。1417 cm-1的峰是C-H变角振动峰。1073 cm-1附近处出现的强吸收峰是由C-O形成的伸缩振动区,该吸收峰是C-OH和吡喃环上的醚键C-O-C特征吸收峰,说明两种枸杞多糖中都存在吡喃糖苷键。在1017 cm-1的吸收峰是糖苷键C-O-C非对称伸缩振动,说明了多糖中都存在吡喃环构象[20]。蛋白质红外图谱中1530 cm-1附近处出现的峰是 N-H 变角振动的信号,表明红外光谱图具有酰胺结构的特征吸收峰,由此确认中间相萃取物为蛋白质[21]。
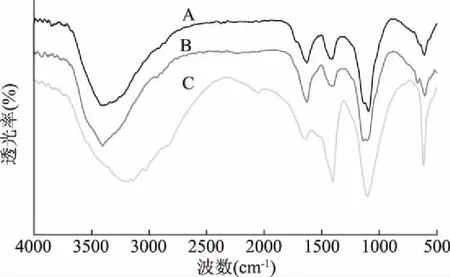
图6 枸杞多糖和蛋白质红外光谱图
2.5 DPPH自由基清除活性
DPPH自由基是一种稳定的自由基,甲醇溶液显紫色,自由基清除剂能够与DPPH的单电子被配对,在最大吸收波长处颜色变浅,吸光度也随之变小[22]。DPPH自由基清除率越高,说明其抗氧化能力越大。其抗氧化性如图7所示。

图7 多糖对DPPH自由基清除能力
图7为两种不同纯化方法所得不同浓度多糖的DPPH自由基清除活性。可以看出两种多糖均表现出较强的抗氧化活性,且随着糖浓度增高两者的自由基清除能力均有所增强。对比两种多糖可以发现在样品浓度为2 mg/mL时,三相萃取的多糖(多糖B)DPPH自由基的清除率为90.11%,醇沉多糖(多糖A)DPPH自由基的清除率为88.87%,这就说明两种方法所提取的多糖均具有良好的抗氧化活性。
3 结论
三相萃取法可在萃取枸杞多糖的同时一定程度上的分离水提液中的蛋白质和黄酮。本文研究了三相体系中的提取液中(NH4)2SO4添加量、叔丁醇添加量、萃取温度、pH这四个因素对三相体系萃取枸杞活性的效果的影响,优化条件发现提取液中(NH4)2SO4添加量为30%、叔丁醇添加量为10 mL、温度为35 ℃、pH为6时多糖的萃取率可达95.31%,蛋白质萃取率可达83.45%,黄酮萃取率可达50.66%。三相对其他传统的方法而言,此法的枸杞活性成分综合利用率、萃取率有了明显提高。三相萃取体系中的无机盐和有机溶剂都可以回收重复使用,但是最优的体系筛选和后续三相中的活性成分精制仍需进一步研究完善。因此三相萃取法分离纯化枸杞活性成分是一种具有前景的高效分离方法。
