制备过程中淀粉浓度对莲子回生淀粉理化特性的影响
2019-06-25陈钏杰郑宝东曾红亮
陈钏杰,李 欣,黄 莹,常 青,郑宝东,3,张 怡,3,曾红亮,3,*
(1.福建农林大学食品科学学院,福建福州 350002;2.福建省特种淀粉品质科学与加工技术重点实验室,福建农林大学,福建福州 350002;3.中爱国际合作食品物质学与结构设计研究中心,福建农林大学,福建福州 350002)
莲子为我国重要的特种经济作物之一,在东南亚地区及澳大利亚均有大规模种植,国内主要分布于东部沿海地区[1]。莲子淀粉是干莲子的主要构成成分,其质量可占莲子干重的50%,且直链淀粉在总淀粉中的含量可达40%,属于高直链淀粉[2]。高直链含量使其极易回生形成抗性淀粉。近年来,已有多篇文献证实莲子抗性淀粉对双歧杆菌等肠道益生菌的促生长作用[3]及促产酸作用[4],且不同组分的莲子抗性淀粉也在益生元作用上有所差异[5-6]。
众多研究表明水-淀粉比例对淀粉糊化回生具有重大的影响[7-9]。水分在糊化、回生过程中不仅可充当溶剂,也作为塑化剂使淀粉具有较大移动性[10]。国内外现有研究中,多数研究从结构、热焓变化方面着手探究水分对淀粉糊化、回生的影响,如回生过程中生成的双螺旋结构、结晶等有序结构以及热焓特性等性质[11]。而有关水分含量对回生淀粉理化特性影响的研究报道较少,且现有研究主要关注淀粉在不同水分条件下的回生特性及性质变化,而非回生淀粉在复水后的理化性质差异。根据人类食用习惯,多数消费者在食用加工类食品前习惯将食品通过蒸煮等方式重加工。这一过程使得食品中淀粉等物质的性质再次发生变化,进而影响到食品本身的性质,如粘度、硬度、咀嚼性等。因此研究淀粉质食品在回生复水后的性质尤为重要。
为弥补现有研究中对回生淀粉复水后特性研究的空白,本研究通过配制不同淀粉浓度的淀粉悬浮液,经糊化、老化、干燥制得莲子回生淀粉,并研究其热特性及复水后的理化特性,以期为今后的淀粉质食品加工提供一定的理论依据。
1 材料及方法
1.1 材料与仪器
速冻鲜莲 福建闽江源绿田实业投资发展有限公司。
DHG-9140A 烘干箱 上海精宏设备有限公司;MJ-54A高压灭菌锅 施都凯仪器设备(上海)有限公司;L530型台式离心机 湖南湘仪实验室仪器开发有限公司;TechMaster快速粘度测定仪(RVA) 波通瑞华科学仪器(北京)有限公司(瑞典perten);MCR301流变仪 奥地利安东帕公司;STA449C同步热分析仪 德国耐驰仪器制造有限公司。
1.2 实验方法
1.2.1 莲子淀粉的提取 莲子淀粉,于实验室条件下由速冻鲜莲中提取。提取方法参考曾绍校[2],并做轻微修改。简要流程如下:新鲜冻莲与蒸馏水以1∶1比例(g/g)混合后,经高速组织捣碎破碎,过100目筛滤网,静止6 h后弃上清液取沉淀,加水重复清洗沉淀,反复3次。经45 ℃烘箱烘干至水分含量<15%后,即得莲子淀粉。
1.2.2 莲子回生淀粉的制备 莲子回生淀粉的制备步骤参考自Zhang等[3]并做适当调整。取适量1.2.1所得莲子淀粉,添加不同比例蒸馏水,配制成不同比例莲子淀粉悬浮液,莲子淀粉∶水的比例(g/mL)分别为:5∶95、10∶90、20∶80、30∶70、40∶60、50∶50。悬浮液用食品级真空包装袋真空包装,防止加热过程的水分蒸发。包装后样品于高压灭菌锅中121 ℃加热30 min,使其充分糊化后,取出于室温下自然冷却6 h。转移淀粉糊至4 ℃冷藏冰箱中,回生24 h后取出。拆开包装将样品置于60 ℃烘箱中烘干24 h至样品水分含量小于15%,使用植物组织粉碎机粉碎并过100目筛,过筛后即制得回生淀粉样品。根据样品加工方法及制备过程中的固形物含量,将样品分别命名为RS5%、RS10%、RS20%、RS30%、RS40%、RS50%(其中RS指回生淀粉)。
1.2.3 热重分析 采用同步热分析仪进行莲子回生淀粉重热分析,分别取10 mg莲子回生淀粉于刚玉坩埚中,空坩埚为参比样,空气氛围下以10 ℃·min-1的升温速率从20 ℃升至600 ℃,研究样品热降解剩余质量比。
1.2.4 膨胀度及溶解度 膨胀度及溶解度方案参考Guo等[12]并稍作调整。分别称取莲子回生淀粉2 g于50 mL离心管中,加入40 mL蒸馏水后,分别于55、65、75、85、95 ℃下水浴30 min,水浴过程中间歇性振摇淀粉-水悬浮液,使水-淀粉接触均匀,时间间隔5 min。水浴结束后,置于室温下冷却至室温后于25 ℃下离心10 min,转速3000 r/s。小心倒出上清液于试管中,并置于105 ℃烘箱中烘干24 h后取出称重,称取固形物重量。下层沉淀直接称重。膨胀度及溶解度计算如下:
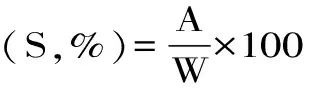
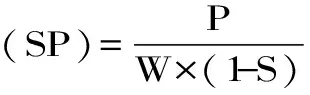
式中:A为上清液干重(g);W为样品干重(g);P为下层沉淀质量(g)。
1.2.5 快速黏度测定 采用快速黏度测定仪研究莲子回生淀粉的在温度变化过程中的黏度特性,分别称取莲子回生淀粉1.5 g于铝箔容器中,添加25 mL蒸馏水,温度程序设置参考Chen等[13]、Zaidul等[14]并稍作调整,具体如下:50 ℃恒温搅拌1 min后,恒速升温4 min至95 ℃,恒温95 ℃持续搅拌3 min后,3 min内恒速降温至50 ℃并维持2 min。
1.2.6 流变性质测定
1.2.6.1 样品前处理 取1.2.3所制得莲子回生淀粉1.5 g于烧杯中,加入25 mL蒸馏水,加入磁力搅拌转子于磁力搅拌器上100 ℃加热30 min使其成糊后,参考郭泽镔[15]、陈秉彦[16]方法进行流变特性扫描。
1.2.6.2 静态流变特性测试 选择锥形模具CP50-2,调用测试程序,取少量1.2.6.1所述淀粉糊于流变仪平板上,启动仪器,刮去溢出样品,设置平板温度为25 ℃,剪切速率由0~3×102s-1,观察表观粘度(η)及剪切应力随剪切速率(γ)升高过程中的变化情况。
1.2.6.3 动态流变特性测定 选择锥形模具CP50-2,选择测定程序,取少量1.2.6.1所述淀粉糊于流变仪平板上,启动仪器,刮去溢出样品,设置平板温度为25 ℃,角频率为6.28 rad/s进行振幅扫描,确定线性黏弹区后,选择线性黏弹区内某应变值进行频率扫描,频率扫描范围为0.1~628 rad/s。
1.2.6.4 糊化回生模型的建立 根据动态及静态流变性特性,采用ChemDraw绘图软件,将淀粉分为糊化及老化两个状态,根据分子链间形态,将淀粉链在不同水分含量下的回生行为可视化,建立回生模型图。
1.3 数据处理
所有测试平行测试3次取平均值。显著性分析由DPS数据处理系统完成,p<0.05。图片使用Origin 8.5完成。
2 结果与分析
2.1 热重分析
不同淀粉浓度条件下制备的莲子回生淀粉热重结果如图1所示,所有莲子回生淀粉在20~600 ℃范围内均显示出较为类似的重量变化趋势,样品失重开始于50 ℃前,并在600 ℃时样品剩余质量比均小于20%。根据其重量变化可将温度区间划分为4个区间,分别为20~150、150~280、280~350、350~600 ℃。其中20~150 ℃区间的质量下降主要为自由水等易挥发物质的受热挥发造成的质量损失[17],当温度升至150~280 ℃时,样品质量保持恒定,主要原因为挥发性物质在150 ℃后挥发殆尽,而淀粉等物质的热降解在280 ℃前尚未开始。为更好地对比淀粉等非挥发性物质的热分解,摘取原始数据中280及600 ℃的剩余质量比于表1中。280 ℃前损失的重量主要为水分及少数耐热性较弱的物质,由表1可知,280 ℃时回生淀粉的质量损失呈一定规律,RS20%、RS30%在280 ℃内的质量损失明显低于RS5%、RS10%、RS40%、RS50%,这可能与淀粉及水的状态有关,RS20%、RS30%中水分被淀粉结晶束缚于结晶结构中或与淀粉链结合形成较为热稳定的结构[18]。280~350 ℃内急剧下降,该现象被认为是样品中多数淀粉分子的热降解[19],淀粉在该温度区间内发生键断裂,主要为C-C-H、C-C、C-H淀粉降解为H2O、CO、CO2以及部分类似CH4、C2H4等物质[20]。350~600 ℃内,样品质量继续减少,可能为回生淀粉中较为稳定的结晶淀粉或淀粉脂质复合物及其他耐热物质的进一步热裂解。RS5%及RS40%在20~150 ℃区间失重最多,说明其含有较多水分等易挥发物质。研究表明:充分糊化的淀粉糊在水分含量超过90%时不易回生[21],则其淀粉链保持非晶状态,且其淀粉链因被水分子塑化而保持无序状态[22]。而RS50%在20~150 ℃区间的失重较少,说明其水分等易挥发物质含量较RS40%低,可能与其浓度过高不易糊化有关,这使得水分子进入淀粉中的程度较低,则内部水分含量少,而外部水分易在烘干过程中蒸发。RS20%在350~600 ℃区间的失重速率较其他条件下制得的回生淀粉快,这可能是由于其中含有较多的可热降解但较游离非晶淀粉耐热的结晶淀粉或大颗粒淀粉导致,说明20%含有较多相对热稳定组分。研究表明,淀粉的降解温度受淀粉结构及颗粒大小影响[23]。且在相同环境条件下,过高或过低淀粉浓度下均会抑制淀粉的回生,而适中的淀粉/水比例有助于淀粉糊的回生[24]。对于RS5%,RS10%、RS30%、RS40%、RS50%样品在350~600 ℃区间的质量损失曲线斜率几乎一致且比RS20%小。且所有样品的质量损失曲线在温度接近600 ℃时趋于平缓。可推测,当温度继续升高时,曲线最终将平行于X轴,所对应Y值为淀粉中灰分比例。

表1 莲子回生淀粉剩余质量损失Table 1 Residual mass loss of lotus seed retrogradated starch
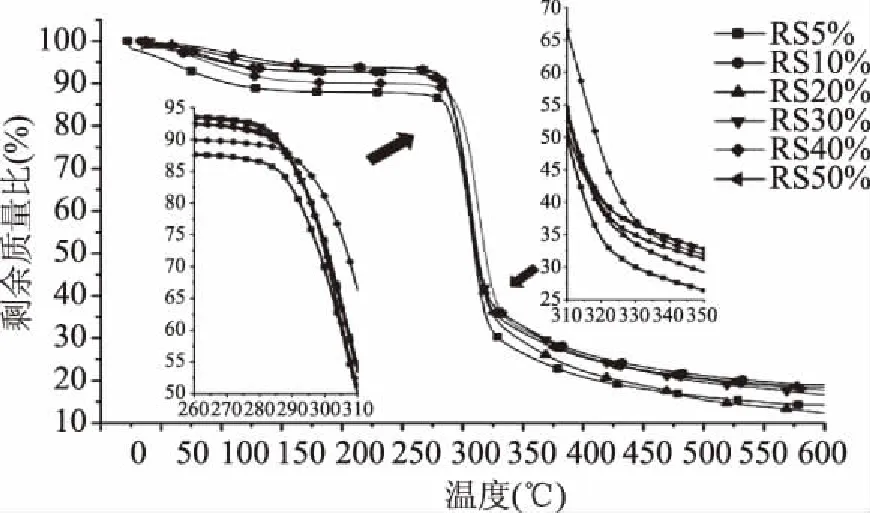
图1 不同淀粉浓度制备的莲子回生淀粉的热重曲线
2.2 膨胀度及溶解度分析
不同淀粉浓度条件下制备的莲子回生淀粉的膨胀度及溶解度如图2所示,由图2a中回生淀粉在不同温度下的膨胀度趋势分布可知,随着温度的升高,回生淀粉的膨胀度均随温度上升呈增长趋势,并在95 ℃时最大,与Chen等[13]的研究结果相似。由于淀粉膨胀是一个吸水的过程,与淀粉的伸展程度及淀粉链与水结合有关[25]。较低温度下,不充足的热量使得淀粉无法充分伸展,因此在55 ℃时,回生淀粉样品间差异不明显;随着温度的升高,淀粉伸展程度得到提升,因此其膨胀度提高。但是,RS30%、RS40%、RS50%的膨胀度及其随温度增长的幅度较RS5%、RS10%、RS20%小,这可能与回生淀粉制备过程中的淀粉链缠结程度有关。淀粉在高水分含量下糊化形成淀粉糊后,淀粉链被水分塑化,将使得淀粉链间距离大,抑制淀粉链的回生,即链间聚合并形成双螺旋结构的形成。相对独立的淀粉链在烘干复水过程中更易吸水膨胀,因此表现出较高膨胀度。反之,由于RS30%、RS40%、RS50%在制备过程中淀粉浓度较高,使得链伸展不充分,进而导致其在回生并烘干后形成较为致密的结构,且不利于淀粉的伸展及吸水膨胀,因此在高水分含量下制备的回生淀粉膨胀度较低。另外,RS5%膨胀度最高且受温度影响变化最快。根据Nara等[26]的研究结果表明糊化状态下的淀粉链在水分含量高于90%时不易形成凝胶网络。因此,RS5%的高膨胀度及对温度的高度依赖性与其过大的淀粉链间距离有关。
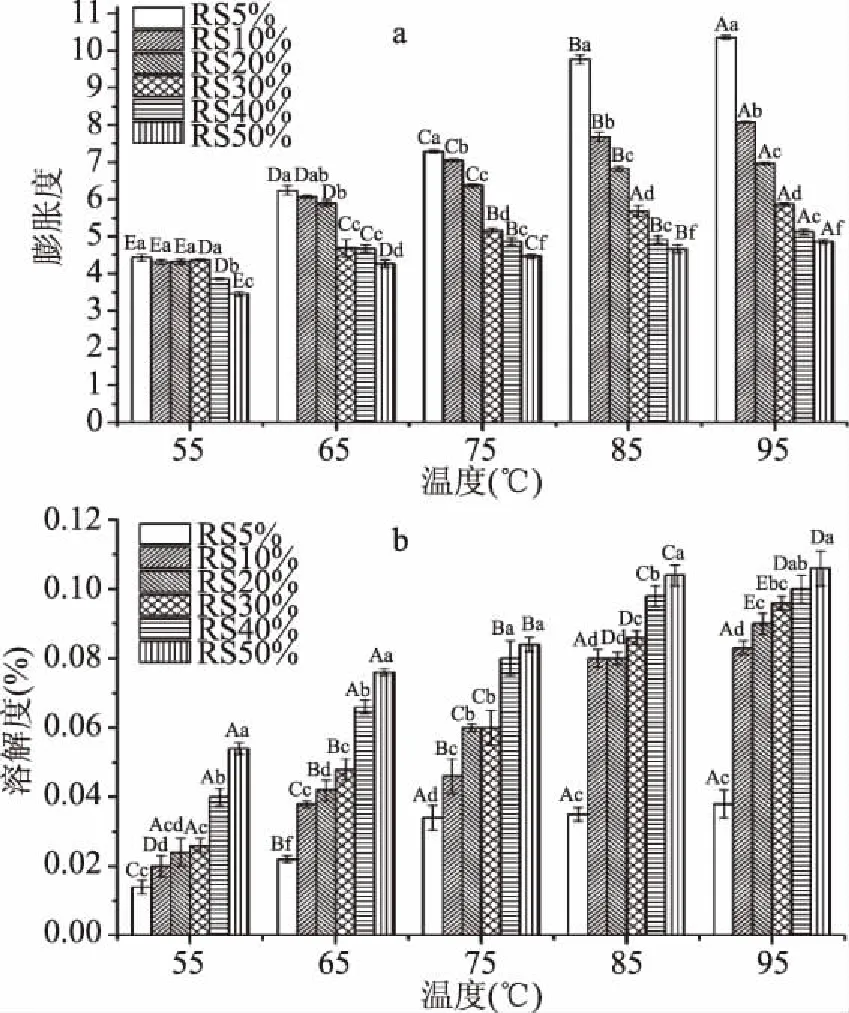
图2 不同淀粉浓度制备的莲子回生淀粉的膨胀度及溶解度
如图2b回生淀粉的溶解度在样品间差异显著且随温度增加,同一样品间也存在显著性差异,这可能与其回生过程有关系。研究认为,淀粉溶解度测定的主要为分散于淀粉颗粒无定型区中的直链淀粉[27]。另外,众多研究表明淀粉链的短期回生主要为直链淀粉的相互缠结形成双螺旋及进一步的有序结构-结晶[18]。与支链淀粉结晶不同的是,直链淀粉结晶较为耐热,其结晶在加热至100 ℃后仍可保持缠结有序结构。而在本研究中,样品均为经过24 h短期回生的莲子淀粉,尽管回生时淀粉浓度不同,但是都属于可回生范围。如图2b所示,莲子回生淀粉的溶解度随温度上升呈上升趋势,这与莲子回生淀粉随温度升高溶胀程度增加有关系,较高的膨胀度使更多的可溶性淀粉溶解于溶液中。除个别点间差异不显著外(75 ℃ RS20%、RS30;85 ℃ RS10%、RS20),不同莲子回生淀粉的溶解度在整体上规律如下:RS5% 不同浓度莲子回生淀粉在温度影响下的黏度变化情况如图3所示。低温时,样品间黏度差异不明显,当温度升高至约65 ℃后,样品间黏度开始出现较大差别。最终黏度在RS5%达到最大,且随制备时淀粉浓度增加而减小。该趋势与样品的膨胀度结果一致,主要影响因素仍为样品在制备过程中的链间缠结程度不同。同时,温度对淀粉链伸展的影响使得淀粉链在开始吸水膨胀,并有淀粉链溶解至水中形成凝胶网络,最终提高淀粉糊黏度[21]。淀粉黏度在温度上升至95 ℃后约3 min增长趋于平缓,并在降温过程中持续上升。该过程体现了淀粉链随温度变化而呈现出的在淀粉-水体系中的排列状态,65~95 ℃的黏度升高是由于回生淀粉颗粒的受热吸水膨胀,淀粉链由颗粒向水相中伸展[29]。95 ℃恒温阶段的黏度升高是由于淀粉链的持续吸热吸水膨胀,而其增长速率的较小是由于淀粉链在膨胀后经过一段时间的剪切使得淀粉链在悬浮液中的排列趋于有序。95~50 ℃的黏度上升是由于温度降低使得淀粉链间活化能过高,淀粉链趋向于相互靠近形成热力学稳定的体系,因而使淀粉链间接触增加,黏度随之增加[30]。最终样品间的黏度差异性较为明显,RS5%、RS10%由于链间缠结程度较弱导致淀粉链复水后易溶出,增加了淀粉链的触碰摩擦,因而表现出较高的黏度,RS20%由于形成较多结晶而表现出较RS5%、RS10%低的黏度;RS30%、RS40%、RS50%、由于糊化不完全而形成较为致密的结构,导致淀粉链的溶出困难,因而表现出较低的黏度,且随样品制备浓度的升高黏度减小。 图3 不同淀粉浓度制备的莲子回生淀粉的RVA黏度曲线 2.4.1 静态流变特性 不同水分浓度下制备的莲子回生淀粉的静态流变学特性如图4所示,该图揭示了莲子回生淀粉在1×100~3×102s-1剪切速率下黏度随剪切速率的变化。由图可知,本研究中所有莲子回生淀粉在剪切速率由1×100s-1增长至3×102s-1过程中均表现出剪切黏度下降,即剪切稀化现象。这说明本研究中所有莲子回生淀粉均为假塑性流体[31],该现象的产生是由于剪切过程中分子有序排列导致的。回生淀粉受剪切速率影响表现出与RVA不同的分布顺序。RS5%、RS10%、RS20%黏度明显高于RS30%、RS40%、RS50%。其中,RS5%在不同剪切速率下均表现出最高的黏度,这与其较分散的链分布有关系。在5%淀粉浓度下,由于淀粉链不易回生,导致较多数淀粉链保持自由状态,增大了链间摩擦的几率,因此剪切黏度较大。同理,由于淀粉链分散程度不同使RS10%黏度大于RS20%黏度。与RS5%、RS10%、RS20%不同的是,RS30%、RS40%、RS50%的剪切黏度较低,且RS50%>RS40%>RS30%。这可能与其在糊化回生过程中直链淀粉不易溶出及支链淀粉侧链间的交缠有关系,淀粉浓度越高,直链淀粉越不易溶出,直链淀粉-支链淀粉及支链淀粉-支链淀粉间交缠的概率越大[32]。同时,在流变测试前的复水过程中,由于RS50%吸水膨胀较少,链间交缠较为紧密,所形成的凝胶网络相对于RS40%及RS30%强,因此表现出较高的黏度[33]。但是与RS5%、RS10%、RS20%等淀粉链伸展充分且分布较为分散的回生淀粉相比,RS30%、RS40%、RS50%的剪切黏度不及低淀粉浓度下制备的莲子回生淀粉。 图4 不同淀粉浓度制备的莲子回生淀粉的剪切黏度曲线 2.4.2 动态流变特性测试 通过振幅扫描确定线性黏弹区。经测试,不同水分浓度下制备的莲子回生淀粉的线性黏弹区均分布在应力为0%~4%。因此,选取应力为2%进行下一步的频率扫描,观察莲子回生淀粉在2%应力条件下随频率变化表现出的流变特性。如图5a所示,不同淀粉浓度条件下制备得到的莲子回生淀粉的储存模量G′(又称弹性模量)在角频率低于10 rad·s-1时基本不随频率变化而变化,弹性模量保持不变。当频率高于10 rad·s-1时,莲子回生淀粉表现出两种不同的弹性模量变化趋势,RS5%、RS10%、RS20%的储存模量(弹性模量)随角频率升高而下降,而RS30%、RS40%、RS50%的弹性模量随角频率升高而升高。这可能与样品性质有关系,2.2及2.3中结果表明RS5%、RS10%、RS20%与RS30%、RS40%、RS50%存在本质性差别,前者样品在制备过程中淀粉链相对分散,而后者相对紧密且直-支、支-支链间交缠程度较高。该样品特性导致淀粉样品在复水后表现出不同的低频弹性模量,主要由于相对分散的淀粉链在复水后更易形成淀粉凝胶,而淀粉链交缠程度高的样品不易形成淀粉凝胶,从而样品间表现出不同的凝胶强度,即弹性模量差异。RS30%、RS40%、RS50%在高频下表现出的弹性模量升高可能与其较为紧密的交缠结构在高频剪切下被破坏有关,这使得淀粉溶出量增加,淀粉凝胶结构增强,因此表现出刚性增加。由图5b可知,随着角频率的升高,不同淀粉浓度条件下制备得到的莲子回生淀粉的损失模量G″(又称黏性模量)均表现出一致的升高趋势,即其黏性模量上升。 图5 不同淀粉浓度制备的莲子回生淀粉的频率扫描曲线 整体而言,RS5%、RS10%、RS20%的黏性(由损失模量G″体现)仍高于RS30%、RS40%、RS50%的黏性。该现象与储存模量中不同样品间的差异现象一致,因此其原因也与RS5%、RS10%、RS20%相对分散的淀粉链分布及RS30%、RS40%、RS50%较为紧密的结构有关。另外,RS20%受频率变化影响较小,且其黏性模量高于其他样品。热重分析结果显示RS20%在350~600 ℃表现出较其他回生淀粉高的降解率,因此该流变现象可能与其有利于淀粉回生的特性有关,进而使其结构发生变化。对比稳态流变特性测试,频率扫描时莲子回生淀粉表现出的黏性规律与剪切速率扫描所表现出的黏性规律略有差异。这与测试本身的原理及样品多方面性质对测试项目的影响程度有关[34]。 本研究中淀粉-水体系在不同比例下的糊化、回生可由图6表示。水分含量5%、10%、20%有利于淀粉的完全糊化,分子链间相对分散,并且对淀粉链的移动性产生较小阻力,而20%由于淀粉链接触机会较大,因此易于淀粉链间双螺旋及结晶的形成。水分含量30%、40%、50%由于淀粉浓度较低,对淀粉完全糊化、直链淀粉溶出及淀粉链的移动性表现出不同程度上的限制,因此较不利于回生。由此可知,RS20%在高温下的降解较多与其回生形成较多淀粉结晶有关;样品间膨胀度、溶解度的差异与淀粉在不同浓度溶液中糊化是否完全有关系,同时该结果也受淀粉链回生形成不易膨胀的结晶等有关系。而不同水分含量下制备的回生淀粉的流变特性也受到其分子链在不同淀粉-水体系的分散度、紧密度等影响。 图6 不同淀粉-水体系在糊化老化过程中的微观结构示意图 随着制备时淀粉浓度的增加,所制得的莲子回生淀粉在TGA测试中呈现差异性,其中RS5%、RS40%含有较多水分等易挥发物质,RS20%含有较多耐热物质。快速黏度测试中样品黏度随制备浓度增加呈递减趋势。同一淀粉样品的膨胀度及溶解度均随温度升高而增加;相同温度时,随制备浓度的上升,样品膨胀度减小,溶解度减小。静态流变结果表明,所有样品均表现出剪切稀化现象;相比于高淀粉浓度下(30%~50%)制备的回生淀粉,低淀粉浓度下(5%-20%)制备的回生淀粉在不同剪切速率下的黏度均较高,黏度大小顺序为RS5%>RS10%>RS20%>RS50%>RS40%>RS30%。动态流变结果表明,当角频率小于10 rad·s-1时,所有样品的储存模量均不受角频率影响;当角频率大于10 rad·s-1时,RS5%、RS10%、RS20%的储存模量随角频率增加呈下降趋势,而RS30%、RS40%、RS50%储存模量呈上升趋势。在测试范围内,所有样品的损失模量均随角频率升高呈上升趋势。综上可知,莲子淀粉回生行为受到回生过程中淀粉浓度的影响,其中水分含量为5%、10%、20%时有利淀粉链的分散及回生过程中的重新排列,而30%、40%、50%不利于淀粉链的分散,因此两组样品在理化性质上呈现差异。2.3 快速黏度分析

2.4 流变性质分析


2.5 莲子淀粉在不同淀粉-水体系中的糊化及老化模型

3 结论
