迷迭香多酚提取工艺响应面优化及抑制李斯特菌活性研究
2019-06-25耿敬章
耿敬章
(陕西理工大学 生物科学与工程学院,陕西 汉中 723000)
迷迭香属于唇形科的芳香植物,具有丰富的使用价值[1,2],在我国云南、贵州、广西、海南等地有种植。迷迭香是一种名贵的天然香料植物,在生长季节会散发一种清香气味[3,4]。迷迭香是西餐中经常使用的香料,经常使用在牛排、土豆等料理以及烤制品中。同时,迷迭香还被广泛用于医药、油炸食品、食品保鲜等[5,6]。研究表明,这些功能主要与迷迭香化学成分中的酚类和挥发油类有关[7]。迷迭香提取物中除了有熊果酸、α-蒎烯等物质外,还有鼠尾草酚、鼠尾草酸、迷迭香酸、迷迭香酚等二萜酚类物质。其中,二萜酚类物质具有明显的抗微生物活性,在抗菌、消炎方面发挥巨大作用[8]。李斯特菌存在于绝大多数食品中,肉类、蛋类、海产品、蔬菜等都已被证实是李斯特菌的感染源[9-11]。因此,本文研究迷迭香多酚提取工艺及其抑制李斯特菌活性,以期对迷迭香多酚资源进行深层次挖掘和利用。
1 材料及方法
1.1 原料与试剂
迷迭香:购于当地中药材批发市场;乙醇、没食子酸、福林酚试剂、碳酸钠、石油醚等:中国医药(上海)化学试剂公司;胰蛋白胨大豆肉汤(TSB)、胰蛋白胨大豆琼脂(TSA):上海缘肽生物技术有限公司;单增李斯特菌种:省农科院提供;其他试剂均为分析纯。
1.2 实验仪器与设备
电动搅拌机 江西安亭仪器设备厂;HZX-JA100电子天平 北京新阳仪器设备有限公司;DK-8D超级水浴锅 华立设备公司;721G型可见分光光度计 上海精密科学仪器有限公司;循环真空泵 天津贝纳仪器设备有限公司;超声波发生仪 北京天辉化工设备有限公司;旋转蒸发仪、真空干燥箱 安徽高博科学仪器有限公司。
1.3 实验方法
1.3.1 迷迭香多酚提取工艺流程
迷迭香干叶→筛选→鼓风干燥→粉碎→筛分→乙醇→超声波提取→滤渣再提取→合并滤液→萃取→浓缩→真空干燥→迷迭香多酚提取物[12]。
1.3.2 指标测定
总酚含量:Folin-Ciocalteu法测定总酚含量[13]。
提取率=(C×V/m)×100%。
式中:C为提取液总酚含量,mg/mL;V为体积,mL;m为原料质量,g[14]。
1.3.3 迷迭香多酚抑制李斯特菌活性实验
TSB培养基接种单增李斯特菌,37 ℃ 200 r/min摇床培养24 h,然后离心,添加生理盐水,获得200 CFU/mL菌悬液备用。用移液器吸取迷迭香多酚菌悬液到TSA培养基,然后涂布均匀,再加1%吐温80,稀释为200,100,50,25,12.5,6.25 mg/mL 6个梯度。以1%吐温80为空白对照实验,测抑菌圈直径,平行实验3次[15-17]。
2 结果与分析
2.1 液料比对提取迷迭香多酚的影响
设定提取迷迭香多酚其他各因素条件,选取6,10,14,18,22,26 6个水平的液料比提取迷迭香多酚,检测迷迭香多酚。有效成分提取的过程实质是一个传质过程,因此操作条件中的液料比对提取效果至关重要[18]。

图1 液料比对提取迷迭香多酚的影响Fig.1 Effect of liquid-material ratio on the extraction of rosemary polyphenols
由图1可知,液料比小于18时,提取率逐渐提高,这是因为迷迭香多酚不断从固体原料向液体溶剂传质,溶剂的渗透和有效成分的溶解进行较快。当液料比为18时,迷迭香多酚提取效果较好,提取率达到最大。当液料比大于18时,提取率反而降低,这可能是因为较高的液料比增加了传质推动力,使得提取效果下降。同时使用大量的溶剂会对实验后处理操作造成负担。因此,综合考虑,迷迭香多酚提取过程中,液料比为18较为适宜。
2.2 乙醇浓度对提取迷迭香多酚的影响
设定提取迷迭香多酚其他各因素条件,选取50%、55%、60%、65%、70%、75% 6个水平的乙醇浓度提取迷迭香多酚,检测迷迭香多酚。乙醇作为一种极性较强的溶剂,能提取出极性强或极性较弱的有效物质[19]。乙醇浓度的变化能影响提取物密度、黏度、介电常数等物理性质,进而影响提取率。

图2 乙醇浓度对提取迷迭香多酚的影响Fig.2 Effect of ethanol concentration on extraction of rosemary polyphenols
由图2可知,迷迭香多酚的提取率随乙醇浓度的提高先增大后减小。当乙醇浓度分别为50%、55%时,迷迭香多酚提取率逐渐提高,当乙醇浓度提高到60%时,迷迭香多酚提取率达到最高,说明乙醇对提取多酚效果较好。当乙醇浓度大于60%时,迷迭香多酚提取率反而下降,这可能是由于其他一些弱极性成分溶出量增加,减缓了酚类物质向乙醇溶剂的扩散。因此,迷迭香多酚提取过程中,乙醇浓度为60%较为适宜。
2.3 超声波功率对提取迷迭香多酚的影响
设定提取迷迭香多酚其他各因素条件,选取200,250,300,350,400,450 W 6个水平的超声波功率提取迷迭香多酚,检测迷迭香多酚。超声波辅助提取是天然产物中有效成分提取的一个好方法,它操作简单,节省能耗,提取效果有保证[20]。

图3 超声波功率对提取迷迭香多酚的影响Fig.3 Effect of ultrasonic power on extraction of rosemary polyphenols
由图3可知,随着超声波功率提高,迷迭香多酚提取率呈先上升后下降的趋势,当超声波功率为350 W时,迷迭香多酚提取率达到最高。这是由于随着超声功率提高,超声波引起的“空化效应”加强,迷迭香多酚渗透速率加快。但是,当超声波功率大于350 W时,高压环境致使迷迭香多酚的结构受损,且杂质溶出严重,导致迷迭香多酚提取率降低。因此,迷迭香多酚提取过程中,超声波功率为350 W较为适宜。
2.4 超声波时间对提取迷迭香多酚的影响
设定提取迷迭香多酚其他各因素条件,选取10,20,30,40,50,60 min 6个水平的超声波时间提取迷迭香多酚,检测迷迭香多酚。

图4 超声波时间对提取迷迭香多酚的影响Fig.4 Effect of ultrasonic time on extraction of rosemary polyphenols
由图4可知,超声时间低于40 min时,迷迭香多酚提取率逐渐上升,当超声波时间为40 min时,提取率最大,之后逐渐下降。这可能是因为超声提取开始时,细胞破碎逐渐增加,因此迷迭香多酚含量不断提高。当超声40 min后,超声时间过长,迷迭香多酚已基本溶出且部分被损坏,所以提取率下降。因此,迷迭香多酚提取过程中,超声波时间为40 min较为适宜。
2.5 迷迭香多酚提取工艺条件优化实验

表1 响应面优化提取条件的因素和水平 Table 1 Factors and levels of optimizing the extraction conditions by response surface methodology

表2 迷迭香多酚提取条件实验结果Table 2 Experimental results of extraction conditions of rosemary polyphenols

续 表
由表1可知,迷迭香多酚提取条件中,液料比、乙醇浓度、超声波功率、超声波时间对结果影响显著。以下为提取率二次回归拟合方程:
提取率(%)=4.22—0.065A-0.10B+0.50C+0.080D-0.028AB-0.10AC-0.095AD-0.42BC+0.016BD+0.086CD-0.50A2-0.16B2-0.57C2-0.45D2。
式中:A是液料比,B是乙醇浓度,C是超声波功率,D是超声波时间。迷迭香多酚提取条件实验结果见表2,响应面实验结果分析见表3。

表3 响应面实验结果分析Table 3 Analysis of experimental results of response surface methodology
注:若“Prob>F”<0.05,表示因素为显著因素。
迷迭香多酚提取实验失拟项不显著,P值为0.8867,模型极显著,P值<0.0001,所以能对提取迷迭香多酚的条件进行预测。得到迷迭香多酚提取的最佳条件为液料比15,乙醇浓度56%,超声波功率376 W,超声波时间38 min。

图5 液料比和乙醇浓度的相互作用Fig.5 Interaction between liquid-material ratio and ethanol concentration
由图5可知,液料比与乙醇浓度的相互作用对提取迷迭香多酚的影响显著,随着液料比与乙醇浓度的增大,提取率先增后减,变化幅度不大。

图6 液料比和超声波功率的相互作用Fig.6 Interaction between liquid-material ratio and ultrasonic power
由图6可知,液料比与超声波功率的相互作用对提取迷迭香多酚的影响显著,随着液料比与超声波功率的提高,提取率先增后减,变化幅度较大。

图7 液料比和超声波时间的相互作用Fig.7 Interaction between liquid-material ratio and ultrasonic time
由图7可知,液料比与超声波时间相互作用对提取迷迭香多酚的影响显著,随着液料比与超声波时间的提高,提取率先增后减,变化幅度不大。

图8 乙醇浓度和超声波功率的相互作用Fig.8 Interaction between ethanol concentration and ultrasonic power
由图8可知,乙醇浓度与超声波功率的相互作用对提取迷迭香多酚的影响显著,随着乙醇浓度与超声波功率的提高,提取率先增后减,变化幅度较大。
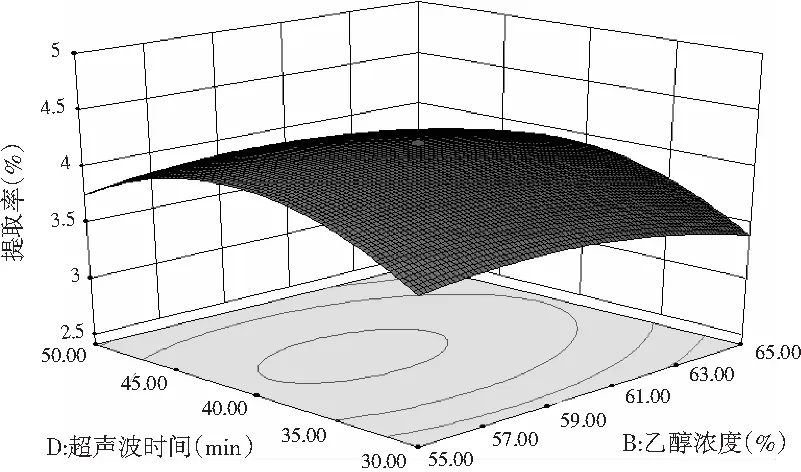
图9 乙醇浓度和超声波时间的相互作用Fig.9 Interaction between ethanol concentration and ultrasonic time
由图9可知,乙醇浓度与超声波时间的相互作用对提取迷迭香多酚的影响显著,随着乙醇浓度与超声波时间的提高,提取率先增后减。

图10 超声波功率和超声波时间的相互作用Fig.10 Interaction between ultrasonic power and ultrasonic time
由图10可知,超声波功率与超声波时间的相互作用对提取迷迭香多酚的影响显著,随着超声波功率与超声波时间的提高,提取率先增后减。
2.6 验证
设计表4来验证响应面优化得到的提取迷迭香多酚的最佳条件的可靠性。

表4 结果验证Table 4 Verification of results
由表4可知,实验4的提取率最高,因此提取迷迭香多酚的最佳条件是液料比15,乙醇浓度56%,超声波功率376 W,超声波时间38 min。
2.7 迷迭香多酚抑制李斯特菌活性结果

图11 迷迭香多酚抑制李斯特菌活性结果Fig.11 Results of antibacterial activity of Listeria monocytogene by rosemary polyphenols
由图11可知,迷迭香多酚提取物是抑制李斯特菌的有效物质,且抑菌程度有所不同[21-23]。随着迷迭香多酚提取物浓度逐渐提高,抑菌圈直径逐渐增大,当浓度为200 mg/mL时,抑菌圈直径达到最大。这可能是因为迷迭香多酚损伤李斯特菌的细胞壁和细胞膜,又或者是影响了李斯特菌的呼吸能量代谢,甚至影响了李斯特菌的DNA,进而抑制了李斯特菌的活性[24,25]。
3 结论
响应面优化提取迷迭香多酚的实验模型和实际情况拟合度比较好,结果可用,迷迭香多酚提取的二次回归拟合方程如下:提取率(%)=4.22—0.065A-0.10B+0.50C+0.080D-0.028AB-0.10AC-0.095AD-0.42BC+0.016BD+0.086CD-0.50A2-0.16B2-0.57C2-0.45D2(式中:A是液料比,B是乙醇浓度,C是超声波功率,D是超声波时间)。迷迭香多酚提取的最佳条件是液料比15,乙醇浓度56%,超声波功率376 W,超声波时间38 min。
迷迭香多酚能在一定程度上抑制李斯特菌的活性,且随着迷迭香多酚的浓度提高,抑制程度增大。
