螺旋藻蛋白酶解工艺的优化及螺旋藻肽的制备
2019-06-25孙媛媛郑雪君崔春李龄佳许立锵
孙媛媛,郑雪君,崔春*,李龄佳,许立锵
(1.华南理工大学 食品科学与工程学院,广州 510640; 2.广东真美食品股份有限公司,广东 潮州 521000)
螺旋藻(Spirulina),属蓝藻纲,颤藻科,是一种营养价值全面、生物活性成分丰富的低等原核生物;其蛋白含量高达60%~70%,且必需氨基酸种类齐全,组成合理,因而被认为是人类最理想的蛋白源[1,2]。近年来,生物活性肽因具有抗氧化、延缓衰老、神经调节等多种显著的生物功效而受到人们广泛研究[3],而螺旋藻蛋白作为优质生物活性肽的良好来源,具有广阔的开发前景[4]。
当前制备生物活性肽的方法主要有提取法、合成法及降解法3种,其中酶解法因反应条件温和、工艺简单、制备得到的活性肽稳定性较好等优点而成为制备生物活性肽的主流方法,因此本实验选用酶解法进行螺旋藻肽酶解工艺的研究。然而,当前螺旋藻蛋白的酶解效率普遍较低,并且螺旋藻腥味重、溶解性较差,限制了其开发利用。为解决这一问题,本实验选用破壁螺旋藻为原料,这将有利于螺旋藻腥味的脱除以及溶解性的提高[5]。在最优酶解工艺的基础上,对制备得到的螺旋藻肽进行了多种指标的测定,以期为后续开发提供有力支撑。
1 材料与方法
1.1 材料和仪器
1.1.1 材料与试剂
破壁螺旋藻:广西农垦绿仙生物保健食品有限公司;碱性蛋白酶37071:诺维信(中国)生物技术有限公司;氢氧化钠、盐酸、硫酸钾、甲醛等常用化学试剂:分析纯,广州市丛源仪器有限公司。
1.1.2 主要仪器设备
ME204E型万分之一电子天平 梅特勒-托利多仪器有限公司;KDN-103F微量凯式定氮仪 广州芊荟化玻仪器有限公司;KDN-40八孔消化炉 广州市丛源仪器有限公司;Scientz-18N冷冻干燥机 宁波新芝生物科技有限公司;雷磁PHS-3E pH计 上海仪电科学仪器股份有限公司;GL-21M型高速冷冻离心机 长沙湘仪离心机仪器有限公司。
1.2 螺旋藻蛋白酶解工艺单因素实验
1.2.1 基本工艺
50 g破壁螺旋藻溶解于450 mL水中,加入螺旋藻重量0.1%的碱性蛋白酶,用NaOH溶液调整pH至一定值,55 ℃水解一定时间,8000 g离心20 min,上清液即为蛋白提取液。
1.2.2 酶解pH单因素实验
用NaOH溶液分别调整螺旋藻溶液pH至6,7,8,9,10,加入螺旋藻重量0.1%的碱性蛋白酶,55 ℃水解9 h后离心,得到螺旋藻蛋白酶解液。
1.2.3 酶解时间单因素实验
用NaOH溶液调整螺旋藻溶液pH至8,加入螺旋藻重量0.1%的碱性蛋白酶,55 ℃水解6,9,12,24 h,离心后得到螺旋藻蛋白酶解液。
1.2.4 热处理单因素实验
50 g破壁螺旋藻溶解于450 mL水中,分别置于70,80,90,100 ℃下进行热处理30 min,而后冷却,调节pH至8,加入螺旋藻重量0.1%的碱性蛋白酶,55 ℃水解24 h,离心后得到蛋白提取液。
1.2.5 蛋白提取液中总氮含量的测定
总氮含量由凯氏定氮法[6]测得。
1.2.6 蛋白提取液中氨氮含量的测定
α-氨基氮含量由甲醛滴定法[7]测得。
1.2.7 蛋白质回收率的计算
1.2.8 水解度的计算
水解度(%)=上清液中α-氨基氮含量/上清液总氮含量×100。
1.3 螺旋藻肽的制备及其指标测定
1.3.1 螺旋藻肽的制备
200 g破壁螺旋藻溶解于1800 mL水中,100 ℃热处理30 min,冷却后调pH至8,加入螺旋藻重量0.1%的碱性蛋白酶,55 ℃水解24 h,8000 g离心20 min,取上清液浓缩,真空冷冻干燥后即得螺旋藻肽。
1.3.2 螺旋藻肽产率的计算
产率(%)=螺旋藻肽质量/原料质量×100。
1.3.3 螺旋藻肽蛋白含量的测定
同1.2.5中的方法。
1.3.4 螺旋藻肽氨氮含量及水解度的计算
同1.2.6及1.2.8中的方法。
1.3.5 螺旋藻肽总糖含量的测定
依据SN/T 4260-2015《出口植物源食品中粗多糖的测定 苯酚-硫酸法》测定螺旋藻肽中总糖的含量。
1.3.6 螺旋藻肽分子量分布
高效液相色谱法测定分子量分布,色谱条件:流动相为乙腈+水+三氟乙酸=20+80+0.1,流速0.5 mL/min,采用7.5 mm×600 mm的分析柱(TSK-Gel)进行分析,进样体积为20 μL。
相对分子质量标准曲线的制作:分别用流动相配成质量浓度为1 mg/mL的胰岛素、杆菌肽、甘氨酸-甘氨酸-酪氨酸-精氨酸、甘氨酸-甘氨酸-甘氨酸肽标准溶液,按一定比例混合后进样,得到标准品的色谱图。以相对分子质量的对数对保留时间作图得到相对分子质量校正曲线及其方程:y=-3.2389x+26.438,R2=0.9607。
1.3.7 螺旋藻肽氨基酸组成的测定
按照样品蛋白含量准确称取样品若干,置于水解管中,加入6 mol/L HCl 5 mL,密封。置于(110±1) ℃的烘箱中水解24 h。将水解液过滤,用水定容到50 mL容量瓶中。吸取定容后的样品1~2 mL,置于60 ℃烘箱中脱酸。脱酸后的样品,加入1~3 mL样品缓冲液,震荡均匀后用针管吸取少量,经0.22~0.45 μm滤膜过滤后装入试剂瓶中上机分析(日立L-8900氨基酸分析仪)。
1.3.8 螺旋藻肽中金属元素的测定
依据GB 5009.268-2016《食品中多元素的测定》方法进行测定。
2 结果与分析
2.1 原料总氮含量
凯氏定氮法测得破壁螺旋藻原料的总氮含量为10.75%,即蛋白质含量为67.19%。
2.2 螺旋藻酶解工艺单因素实验
2.2.1 酶解pH单因素实验
pH过高或过低都会使酶发生构象变化从而导致酶活力下降,只有当酶在合适的pH范围内才能表现出其催化活性。

图1 酶解pH对蛋白回收率及水解度的影响Fig.1 Effect of enzymatic hydrolysis pH on protein recovery and degree of hydrolysis
由图1可知,酶解pH的变化对蛋白回收率及水解度均有显著性影响,其中对于蛋白回收率的影响达到极显著水平。随着pH的升高,蛋白回收率先升高后降低,在pH 8时达到最高,为40.26%;水解度随酶解pH的变化趋势大致相同,但在pH为7,8,9时无显著差异。综上所述,得到酶解螺旋藻蛋白的最优pH为8。
2.2.2 酶解时间单因素实验

图2 酶解时间对蛋白回收率及水解度的影响Fig.2 Effect of enzymolysis time on protein recovery and degree of hydrolysis
由图2可知,在酶解24 h内,蛋白回收率及水解度都随着时间的增加而不断增高,在酶解24 h时回收率及水解度均达到最高,分别为45.22%和18.80%。这说明酶解时间的增加有利于蛋白回收率的提高,后续实验中均采用酶解24 h。
2.2.3 热处理单因素实验
据报道,适当的热处理可以提高植物蛋白质的酶解效率,这主要是由于蛋白质的二级结构和聚集态发生了改变[8,9]。

图3 热处理对蛋白回收率及水解度的影响Fig.3 Effect of heat treatment on protein recovery and degree of hydrolysis
由图3可知,对螺旋藻蛋白溶液进行加热的预处理能显著增加蛋白回收率,相较未进行热处理的样品,蛋白回收率能增加至少5%;热处理温度的增加有利于蛋白回收率的提高,其中在100 ℃热处理后,蛋白回收率达到最高,为51.78%。水解度受热处理的影响趋势则相反,热处理后,提取的蛋白溶液中水解度有明显下降趋势。
2.3 螺旋藻肽的制备及其指标测定
2.3.1 螺旋藻肽产率
200 g破壁螺旋藻提取得到83.02 g螺旋藻肽,产率为41.51%。
2.3.2 螺旋藻肽蛋白含量的测定
经测定,螺旋藻肽的蛋白含量为68.30%,由此计算得到蛋白回收率为42.19%。
2.3.3 螺旋藻肽氨氮含量及水解度的计算
经测定,螺旋藻肽的氨氮含量为2.23%,计算得到其水解度为20.42%。
2.3.4 螺旋藻肽总糖含量的测定
经测定,螺旋藻肽的总糖含量为7.51%。
2.3.5 螺旋藻肽分子量分布

图4 螺旋藻肽分子量分布液相谱图Fig.4 Liquid-phase spectrogram of molecular weight distribution of Spirulina platensis peptides

摩尔质量(Da)分布(%)500~100012.025100~50053.574<10034.401
由图4和表1可知,经最优酶解工艺制备得到的螺旋藻肽分子量都相对较小,均低于1000 Da,其中摩尔质量在100~500之间的肽含量占比最大,约为53.6%,说明螺旋藻蛋白已经得到了充分酶解,一系列小分子肽被有效制备。小分子活性肽的制备不仅有利于酶解产物的消化吸收[10],而且为螺旋藻功能性肽的进一步开发奠定了基础。
2.3.6 螺旋藻肽氨基酸组成的测定

图5 螺旋藻肽氨基酸组成液相谱图Fig.5 Liquid-phase spectrogram of amino acid composition of Spirulina platensis peptides
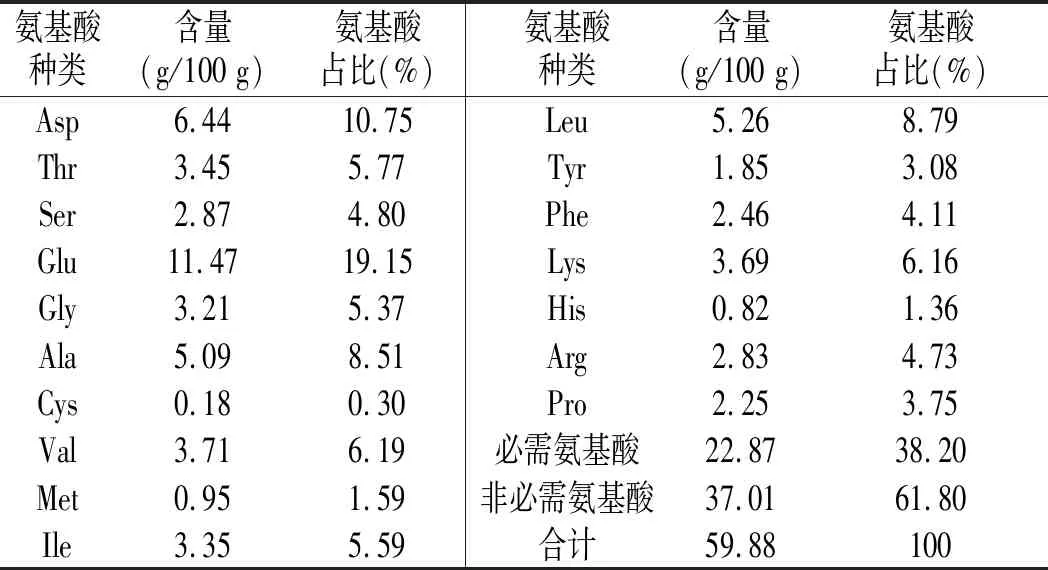
氨基酸种类含量(g/100 g)氨基酸占比(%)氨基酸种类含量(g/100 g)氨基酸占比(%)Asp6.4410.75Leu5.268.79Thr3.455.77Tyr1.853.08Ser2.874.80Phe2.464.11Glu11.4719.15Lys3.696.16Gly3.215.37His0.821.36Ala5.098.51Arg2.834.73Cys0.180.30Pro2.253.75Val3.716.19必需氨基酸22.8738.20Met0.951.59非必需氨基酸37.0161.80Ile3.355.59合计59.88100
由表2可知,螺旋藻肽氨基酸种类齐全,富含赖氨酸、苏氨酸、蛋氨酸和半胱氨酸等人体和动物的必需氨基酸以及其他非必需氨基酸。其中谷氨酸含量最高,达到11.47%,其次是天门冬氨酸,达6.44%,其他含量较高的氨基酸还有亮氨酸、丙氨酸、缬氨酸等。WHO/FAO提出,必需氨基酸量/总氨基酸量=40%,必需氨基酸量/非必需氨基酸量=0.6的参考蛋白模式可提供优质蛋白质,在螺旋藻肽中,这2个值分别为38.2%与0.618,由此可以看出,该螺旋藻肽是优质的蛋白质和氨基酸来源[11]。
2.3.7 螺旋藻肽中金属元素的测定

表3 螺旋藻肽金属元素含量分布Table 3 Content distribution of metal elements in Spirulina platensis peptides mg/kg
由表3可知,根据GB 2762-2017《食品中污染物》以及GB 19643-2016《藻类及其制品》等国家标准,螺旋藻肽中铅、砷、镉、汞、铬等重金属元素均未超标,且其突出的特点是镁元素含量丰富,可达到430 mg/kg。
3 结论
螺旋藻蛋白酶解的最佳工艺条件为:酶解pH 8,酶解时间24 h,热处理100 ℃;此时,蛋白回收率达到51.78%,水解度为13.16%。
在最佳酶解工艺的基础上,制备得到的螺旋藻肽蛋白含量为68.30%,蛋白回收率为42.19%,水解度为20.42%,总糖含量为7.51%。此外,分子量结果显示:螺旋藻肽的分子量都低于1000 Da,说明一系列小分子肽被成功制备,且氨基酸结果显示:螺旋藻肽中含有丰富多样的氨基酸,其中谷氨酸的含量最高。
经检验结果表明,螺旋藻肽中无重金属元素超标,且其中含有丰富的镁元素,同时含有硒、铜、铁、钙、锌等对人体有益的元素。
综上所述,该实验通过一系列探索,得到了螺旋藻蛋白的最优酶解工艺,从而制备了一种溶解性好的螺旋藻肽,并且通过一系列数据对螺旋藻肽的各种性质进行了表征,从而为螺旋藻肽的进一步开发利用提供了数据支撑,以期为螺旋藻功能性肽的开发奠定基础。
