雷公藤红素纳米结构脂质载体的制备工艺优化及其表征Δ
2019-06-25屈子卉张备陈洋洋阎雪莹黑龙江中医药大学药学院哈尔滨150040
屈子卉,张备,陈洋洋,阎雪莹(黑龙江中医药大学药学院,哈尔滨150040)
雷公藤红素(Celstrol,简称Cel)是自雷公藤(Tripterygium wilfordiiHook.f.)根部提取出的一个天然活性成分[1],具有广泛的药理活性,如能抑制肿瘤生长、促进肿瘤细胞凋亡[2],以及对免疫功能和神经退行性疾病等具有较好的改善作用[3]。但是Cel毒副作用大,加上由于Cel具有水不溶性特点而导致其生物利用度低、体内消除快,制约了其临床应用[4]。在纳米给药系统中,纳米结构脂质载体(Nanostructured lipid carriers,NLC)不仅具有固体脂质纳米粒的优点,并且解决了固体脂质纳米粒粒径大、易凝胶化以及由于固体脂质纳米粒的晶体结构而导致的包封率低等问题[5-6]。NLC可作为水不溶性抗癌药物的载体,当药物通过静脉或肌内注射进入机体后,由于NLC具有被动靶向性,在肿瘤部位的分布将大大增加[7-8]。因此,将全身毒性大的药物(如Cel)包载入NLC中,可提高其抗肿瘤作用并降低其全身毒性,这种思路和方法已被广泛应用于肿瘤治疗研究中。星点设计-响应面法是一种综合了数学和统计学的试验设计方法,因其试验次数少、试验精度高等特点,近年来被广泛应用于新型给药系统的处方筛选中[9]。故本研究以Cel为模型药,通过星点设计-响应面法优化Cel-NLC的制备工艺,为Cel的靶向抗肿瘤研究提供试验依据,同时为进一步研究和开发应用于临床的新型纳米递药载体提供参考。
1 材料
1.1 仪器
LC-2010A高效液相色谱仪(日本岛津公司);W202B数控恒温水浴锅(上海申胜生物有限公司);UV 9100紫外分光光度计(北京莱伯泰科仪器有限公司);Nano-ZS90纳米粒度及Zeta电位分析仪(英国马尔文仪器有限公司);JEM-2100透射电子显微镜(日本电子株式会社);Unique-R20多功能超纯水机(厦门锐思捷水纯化技术有限公司);Scientz-ⅡD超声波细胞破碎机(宁波新芝生物科技股份有限公司);KQ5200DB数控超声波清洗器(昆山市超声仪器有限公司);HZS-HA恒温水浴振荡器(东联电子技术开发有限公司);BT25S分析天平(德国赛多利斯公司);HJ-6A数显恒温磁力搅拌器(金坛市荣华仪器制造有限公司)。
1.2 药品与试剂
Cel对照品(成都普菲德生物技术有限公司,批号:34157-83-0,纯度:>98%);肉豆蔻酸异丙酯(上海源叶生物科技有限公司,批号:110-27-0,纯度:98%);维生素E聚乙二醇琥珀酸酯(TPGS)、双硬脂酸甘油酯、嵌段式聚醚F-68(上海源叶生物科技有限公司,批号:9002-96-4、1323-83-7、9003-11-6);SephadexG-50葡聚糖凝胶(瑞典法玛西亚公司,批号:17-0033-01);油酸、硬脂酸、单硬脂酸甘油酯、卵磷脂(天津市科密欧化学试剂公司);甲醇为色谱纯,其他试剂均为分析纯。
2 方法与结果
2.1 Cel-NLC及空白NLC的制备
2.1.1 Cel-NLC的制备 结合预试验结果和相关文献报道[10]确定制备方法,即称取处方量的固体脂质材料、液态脂质材料和Cel对照品,置于20 mL烧杯中,70℃恒温水浴使其充分熔融作为油相;另取处方量的嵌段式聚醚F-68和复合乳化剂于50 mL烧杯中,加适量水,70℃恒温水浴搅拌,加热到油相相同温度,作为水相。待水相完全溶解后,将水相加入到同温度的油相中,用恒温磁力搅拌器在70℃条件下搅拌(1 500 r/min)60 min,使其充分乳化。趁热将制得的初乳转移至细胞破碎机中,在600 W下探头超声10 min,冷却后用微孔滤膜(0.22 μm)滤过,即得Cel-NLC,4℃保存。
2.1.2 空白NLC的制备 按“2.1.1”项下方法,油相中不加Cel制得空白NLC。
2.2 Cel的含量测定
2.2.1 溶液的制备 (1)Cel对照品溶液:取Cel对照品适量,精密称定,置于10 mL量瓶中,加甲醇定容至刻度,混匀,得到质量浓度为520 μg/mL的Cel对照品溶液。(2)Cel-NLC供试品溶液:精密量取“2.1.1”项下的Cel-NLC 1.0 mL于10 mL量瓶中,用85%甲醇稀释并定容至刻度,振摇混匀,然后用微孔滤膜(0.45 μm)滤过,即得。(3)阴性对照溶液:精密量取“2.1.2”项下的空白NLC 1.0 mL于10 mL量瓶中,用85%甲醇稀释并定容至刻度,振摇混匀,用微孔滤膜(0.45 μm)滤过,即得。
2.2.2 色谱条件与系统适用性试验 色谱柱:Dikma Diamonsil(钻石一代)C18(250 mm×4.6 mm,5 μm);流动相:甲醇(A)-水(B),梯度洗脱(0~12 min,85%A;12~20 min,85%→90%A;20~30 min,90%A);流速:1.0 mL/min;柱温:30 ℃;检测波长:426 nm;进样量:20 μL。取“2.2.1”项下3种溶液,按此色谱条件进样测定,记录色谱图。结果显示,在该色谱条件下,理论板数按Cel峰计不低于7 000,待测成分与相邻峰间分离度大于1.5,且阴性对照对测定无干扰,色谱图见图1。
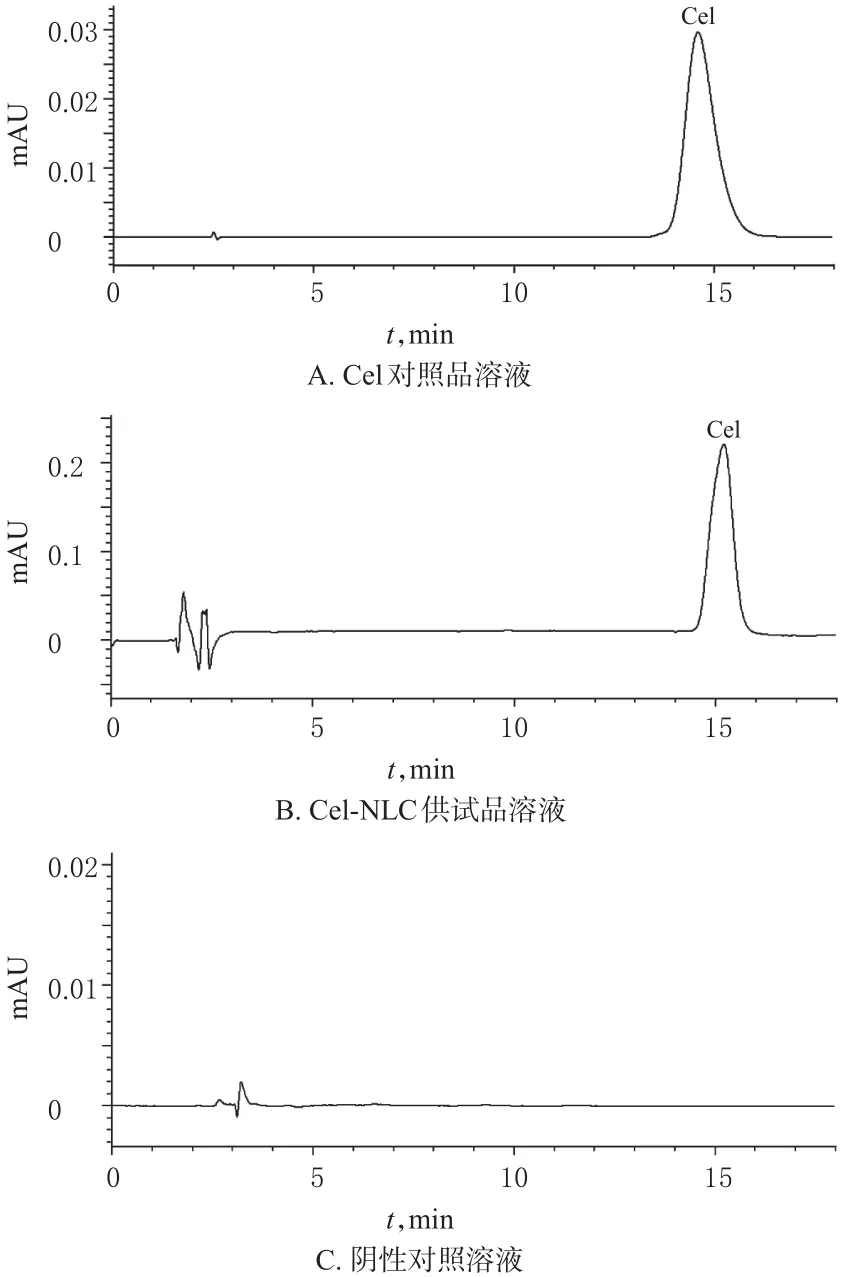
图1 高效液相色谱图Fig 1 HPLC chromatograms
2.2.3 标准曲线的绘制 精密吸取“2.2.1”项下Cel对照品溶液适量,用甲醇稀释为Cel质量浓度分别为520、390、260、130、26、6.5、0.65 μg/mL 的 Cel标准溶液,按“2.2.2”项下色谱条件进样分析,以峰面积(A)为纵坐标、Cel质量浓度(c,μg/mL)为横坐标建立标准曲线。结果,Cel的线性回归方程为:A=15 051c-2 666(R2=0.999 6),表明Cel在进样质量浓度为0.65~520µg/mL范围内与其峰面积的线性关系良好。
2.2.4 精密度试验 制备低、中、高(4.06、10.15、20.30µg/mL)3个质量浓度的Cel对照品溶液各3份,按“2.2.2”项下色谱条件进样测定,同日内每份样品连续进样3次,计算日内精密度;连续进样测定3 d,计算日间精密度。结果,日内精密度试验的RSD分别为1.08%、0.75%、0.53%(n=3),日间精密度试验的RSD分别为1.03%、1.24%、1.43%(n=3),表明日内、日间精密度良好。
2.2.5 稳定性试验 精密吸取“2.2.1”项下Cel-NLC供试品溶液,放置0、3、6、9、12、24 h后,分别按“2.2.2”项下色谱条件进样测定,记录峰面积。结果,Cel峰面积的RSD=1.37%(n=6),表明供试品溶液24 h内稳定性良好。
2.2.6 重复性试验 取制备的同一批Cel-NLC样品适量,共6份,按“2.2.1(2)”项下方法制备供试品溶液,再按“2.2.2”项下色谱条件进样测定,记录峰面积。结果,Cel峰面积的RSD=0.88%(n=6),表明该方法的重复性良好。
2.2.7 回收率试验 精密量取空白NLC溶液0.5 mL,共9份,分别加入质量浓度为10、30、50 μg/mL的Cel对照品溶液,每个质量浓度平行制备3份,然后按“2.2.2”项下色谱条件进样测定,记录峰面积并计算回收率。结果,10、30、50 μg/mL 3个质量浓度Cel的平均回收率分别为99.02%、99.89%、98.52%,RSD均小于2.0%(n=3),表明该方法准确度良好。回收率测定结果见表1。

表1 回收率测定结果Tab 1 Results of recovery tests
2.3 微型凝胶柱离心法测定Cel-NLC的包封率
2.3.1 微型凝胶柱的制备 将SephadexG-50葡聚糖凝胶用水浸泡24 h,置于4℃冰箱中封口,备用。取2.5 mL的注射器,去掉针头和活塞,底部填入双层圆形滤纸,然后加入充分溶胀的SephadexG-50葡聚糖凝胶,注射器外套一5 mL离心管,置于离心机中,以2 000 r/min离心2 min(下同),使其失水皱缩[11-12](在注射器中呈斜面圆柱状),待用,此时SephadexG-50葡聚糖凝胶高约2.3 cm。
2.3.2 微型凝胶柱对空白NLC过柱回收率的影响 分别精密吸取0.1、0.2、0.3 mL的空白NLC,缓慢注入微型凝胶柱的顶端,离心,收集滤液。继续向微型凝胶柱中加入相同量磷酸盐缓冲液(PBS,pH 7.4);以2 000 r/min离心2 min,收集洗脱滤液,重复以上操作4次,合并4次洗脱滤液,然后置于5 mL量瓶中,加PBS(pH 7.4)至刻度。另取相同量的空白NLC置于5 mL量瓶中,加PBS(pH 7.4)至刻度。用紫外分光光度计分别在490 nm波长处测定溶液吸光度,计算空白NLC的过柱回收率[过柱回收率(%)=(过柱后溶液吸光度/未过柱溶液吸光度)×100%] 。0.1、0.2、0.3 mL空白NLC过柱后溶液的吸光度分别设为A1、A2、A3,未过柱溶液吸光度均设为A0,每批样品重复测定3次。结果显示,0.1、0.2、0.3 mL空白NLC的平均过柱回收率分别为(100.26±0.59)%、(99.91±0.81)%、(99.39±0.20)%(n=3),均符合要求,表明微型凝胶柱本身对空白NLC几乎不吸收,不会影响Cel-NLC包封率的检测。微型凝胶柱对空白NLC的过柱回收率测定结果见表2。
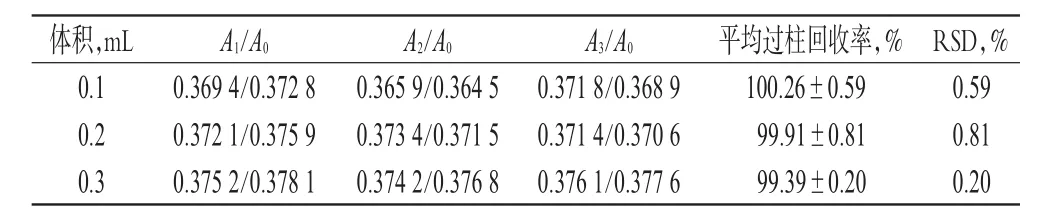
表2 微型凝胶柱对空白NLC的过柱回收率测定结果(n=3)Tab 2 The column recovery rate of black NLC on microgel column(n=3)
2.3.3 洗脱曲线的绘制 取Cel对照品溶液和Cel-NLC供试品溶液各0.1 mL,混合后置于微型凝胶柱顶端,离心,收集滤液,继续向微型凝胶柱中加入0.2 mL PBS(pH 7.4)0.2 mL,离心,连续洗脱20次,每份洗脱液加甲醇0.5 mL破乳,按“2.2.2”项下色谱条件测定其中Cel含量,绘制洗脱曲线。结果显示,Cel-NLC和游离Cel可完全分开,洗脱0~4次的洗脱液为Cel-NLC,洗脱4~11次的洗脱液为蒸馏水,洗脱11~16次的洗脱液为游离Cel,故本研究中只需收集洗脱0~4次的洗脱液进行破乳处理,用于测定Cel-NLC中Cel的含量。Cel对照品溶液和Cel-NLC供试品溶液的洗脱曲线见图2。

图2 Cel对照品溶液和Cel-NLC供试品溶液的洗脱曲线Fig 2 Elution curve of Cel control solution and Cel-NLC test solution
2.3.4 Cel-NLC包封率的测定 取Cel-NLC 0.2 mL,按“2.3.3”项下方法连续洗脱4次,收集4次的洗脱液,置于5 mL量瓶中,加甲醇破乳并定容至刻度,然后按“2.2.2”项下色谱条件分别进样测定Cel-NLC包封的Cel含量(cNLC)。另取Cel-NLC 0.2 mL,置于5 mL量瓶中,加甲醇破乳并定容至刻度,然后再按“2.2.2”项下色谱条件进样测定总Cel含量(c总),并按下式计算其包封率:包封率(%)=cNLC/c总×100%。重复操作3次。结果,测定3次的包封率分别为86.54%、85.59%、88.37%,平均包封率为86.83%,RSD=1.63%(n=3)。
2.4 单因素试验
根据相关文献报道[13-14],固态脂质类型、液态脂质类型、液态脂质比例、脂质材料用量、主药用量、复合乳化剂类型、复合乳化剂比例、复合乳化剂用量、乳化时间、超声时间等都会对NLC的包封率产生影响。因此,在本研究中将以NLC包封率为指标,对上述10个因素进行单因素考察。
2.4.1 固态脂质 固定脂质材料总量为100 mg[液态脂质为肉豆蔻酸异丙酯,液态脂质比例(占总质量的比例,下同)为50%] ,主药用量为10 mg,复合乳化剂用量为200 mg(嵌段式聚醚F-68与TPGS的质量比为1∶1),乳化时间为40 min,超声时间为10 min(功率:600 W,频率:20 kHz),按“2.1.1”项下方法制备Cel-NLC。考察固态脂质分别为单硬脂酸甘油酯、硬脂酸和双硬脂酸甘油酯时对Cel-NLC包封率的影响,结果Cel-NLC的包封率分别为66.24%、49.54%、78.12%,故选择双硬脂酸甘油酯作为固态脂质材料。
2.4.2 液态脂质 固定脂质材料总量为100 mg(固态脂质为双硬脂酸甘油酯,液态脂质比例为50%),其余条件同“2.4.1”项下,按“2.1.1”项下方法制备Cel-NLC。考察不同液态脂质(油酸、肉豆蔻酸异丙酯)对Cel-NLC包封率的影响,结果Cel-NLC的包封率分别为59.46%、78.19%,故选择肉豆蔻酸异丙酯作为液态脂质材料。
2.4.3 液态脂质比例 固定液态脂质为肉豆蔻酸异丙酯、固态脂质为双硬脂酸甘油酯,脂质材料总量为100 mg,其余条件同“2.4.1”项下,按“2.1.1”项下方法制备Cel-NLC。考察液态脂质比例分别为25%、30%、40%、50%、60%时对Cel-NLC包封率的影响,结果Cel-NLC包封率分别为38.94%、66.04%、81.84%、72.12%、43.21%,可见液态脂质比例为40%时Cel-NLC包封率达到80%以上,故选择液态脂质比例40%为中值进行进一步筛选。
2.4.4 脂质材料用量 固定液态脂质为肉豆蔻酸异丙酯、固态脂质为双硬脂酸甘油酯,液态脂质比例为40%,其余条件同“2.4.1”项下,按“2.1.1”项下方法制备Cel-NLC。考察脂质材料用量分别为60、100、140 mg时对Cel-NLC包封率的影响,结果Cel-NLC包封率分别为70.64%、85.38%、78.04%,故确定脂质材料用量为100 mg。
2.4.5 主药用量 固定脂质材料总量为100 mg(液态脂质为肉豆蔻酸异丙酯、固态脂质为双硬脂酸甘油酯,液态脂质比例为40%),除主药用量外的其余条件同“2.4.1”项下,按“2.1.1”项下方法制备Cel-NLC。考察主药用量分别为6、8、10、12 mg时对Cel-NLC包封率的影响,结果Cel-NLC包封率分别为85.38%、85.49%、83.53%、79.94%。结果显示,当主药用量为6、8 mg时包封率均在85%以上,而主药用量为10 mg时包封率下降,并且制得的Cel-NLC在放置1 d即出现沉淀,说明稳定性变差,包载量已过饱和,故最终选择主药用量为8 mg为中值进行进一步筛选。
2.4.6 复合乳化剂类型 固定脂质总量为100 g(液态脂质为肉豆蔻酸异丙酯、固态脂质为双硬脂酸甘油酯,液态脂质比例为40%),主药用量为8 mg,复合乳化剂用量200 mg(固定其中一种乳化剂为嵌段式聚醚F-68,两种乳化剂的质量比为1∶1),乳化时间为40 min,超声时间为10 min(功率:600 W,频率:20 kHz),按“2.1.1”项下方法制备Cel-NLC。分别考察卵磷脂和TPGS分别与嵌段式聚醚F-68组成的复合乳化剂对Cel-NLC包封率的影响。结果Cel-NLC包封率分别为61.50%、83.19%,故选择TPGS与嵌段式聚醚F-68共同作为复合乳化剂。
2.4.7 复合乳化剂比例 固定其他条件不变,考察嵌段式聚醚F-68与TPGS的质量比分别为1∶1、3∶7、7∶3、4∶6时对Cel-NLC包封率的影响,结果Cel-NLC包封率分别为83.53%、81.84%、73.58%、82.64%,故选择将嵌段式聚醚F-68与TPGS按1∶1的质量比混合后作为复合乳化剂。
2.4.8 复合乳化剂用量 固定其他条件不变,考察复合乳化剂用量分别为100、200、280 mg时对Cel-NLC包封率的影响,结果Cel-NLC包封率分别为75.07%、82.73%、81.69%,可见复合乳化剂用量为200、280 mg时包封率均较高,但复合乳化剂用量为280 mg时制得的Cel-NLC在放置1 d出现了沉淀,故选择复合乳化剂用量200 mg为中值进行进一步优化。
2.4.9 乳化时间 固定其他条件不变,考察乳化时间分别为40、60、80、100 min时对Cel-NLC包封率的影响,结果Cel-NLC包封率分别为75.07%、82.09%、77.48%、81.69%,将乳化时间控制在60 min时包封率最高,故选择乳化时间为60 min制备Cel-NLC。
2.4.10 超声时间 固定其他条件不变,考察超声时间分别为6、8、10、12 min(功率:600 W,功率:20 kHz)对Cel-NLC包封率的影响。结果Cel-NLC包封率分别为69.79%、76.12%、81.81%、65.93%。可见,超声时间过短时包封率较小,且其粒径较大;而超声时间过长,包封率也会降低,Cel-NLC颜色变深且易产生沉淀,故选择超声时间为10 min制备Cel-NLC。
2.5 星点设计-响应面法优化Cel-NLC的制备工艺
2.5.1 星点试验设计 通过单因素试验考察结果发现,液态脂质比例、复合乳化剂用量、主药用量对包封率的影响较大。故本研究进一步以液态脂质比例(X1)、复合乳化剂用量(X2)、主药用量(X3)作为考察因素,以包封率(Y)为考察指标(响应值),通过星点设计-响应面法优化Cel-NLC的制备工艺。因素与水平见表3,星点设计表及响应值结果见表4。
2.5.2 方程拟合 运用Design-Expert V 8.0.6软件对试验结果进行分析,软件内模型拟合功能显示,采用二次多项式方程拟合效果较好,拟合方程为Y=-803.660+7.006X1+5.158X2+61.773X3+0.012 6X1X2-0.005X1X3-0.063X2X3-0.121X12-0.013X22-3.138X32(R2=0.898 2,P<0.000 1)。计算出模型Y失拟项的平方和为5.75,P=0.13>0.05,表明本模型没有失拟现象,可用于Cel-NLC处方的分析及预测。方差分析结果见表5。

表3 因素与水平Tab 3 Factors and levels
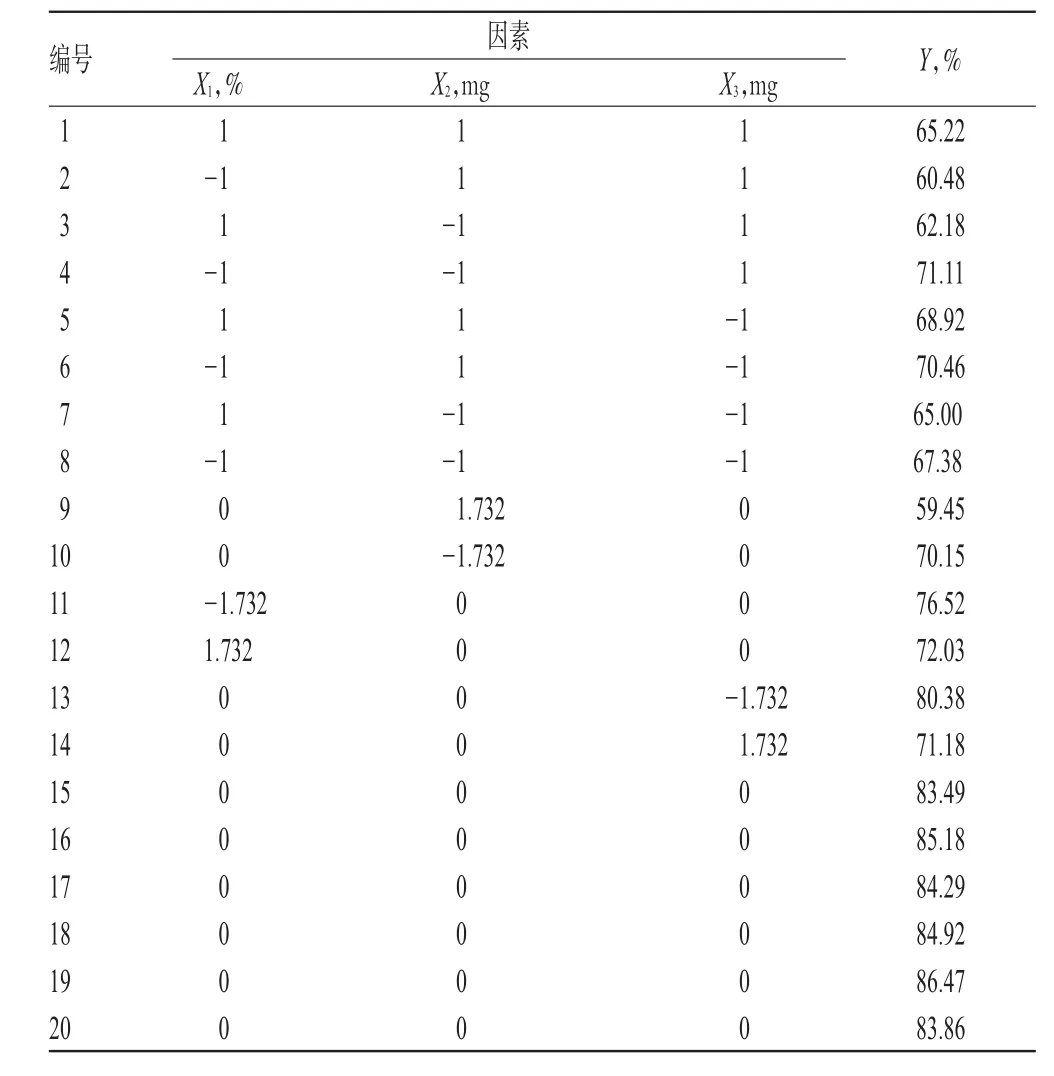
表4 星点设计表及响应值结果Tab 4 Central composite design and response value result
由表5可知,此模型的F=11.63(P<0.001),表明此模型具有显著性。并且,二次项X12、X22、X32对试验结果有极显著的影响(P<0.001),表明所得回归方程能很好地预测Cel-NLC包封率随考察因素的变化,佐证了本研究中选取的3个因素均为该模型的显著性影响因素。
2.5.3 响应面分析 以Design-Expert V 8.0.6软件分别绘制3个因素两两交互对Cel-NLC包封率的响应面曲线图和等高线图,通过响应面曲线的变化情况和等高线的稀疏程度可直观反映出各因素对Cel-NLC包封率的影响,结果见图3。

图3 各因素两两交互对Cel-NLC包封率影响的等高线图和响应面图Fig 3 Contour map and response surface map for the effects of variables interaction on encapsulation rate of Cel-NLC
由图3可知,包封率(Y)与液态脂质比例(X1)、复合乳化剂用量(X2)以及主药用量(X3)的关系密切。随着X1升高、X2增加以及X3的增加,包封率先升高后降低,且趋势明显。因此在合适的液态脂质比例、复合乳化剂用量、主药用量下,包封率会有极大值,且应位于响应曲面的顶部。
2.5.4 响应面优化与预测 在满足Cel-NLC包封率最
大化条件下,利用Design-Expert V 8.0.6软件优化处方,得到最优处方为液态脂质比例38.89%、复合乳化剂用量195.58 mg、主药用量7.86 mg。考虑到实际操作,将Cel-NLC最优处方调整为液态脂质比例为39%、复合乳化剂用量为196 mg、主药用量为8 mg。
2.5.5 验证试验 按最优化后的处方工艺条件,平行制备3批Cel-NLC,按“2.3”项下方法测定包封率。结果,3批Cel-NLC的包封率分别为87.23%、87.53%、86.89%,平均包封率为87.22%,RSD=0.37%(n=3)。与预测值85.13%的相对误差为2.46%,低于5%,说明优选的工艺准确、可靠。
2.6 Cel-NLC的表征
2.6.1 Cel-NLC的外观 取按最优处方工艺制备的Cel-NLC,用肉眼进行外观观察。结果,Cel-NLC为黄色半透明的澄清液体,肉眼观察外观均匀,未见不溶性颗粒,Cel-NLC的外观见图4。

图4 Cel-NLC的外观Fig 4 Appearance of Cel-NLC
2.6.2 Cel-NLC的粒径及Zeta电位 取按最优处方工艺制备的Cel-NLC 1滴,加水1 mL稀释后,置于纳米粒度及Zeta电位分析仪中测定其粒度分布及Zeta电位。结果,测得粒径为(41.2±1.1)nm、多分散指数(PDI)为0.14±0.28,Zeta电位为(-18.4±0.2)mV(n=3),Cel-NLC的粒径和Zeta电位分布图见图5。
2.6.3 Cel-NLC的微观形态观察 采用透射电子显微镜观察Cel-NLC的微观形态。结果,样品中粒子呈类球形,粒径大小与“2.6.2”项下检测结果基本吻合,Cel-NLC的透射电镜图见图6。
2.6.4 稳定性考察 取3批Cel-NLC样品,分别于室温(25℃)和4℃冷藏下保存,分别于0、7、15、30 d取样,肉眼观察外观变化,考察其稳定性。结果,Cel-NLC在4℃条件下放置30 d,外观均匀,不分层,无沉淀;在25℃条件下放置15 d时,肉眼可见出现絮凝,但振摇后可恢复;在25℃条件下放置30 d时,已出现不可逆沉淀。以上结果表明,Cel-NLC在4℃冷藏下保存30 d内比较稳定。

图5 Cel-NLC的粒径和Zeta电位分布图Fig 5 Particle size and Zeta-potential distribution of Cel-NLC

图6 Cel-NLC的透射电镜图Fig 6 Picture of Cel-NLC by TEM
3 讨论
在前期研究中,笔者曾分别采用熔融乳化超声法、薄膜超声分散法和溶剂扩散法以相同质量双硬脂酸甘油酯、肉豆蔻酸异丙酯、Cel为油相,相同体积嵌段式聚醚F-68和TPGS为水相制备Cel-NLC。试验结果表明,采用溶剂扩散法制得的Cel-NLC体系不稳定,4℃放置1 d即产生絮凝;采用薄膜超声分散法制得的Cel-NLC粒径较大,在190 nm左右,静置易浑浊;而采用熔融乳化超声法制备的Cel-NLC粒径在40 nm左右,且纳米体系稳定,故最终选择熔融乳化超声法制备Cel-NLC。
包封率是NLC重要的评价指标[15]。对于不同性质的NLC,适合的包封率测定方法各有不同。微柱离心法测定NLC包封率所需时间短、葡聚糖凝胶用量少,且对NLC的稀释倍数小,可有效地将NLC与游离药物分离[16]。在本研究中,笔者采用Sephadex G-50葡聚糖凝胶微柱离心和HPLC法联合应用测定Cel-NLC包封率,取得了较好的结果。在试验过程中,笔者发现离心处理时转速对微型凝胶柱的形成具有重要作用,转速过小凝胶失水量少,无法脱离注射器成柱,但转速过高会导致微型凝胶柱断裂,经过反复试验后最终确定以2 000 r/min离心2 min,此时既可使微型凝胶柱失水收缩,又不会引起凝胶的断裂,从而达到理想的分离效果。
将单硬脂酸甘油酯中微量的双硬脂酸甘油酯提纯到80%以上可称为双硬脂酸甘油酯,其脂质特性更优于单硬脂酸甘油酯,在本研究中也证实了这一点。本研究以双硬脂酸甘油酯作为固态脂质材料比单硬脂酸甘油酯包封率高11.9%,故选择双硬脂酸甘油酯作为固态脂质材料。采用固态和液态混合脂质材料作为载体,能增加NLC的晶格混乱度,解决了SLN脂质粒径变大、凝胶化趋势,以及由于NLC的晶体结构而导致的包封率低等问题[17-18]。在预试验中笔者发现,用固态脂质和液态脂质作为载体制得的Cel-NLC在稳定性、载药量和PDI指数方面均优于单独使用固态脂质材料,且粒径在100 nm以内,这提示制备的Cel-NLC具有被动靶向性。乳化剂可以改变NLC中脂质的结晶行为,避免脂质裸露于颗粒的表面,降低颗粒间发生聚集的可能性,然而乳化剂用量过多也会影响NLC的稳定性并会增加毒性[19]。嵌段式聚醚F-68是NLC常用的乳化剂,但在本研究制备Cel-NLC时,不断增加嵌段式聚醚F-68用量,Cel-NLC的稳定性均较低,而发现用TPGS和嵌段式聚醚F-68形成复合乳化剂后,Cel-NLC包封率和稳定性都明显提高,于是在本研究中采用复合乳化剂作为NLC的水相。
综上所述,本研究优化了Cel-NLC的制备处方工艺,制得的Cel-NLC粒径较小且分布均匀、包封率高,为Cel的后续开发及研究拓宽了思路并提供了试验依据。
