口腔鳞状细胞癌中RAF激酶抑制蛋白的表达及其与临床特点的相关性
2019-06-22包凡董菲刘娟
包凡 董菲 刘娟
口腔癌为最常见的头颈部恶性肿瘤,主要发生在口腔黏膜如舌、颊、硬腭、牙龈等处。90%以上的口腔癌是鳞状细胞癌(Oral Squamous Cell Carcinoma,OSCC),口腔鳞状细胞癌经常发生侵袭和远处转移[1],是一种恶性程度较高的肿瘤。
Raf-1激酶调控着细胞的生长、增殖以及分化,过度活化的Raf-1激酶会促近肿瘤的发生发展。Raf激酶抑制蛋白(Raf kinase inhibitor protein,RKIP)是一种Raf-1激酶的抑制剂,属于磷脂酰乙醇胺结合蛋白(phosphatidylethanolamine-binding protein,PEBP)家族成员之一。RKIP能够结合Raf-1从而抑制Raf-1介导的细胞增殖的信号转导通路[2], 同时还可以调控G蛋白偶联受体信号通路和NF-κB信号通路[3]。RKIP表达丧失或减少与很多恶性肿瘤的发生发展密切相关,可以作为一种新的肿瘤标志物。研究证实Raf激酶抑制蛋白在肺癌[4]、胃癌[5]、子宫颈癌[6]、卵巢癌[7]、鼻咽癌[8]、胰腺癌[9]等多种恶性肿瘤中表达减少甚至消失,并且与肿瘤的浸袭和远处转移密切相关。RKIP表达缺失往往意味着肿瘤的恶性程度较高,远处转移的可能性较大,有学者认为RKIP可以作为肿瘤基因治疗的新靶点。因而,本研究通过检测RKIP在口腔癌组织以及非肿瘤组织的表达情况,评估了RKIP在口腔癌患者诊疗中的临床价值。
1 材料与方法
1.1 材料
1.1.1 研究报经医院伦理委员会通过,收集云南省一院2014-01~2016-07病理科病理蜡块,其中30 例口腔黏膜白斑、 50 例OSCC组织和50 例对应的癌旁正常黏膜组织,以及其中有淋巴结转移的转移组织22 例。所有标本经HE染色确定,且所有患者术前均未经放疗或者化疗。
1.1.2 试剂 RKIP一抗(sc-28837, Santa Cruz, 美国); 兔specific HRP/DAB (ABC) Detection IHC试剂盒、 DAB显色试剂盒、 β-actin(北京中杉金桥公司)。
1.2 实验方法
1.2.1 免疫组化法检测RKIP的表达 福尔马林固定、石蜡包埋组织, 4 μm厚的组织切片常规失蜡、微波抗原修复20 min, 室温下3%过氧化氢封闭30 min,PBS冲洗后用10%山羊血清封闭30 min。 RKIP一抗(sc-28837) 稀释度: 1∶200)4 ℃冷库孵育组织切片过夜,PBS漂洗3 次;辣根过氧化物酶孵育后通过DAB显影液显示着色情况,随后使用苏木精复染。以PBS替代一抗作为空白对照。
1.2.2 免疫组化结果评定 每张组织切片用光学显微镜(×400)随机观察5 个视野,由3 位病理科医生分别完成并计分。RKIP的表达根据染色强度(0~3 分)和阳性细胞所占百分比来综合评定,根据参考文献[9]的标准进行评分。
1.2.3 Western blot(WB)法检测RKIP蛋白表达 提取手术标本组织总蛋白,定量后与上样缓冲液混合均匀,100 ℃沸水中煮5 min, SDS-PAGE 聚丙烯酰胺凝胶电泳后将其转移到PVDF 膜,封闭液封闭1 h后加入RKIP一抗4 ℃摇床孵育过夜,TBST 洗涤3 次,每次10 min。洗涤后加入二抗常温孵育2 h后,TBST 洗涤3 次,每次15 min。然后加入显影液压片,显影,拍照。
1.3 统计学分析
结果采用SPSS 18.0软件进行统计分析,RKIP表达与临床病理参数之间的相关性分析采用用χ2检验。计量资料间差异分析采用单因素方差分析,P<0.05认为有统计学差异。
2 结 果
2.1 RKIP在OSCC中的表达情况
在OSCC周围的正常组织和口腔黏膜白斑中,RKIP几乎存在于上皮全层,主要表达在细胞质。在OSCC组织切片中,RKIP主要表达也在细胞质。 50 例原发性口腔癌组织切片中21 例(42.0%)高表达;而相应的50 例癌旁正常组织中36 例RKIP(72%)高表达,口腔黏膜白斑组30 例中有20 例(66.7%)RKIP高表达。癌旁正常组织组与口腔白斑组的RKIP表达没有显著性差异,然而,OSCC组相比这两组RKIP的表达有明显的下降。
2.2 RKIP在转移淋巴结中的表达
在22 例发生淋巴结转的病例中7 例(28%)检测到RKIP的表达,在28 例没有发生淋巴结转的病例中17 例(60.7%)检测到RKIP的表达,表明RKIP在转移淋巴结中表达减少甚至消失;同时, 3 例发生淋巴结远处转移的组织切片中几乎检测不到RKIP的表达。
2.3 WB法检测RKIP的表达
RKIP在OSCC组、正常组织组、口腔白斑组、淋巴结转移组都有表达(图 2)。 RKIP蛋白在正常组和白斑组的表达量明显高于OSCC组和淋巴结转移组。RKIP在OSCC组、 淋巴结转移组、 正常组织组、 口腔白斑组、淋巴结转移组的蛋白表达量分别为: 0.463±0.010 0、 0.352±0.009、 0.824±0.021、 0.752±0.015; 前2 组与后2 组相比差异有统计学意义(P<0.05)。
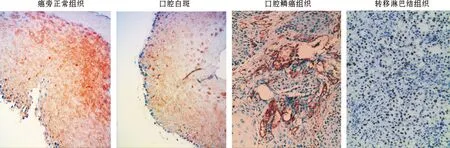
图 1 RKIP在癌旁组织、口腔白斑、 OSCC、转移淋巴结组织中的表达情况
(×400)
Fig 1 RKIP expression of normal oral mucosa, oral leukoplakia, OSCC and lymph node with metastases of OSCC
(×400)

表 1 RKIP在不同口腔组织中的表达
表 2 RKIP表达与OSCC患者临床特征之间的相关性
Tab 2 Association between RKIP expression and clinicopathological features in patients with OSCC
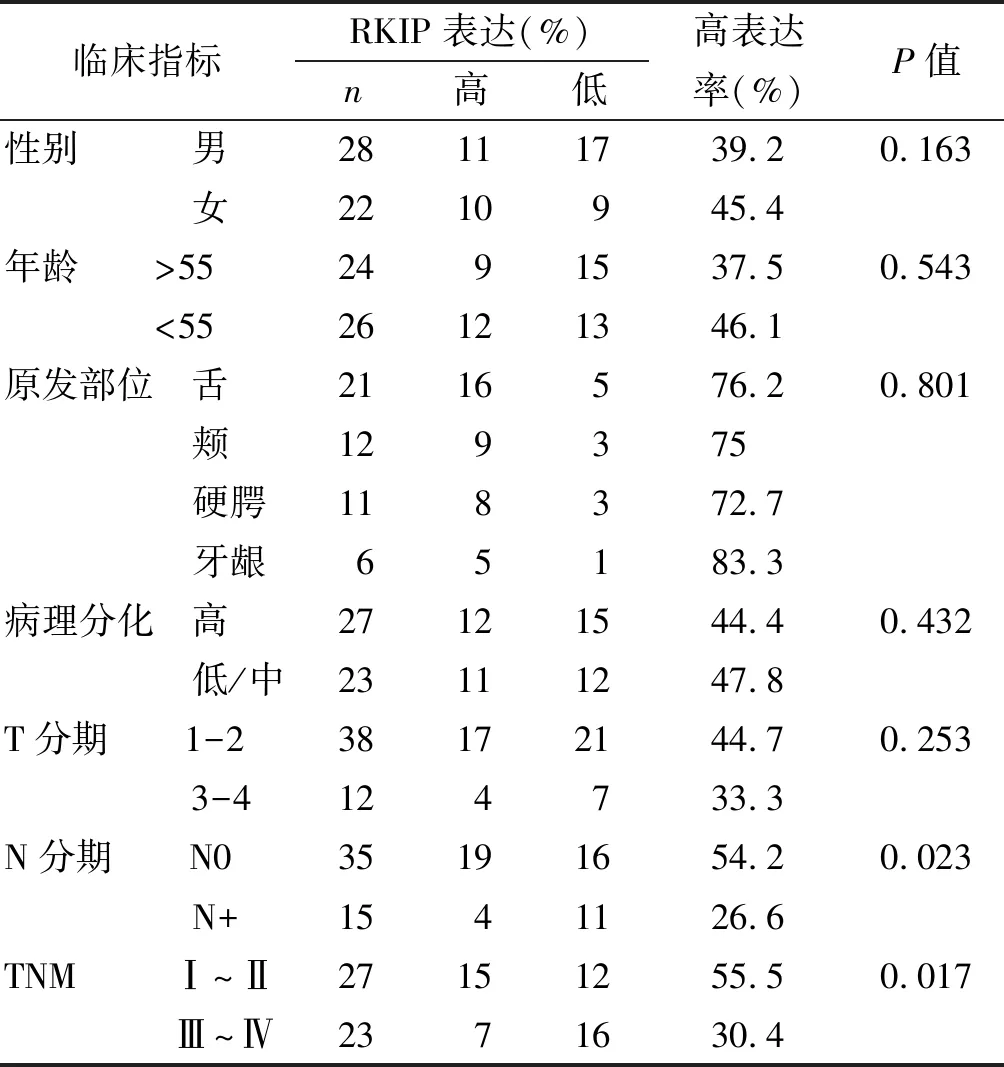
临床指标RKIP表达(%)n高 低高表达率(%)P值性别 男 28 11 17 39.20.163 女 22 10 9 45.4年龄 >55 24 9 15 37.50.543 <55 26 12 13 46.1原发部位 舌 2116 5 76.20.801 颊 129 3 75 硬腭 11 8 3 72.7 牙龈 65 1 83.3病理分化 高 2712 15 44.40.432 低/中 2311 12 47.8T分期 1-2 3817 21 44.70.253 3-4 124 7 33.3N分期 N0 3519 16 54.20.023 N+ 154 11 26.6TNM Ⅰ~Ⅱ 2715 12 55.50.017 Ⅲ~Ⅳ 237 16 30.4
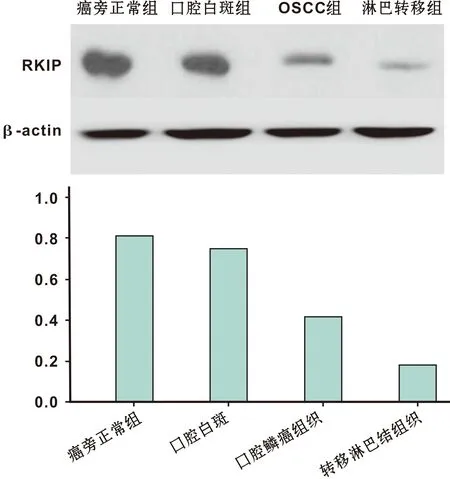
图 2 蛋白质印迹法(WB)检测RKIP在不同组织中的表达情况
3 讨 论
RKIP是负调控Ras-Raf-Mark-Erk细胞增殖信号传导通路的蛋白之一,通过与Raf-1激酶的结合,RKIP能够抑制细胞的过度增殖,维持细胞数量的动态平衡[10]。研究表明,RKIP能够抑制多种恶性肿瘤的发生发展以及转移[11-12]。RKIP抑制肿瘤转移的机制目前尚不清楚,可能RKIP的过表达同样会抑制转移相关的基因。Al-Mulla等[13]发现, RKIP在头颈部正常组织中表达较高,本实验通过免疫组化法和蛋白质印迹法发现RKIP在口腔正常组织和口腔癌前病变组织(口腔白斑)中高表达,与他们研究结果一致。本研究发现,RKIP在口腔鳞状细胞癌中的表达显著减少;在癌症患者相应的转移淋巴结中,RKIP的减少更加明显;在远处转移的淋巴结中,甚至没有RKIP的表达。RKIP表达的丧失与OSCC的远处淋巴结转移以及临床分期相关,但是与肿瘤的原发部位和组织学分级无关,这与Fu 等[11]发现RKIP表达对前列腺癌的组织学分级无关相一致,表明RKIP可以影响OSCC的发展和转移,但是对OSCC的肿瘤性质没有影响。RKIP可能是一种口腔鳞状细胞癌的转移抑制剂。
本研究结果还发现在OSCC中RKIP的表达丧失与癌细胞远处转移之间存在着显著的相关性,在发生远处淋巴结转移的癌组织中RKIP的表达明显低于没有淋巴结转移的原发性癌组织,甚至没有RKIP的表达。OSCC的远处淋巴结转移预示着预后不良、生存时间缩短的临床结局。以往的研究表明,RKIP表达丧失在神经胶质瘤中预示着肿瘤高度恶性和预后生存期较短[14],RKIP表达下降在鼻咽癌中往往预示着癌细胞发生淋巴结转移[15], 磷酸化的RKIP能够作为肺癌的一种预后因子[4]。所以,低表达的RKIP可能作为淋巴结转移的OSCC患者预后不良的临床参考指标之一。
以往的研究发现RKIP在多种肿瘤中发挥着抑制肿瘤转移的功能,RKIP较少或缺失与肿瘤的侵袭性相关。本研究也发现RKIP的表达缺失与OSCC的的发展和转移显著相关,RKIP可能是通过抑制OSCC肿瘤新生血管的生成及抑制肿瘤的血管内侵袭来发挥其抑制肿瘤生长和侵袭的;也可能是对OSCC侵袭转移的相关基因进行调节,抑制相关的肿瘤转移信号通路。但RKIP抑制OSCC转移的具体机制尚不明确,还需要更进一步的研究来探索。
