miR-126多基因靶向调控血管再生的研究
2019-06-22王璐张洲铭金诺蔡卜磊董广毅李德超
王璐 张洲铭 金诺 蔡卜磊 董广毅 李德超
通过组织工程骨进行牙槽骨的修复再生实质是由再生与血管化2 个方向共同调节的。在此期间,如果血管再生不充分会导致新生组织内部营养缺乏,从而导致组织吸收甚至感染[1]。尤其是当缺损面积较大或组织再生能力差时,组织中新血管的形成和稳定更加重要。
血管网络的建立需要多种细胞因子的调节,如血小板衍生生长因子(Platelet-derived growth factor,PDGF),血管生成素(Angiopoietin-1,Ang-1)等[2-3]。通过联合使用多个生长因子可以在一定程度上促进组织内的血管再生,但是这种外源性直接干预会打破血管重建平衡从而导致大量不成熟的血管形成而造成血管高压进一步发生血管微渗漏[4-5]。miRNA长约21~23 个核苷酸,是一种内源性产生的单链非编码RNA分子,具有高度的保守性和高组织表达特异性。miRNA的过度表达或抑制可同时调节多种生长因子的内源性表达,目前已发现某些miRNA可以通过间接诱导细胞产生多种血管生成相关因子来促进血管的形成和成熟[6],为组织工程材料内部血管化提供了新的治疗策略。
1 材料与方法
1.1 实验动物
实验动物为SPF级4~6 周龄C57 裸鼠,雄性,体质量 18~25 g[空军医大学第三附属医院(原第四军医大学)实验动物中心]。
1.2 主要试剂与仪器
α-MEM(12561-056, Gibco,美国); 胎牛血清、 2.5 g/L胰酶细胞消化液(Hyclone公司, 美国); E.Z.N.A.®Total RNA Kit I(OMEGA公司,美国); Prime ScriptTMRT-PCR Kit、 SYBR®Premix Ex TaqTM(Takara公司, 日本); Bulge-LoopTMmiRNA qRT-PCR(广东Ruibo 公司); pEGFP-N1-miR126、 lipofectamine 3000 Transfection Kit(L3000-001, Invitrogen公司, 美国);PVDF(500-600, BIO-RAD, 美国); G418(Sigma公司, 美国);CD31(abcam公司, 美国); Matrigel(Corning公司,美国);超净工作台(Forma公司,美国); CO2恒温孵育箱、 酶联免疫检测仪(Thermo公司,美国); 共聚焦荧光显微镜 (Olympus Optical公司,日本); Real-time RT-PCR 仪(Applied Biosystems公司, 美国)。
1.3 人脐静脉血管内皮细胞(humanumbilical vein endothelial cells, HUVECs)的分离和培养
无菌条件收集采自空军军医大学(原第四军医大学)西京医院妇产科新生儿脐带(本研究得到西京医院伦理委员会同意并取得了产妇的知情同意),将取来的脐带立即移入超净工作台,在无菌条件下,吸取无菌生理盐水从脐带一端插入脐静脉冲洗至冲洗清亮,注入胰蛋白酶消化数分钟,消化完毕后,松开固定端,将消化液收集到盛有10% α-MEM培养基的15 ml离心管中,吹打均匀后1 500 r/min离心5 min,弃上清;接种于培养皿中,细胞传代至第3 代用于实验。
1.4 细胞miRNA的转染
取对数生长期为第3 代的HUVEC,按照 lipofectamine 3000 Transfection Kit说明书进行操作。将HUVEC细胞以1×106个/ml细胞密度接种于六孔板中;miR-126序列如下:5′-CAUUAUUACUUUUGGUACGCG-3′,同时设置对照序列。转染72 h后开始用400 μg/ml的G418选择培养液进行筛选,每3 天换液1 次, 1 周后更换为200 μg/ml的G418选择培养液筛选6 周后收集细胞进行实验。
1.5 miRNA转染效率和效果验证
1.5.1 荧光半定量观察 细胞转染24 h之后,用PBS冲洗2~3 次,4%多聚甲醛固定1 h, PBS洗涤2~3 次,用DAPI室温染色,吸除染色液,PBS洗涤2~3 次,抗荧光衰减封片剂封片。荧光显微镜下观察红色荧光显色情况,镜下计数10 个40 倍视野发红色荧光的细胞数占总细胞的百分率作为转染效率的近似值。
1.5.2 miRNA表达的检测 转染24 h后按照E.Z.N.A.®Total RNA Kit I说明书分组提取细胞总RNA,酶标仪检测RNA浓度,每个标本抽取等量的RNA进行RT-PCR检测提按照Prime ScriptTMRT Master Mix试剂盒说明书进行操作。反转录反应条件: 37 ℃、 15 min; 85 ℃、5 s;-20 ℃保存备用。 Rt-PRC 反应条件: 95 ℃、 10 min; 95 ℃、 2 s; 60 ℃、 20 s; 70 ℃、 10 s; 40 个循环。
1.6 miRNA成血管相关基因和蛋白的检测
1.6.1 RT-PCR 检测 通过 RT-PCR方法检测miR-126表达的变化对成血管相关基因Vegf 和 Ang1的表达的影响。反转录反应条件: 37 ℃、 15 min; 85 ℃、 5 s; -20 ℃保存备用。Rt-PRC 反应条件: 95 ℃、 30 min; 95 ℃、 5 s, 60 ℃、 34 s, 95 ℃、 15 s, 60 ℃、 1 min、 95 ℃、 15 s; 40 个循环,GAPDH作为内参。各组引物由Takara生物科技公司合成,各引物序列(表 1)。
表 1 RT-PCR引物及其序列

Tab 1 RT-PCR primers and their sequences
1.6.2 Western blot蛋白印迹检测 通过Western blot蛋白印迹方法检测miR-126对成血管相关蛋白Vegf、 Ang1的表达的影响,将HUVEC接种在6 孔板中,细胞密度为1×106个/ml,转染步骤同上, 24 h后检测,按照说明书MinuteTMTotal Protein Extraction Kit(Invent公司, 美国)进行细胞总蛋白提取。转染后 37 ℃、 5% CO2孵箱至第14 天,裂解细胞,按照BCA法测量蛋白浓度,上样。通过 SDS-PAGE 凝胶电泳,安装电泳槽及电源,PVDF膜转膜后,孵育一抗, 4 ℃过夜,1%TBST洗涤3 次每次5 min,室温孵育二抗, 1 h后1% TBST洗涤3 次每次5 min后使用 Thermo 公司发光液、显影。以下是使用的抗体稀释比例: Vegf 1∶500, Ang-1 1∶500, β-acting 1∶1 000。 IMAGE-J软件分析条带的灰度值。
1.7 Matrigel成管实验
将 Matrigel 预先放置于4 ℃冰箱过夜,溶胶,实验开始前将接触到Matrigel枪头、离心管、 96 孔板、培养液等均放在4 ℃冰箱预冷,取出 Matrigel移至超净台内在冰上操作,混匀Matrigel基质,按每孔吸取 10 μl 加入96 孔板中, 37 ℃孵育45 min, 将转染miR-126和miR-NC的HUVEC胰蛋白酶消化2 min, 离心5 min, PBS清洗2 遍, 用完全培养基重悬细胞,调整细胞密度每孔按1×105个细胞接种,放回孵箱培养24 h,后激光共聚焦观察成管效果。
1.8 细胞免疫荧光染色
CD31对成管进行染色,PBS清洗细胞2 次, 4%多聚甲醛固定1 h, 用含0.2%Tritonx-100的PBS透化5 min, 含3%FBS的PBS清洗细胞3 次, 含3% FBS和0.5% Teween20封闭1 h, 一抗(CD31按1∶500稀释)室温封闭1 h, PBS清洗细胞3 次, 荧光二抗(1∶500稀释)室温孵育30 min, PBS清洗3 次,防荧光催化剂封片,后激光共聚焦观察成管效果。
1.9 体内血管形成实验
将Matrigel 预先置于4 ℃冰箱过夜,溶胶400 μl,将107个细胞(miR-126与miR-NC转染后)混匀于胶中(全程冰上操作)。将裸鼠麻醉后,无菌条件下,老鼠背部皮下注射400 μl基质胶细胞混合物, 7 d后取材, 10%多聚甲醛固定、脱水、石蜡包埋、切片、烤片; CD31免疫荧光染色,荧光显微镜观察。
1.10 统计学处理
2 结 果
2.1 miR-126 过表达及转染效率验证
通过激光共聚焦结合real time RT-PCR 分析比较miRNA转染效率与效果(图 1A)。 miR-126转染(图 1B)HUVEC后RT-PCR结果显示, miR-126/HUVEC组与miR-NC/HUVEC组(1.00±0.1)相比较, miR-126相对表达水平为(7.88±1.1), miR-126/HUVEC组miR-126表达量显著高于miR-NC/HUVEC组,差异具有统计学意义。
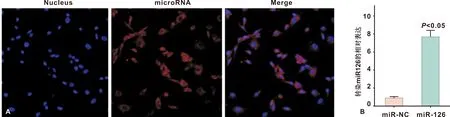
A: 激光共聚焦显微镜观察(×200); B: miR-126在HUVECs内的表达(n=3)
图 1 miR-126在HUVECs中的转染效率
A: Laser confocal microscopy observation(×200); B: miR-126 expression in HUVECs(n=3)
Fig 1 miR-126 transfection efficiency into HUVECs
2.2 miR-126促进HUVEC成血管关键生长因子的表达
通过real time RT-PCR 和Western blot 比较分析成血管相关基因的表达, miR-126转染HUVEC后RT-PCR结果显示,miR-126过表达有效的促进了胞内 VEGF;ANG-1的RNA(图 2A)和蛋白(图 2B)的表达。
2.3 miR-126促进了血管内皮细胞的管腔形成
体外Matrigel 管腔形成实验结果显示,miR-126/HUVEC 组有明显的环形管状似血管结构,端端可见接触,管壁形态完整,miR-NC/HUVEC组未见明显端端接触和环形管状结构且管状结构不完整(图 3)。
2.4 miR-126体内促进了血管化
基于体内异位成血管的模型,通过对血管内皮细胞标志物CD31免疫荧光染色显示,miR-126在HUVEC的过表达有效的促进了其在体内的血管再生。miR-126/HUVEC组中 CD31阳性细胞含量明显高于miR-NC/HUVEC 组,说明miR-126能够有效促进体内微血管的形成(图 4)。
3 讨 论
局部微血管的新生对于牙槽骨缺损的再生修复具有重要意义,稳定新血管的生成需要血小板衍生生长因子(PDGF),转化生长因子b(TGF-b)和血管生成素1(Ang1)等关键生长因子[7-9],但因子递送方式和时间是刺激新生血管形成和成熟的关键[10]。尽管递送生长因子可以促进血管生成,但过量递送单一生长因子所生成的血管通常都是不成熟血管和,极易发生微渗漏。因此,新生血管的成熟稳定需要多个生长因子作用并同时严格控制递送生长因子的剂量。
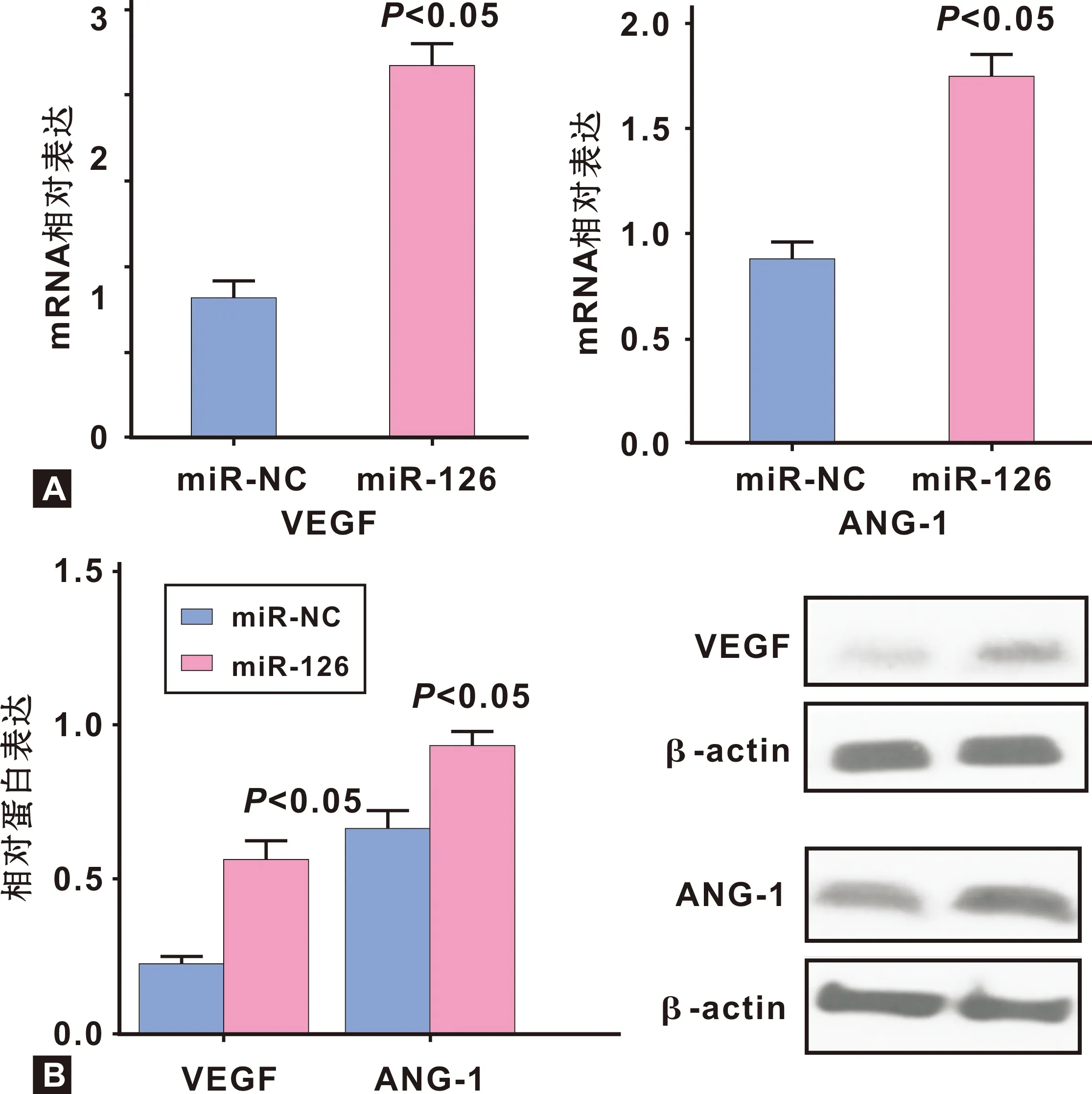
图 2 VEGF和ANG-1 mRNA在HUVECs中的表达
Fig 2 The expression of mRNA and protein of VEGF and ANG-1 in HUVECs
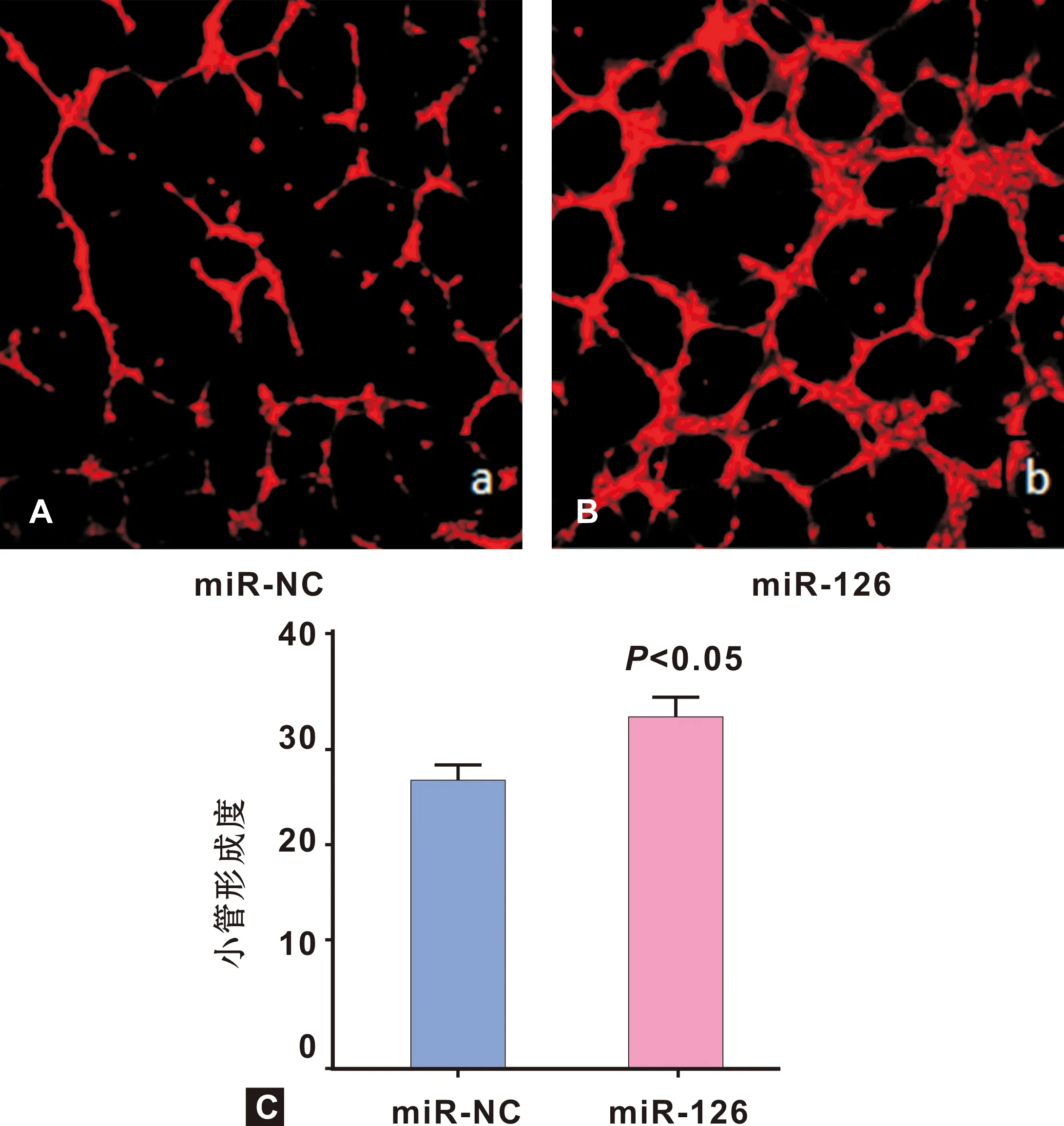
图 3 HUVECs的管腔形成(n=3)
(×50)
Fig 3 Lumen formation of HUVECs
(×50)
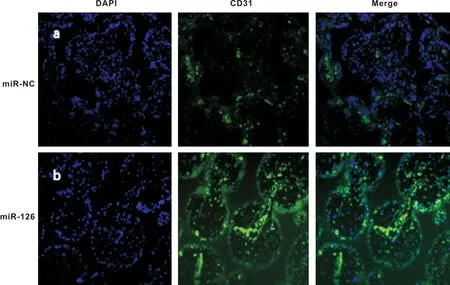
图 4 HUVECs 体内血管化(绿色: CD31; 蓝色: DAPI)
(×200)
Fig 4 The vascularization of HUVECsinvivo(Green: CD31; Blue: DAPI)
(×200)
miRNA可以同时靶向多个mRNA[11-12],过度表达或抑制多个特定miRNA,从而同时调节多种生长因子的内源性表达。在血管生物学领域中,已发现多个可以调节血管生成的miRNA。据报道,miRNA如miR-93, miR-214及miR-221/22等能够通过调节血管内皮细胞进而促血管生成或抗血管生成[13]。又有研究表明肿瘤细胞中miR-21和miR-29b的过度表达通过上调血管生成生长因子如HIF-1a和VEGF来诱导血管生成[14]。有研究发现,在大鼠脑微血管内皮细胞(BMECs)中敲除miR-126-3后,细胞内PIK3R2表达上调,进而使血管内皮生长因子(VEGF)逆转、血管生成素-1(Ang-1)诱导的Akt活化和BMEC凋亡的抑制[15-17]。而本研究发现HUVEC转染miR-126后可显著提高成血管相关基因VEGF和Ang1的表达,而且体外成管实验也发现miR-126的过表达可促进血管的形成并且提高血管完整性。体内实验也证实了miR-126的过表达明显促进了体内血管网的形成以及成熟。
近年来,组织工程骨在牙槽骨缺损的治疗中取得了重大突破,但组织工程骨内的血管网络建立仍是大范围骨缺损修复的难点所在。本次实验发现,miR-126能够同时促进成多种血管相关基因的表达与分泌,进而促进血管的再生和成熟,为组织工程骨内的血管网络建立提供了新的治疗策略。
