PDX通过P38 MAPK通路促进脓毒症性ARDS抗菌肽cathelicidin表达
2019-06-22谷丽君潘静怡MOHAMEDALIAbdullahi金胜威
谷丽君,潘静怡,MOHAMED ALI Abdullahi,金胜威
(温州医科大学附属第二医院育英儿童医院 麻醉科,浙江 温州 325027)
抗菌肽是宿主在抵御外来生物入侵时固有免疫屏障产生的小分子多肽,能广谱抗菌[1-2]并调节免疫反应[3],其中抗菌肽cathelicidin(cathelicidin antimicrobial peptide,CAMP)是主要抗菌肽家族之一。炎症具有防御和损伤双重效应,炎症后期机体通过主动产生促炎症消退介质及时限制过度炎症反应,恢复机体免疫稳态[4-6]。Protectin DX(PDX)是来源于二十二碳六烯(docosahexaenoic acid,DHA)的促炎症消退介质,在多种炎症模型中均有抗炎促消退作用[7-9]。已有研究表明促炎症消退介质脂氧素、消退素能促进抗菌肽的表达[10-12],然而PDX对CAMP的影响尚不清楚,本研究主要探索PDX对CAMP的影响及其具体机制。
1 材料和方法
1.1 材料
1.1.1 实验动物:雄性C57BL/6小鼠,6~10周龄,体质量为23~25 g,购自上海斯莱克实验动物公司,所有动物均饲养于温州医科大学实验动物中心,动物许可证编号:SYXK(浙)2018-103。
1.1.2 主要试剂:PDX购于美国Sigma公司,SB203580购于美国MCE公司,反转录试剂盒、RT-PCR试剂盒购于美国Thermo公司,TRIzol购于美国Invitrogen公司,CAMP、hsp 70、serpina 3、lysozyme基因购于上海生工生物有限公司,cathelicidin抗体、GAPDH抗体购于美国Abcam公司,ERK、P38相关抗体购于美国CST公司,β-actin多克隆抗体购于美国Santa Cruz公司。
1.2 方法
1.2.1 动物处理及分组:盲肠结扎穿孔术建立脓毒症模型:麻醉小鼠至无夹持反应,剖腹探查找到盲肠,在回盲瓣至盲肠末端中间处用外科线结扎肠管,20 G针头从肠系膜刺向游离侧,并对穿。用镊子轻柔挤压肠管,挤出适量肠内容物。回纳盲肠,依次缝合腹膜,肌肉,皮肤。术后皮下补液0.9%氯化钠溶液1 mL,注意保温。术后12 h取组织样本进行检测。先取24只小鼠进行CAMP时效检测:假手术组(Sham组)(n=4):术后即刻取肺组织;脓毒症组(CLP组):制作脓毒症小鼠模型,分别于1、3、6、12、24 h处死小鼠(每个时间点4只),取肺组织行Western blot检测CAMP表达。动物分组,每组6只:假手术组(Sham组):暴露盲肠,不予结扎穿孔并回纳,缝合腹膜及皮肤;脓毒症组(CLP组):暴露盲肠,上述方式结扎穿孔后回纳;治疗组(CLP+PDX组):盲肠结扎穿孔术后2 h腹腔注射PDX 300 ng/只;抑制剂组(CLP+PDX+SB203580组):造模前2 h腹腔注射SB203580(15 mg/kg),盲肠结扎穿孔术后2 h腹腔注射PDX 300 ng/只;溶剂对照组(CLP+PDX+DMSO组):术前2 h腹腔注射等体积1% DMSO,盲肠结扎穿孔术后2 h腹腔注射PDX 300 ng/只;PDX组:暴露盲肠,不予结扎穿孔即回纳,腹腔注射PDX 300 ng/只。
1.2.2 HE染色:于规定时间进行小鼠麻醉,腹主动脉放血处死。摘取小鼠右肺中叶浸泡于4%多聚甲醛(10 mL)固定24 h,常温石蜡包埋5 μm切片。分别经脱蜡、复水、反蓝、透明操作后封片,然后在显微镜下观察采集图像。
1.2.3 菌落形成单位(colony-forming unit,CFU):小鼠麻醉至无夹持反应,剖胸固定,打开心包,于左右心室暗带交接处穿刺进针采血(注意抗凝),取样完成进行涂布。按照原液,1/10原液,1/100原液浓度梯度进行稀释,用灭菌三角涂布棒蘸取各浓度标本于琼脂糖平板进行均匀涂布。涂布完成后,干燥20~30 min,倒置培养皿于37 ℃培养箱培育。12 h后取出样品,计数分析。将计数平面均分为若干块,随机选取3块计数,结果取平均值。
1.2.4 RT-PCR:液氮研磨肺组织,TRIzol溶剂提取组织RNA,反转录试剂盒将RNA反转录为cDNA,混合RT-PCR体系及引物,上机。反应程序:95 ℃预变性2 min进入循环;95 ℃ 15 s,60 ℃ l min,40个循环;进入融解曲线阶段,60 ℃ l min,95 ℃15 s。将PCR所得到的目的基因CT值与其对应内参CT值相减得到ΔCT,再与对照组的ΔCT相减得到ΔΔCT,则目的基因的量为2-ΔΔCT。引物序列为:serpina3:5'-ACGAGTCCACCACGGTGAAGG-3',5'-AGAAGGAAGACAGC AGTGGCATTG-3';hsp70:5'-CCAAGGTGCAGGTGAACTACA AGG-3',5'-GCCGCTGAGAGTCGTTGAAGTAG-3';lysozyme:5'-TCGGAACTGCGGAGTCTGACC-3',5'-GCTGAAGCTTGTGAG GAGGAAGTC-3';CAMP:5'-CACTATCACTGCTGCTGCTACTG G-3',5'-AGTCTCCTTCACTCGGAACCTCAC-3'。
1.2.5 Western blot:肺组织标本加入RIPA裂解液,使用研磨管在冰盒上将标本研磨成匀浆,使用超声裂解液进一步裂解组织,离心12 000×g,30 min,上清液即为总蛋白。经电泳、转膜,10%脱脂牛奶封闭,CAMP(1:1 000)、磷酸化P38(1:1 000)、总P38(1:1 000)、磷酸化ERK(1:1 000)、总ERK(1:1 000)、GAPDH(1:1 000)和β-actin(1:1 000)抗体4 ℃摇床孵育,过夜;对应二抗室温孵育1 h;通过ECL显色,X线胶片曝光成像,使用ImageJ分析图像,得出灰度值,对目的蛋白/内参比值结果进行统计学分析。
1.3 统计学处理方法 采用Graphpad Prism 5.0软件进行统计学分析。正态分布计量资料以形式表示;多组比较采用单因素方差分析,组间两两比较采用SNK-q检验。P<0.05为差异有统计学意义。
2 结果
2.1 PDX对脓毒症性ARDS的保护作用 HE染色检测肺损伤情况,结果显示,相对于Sham组肺组织结构,CLP组小鼠肺泡结构不完整,肺组织间液明显增多,肺出血、炎性细胞浸润明显;PDX处理能显著改善脓毒症模型造成的肺损伤(P<0.05);同时PDX显著抑制血清炎性因子TNF-α、IL-6水平(P<0.05)。见图1。小鼠心脏采血进行CFU检测,结果显示PDX组和Sham组CFU计数结果为阴性,CLP+PDX组菌落计数明显低于CLP组,差异均有统计学意义(P<0.05)。见图2。
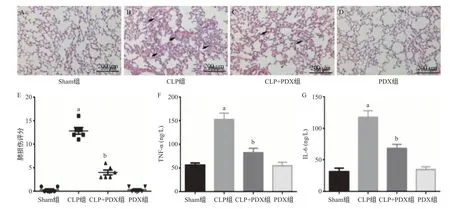
图1 HE染色检测肺损伤情况及小鼠血清炎症因子测定结果


图2 CFU检测菌落形成情况
2.2 PDX促进脓毒症小鼠CAMP的表达 RT-qPCR检测结果显示,相对于Sham组,CLP组serpina 3、hsp70、lysozyme这3种抗菌肽基因表达量差异均无统计学意义(P>0.05)。与Sham组比,CLP组CAMP基因表达上调,经PDX作用后,CAMP基因表达进一步上调(P<0.05),见图3。Western blot结果显示,脓毒症模型中CAMP蛋白表达于6 h内达到高峰,且CLP组表达量高于Sham组,CLP+PDX组CAMP蛋白表达量明显增加,差异有统计学意义(P<0.05),见图4。
2.3 PDX通过P38 MAPK通路促进CAMP的表达
Western blot检测结果显示,与Sham组比,CLP组ERK MAPK相关蛋白的表达量差异无统计学意义(P>0.05);CLP组p-P38/t-P38比值较Sham组有所下降。PDX处理后,p-P38/t-P38比值明显上升,CAMP蛋白表达亦明显上调,差异均有统计学意义(P <0.05)。与CLP+PDX组比,加入P38 MAPK抑制剂SB203580后,CAMP蛋白的表达显著下降,提示PDX对CAMP的促进作用被阻断(P<0.05),见图5。以上结果提示PDX通过P38 MAPK通路促进CAMP的表达。
3 讨论

图3 hsp70、serpina 3、lysozyme、CAMP基因的RT-PCR检测结果
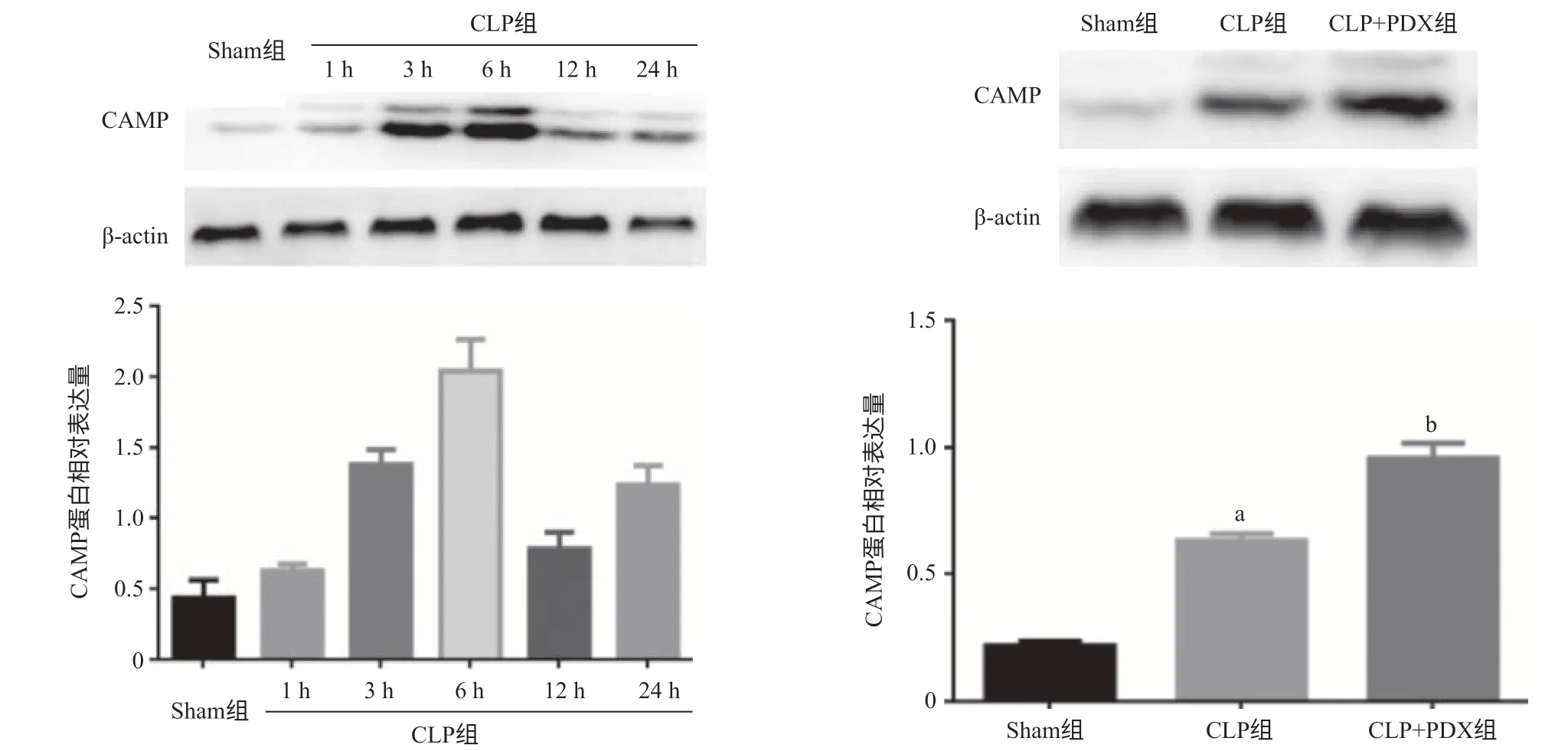
图4 Western blot检测CAMP蛋白的表达
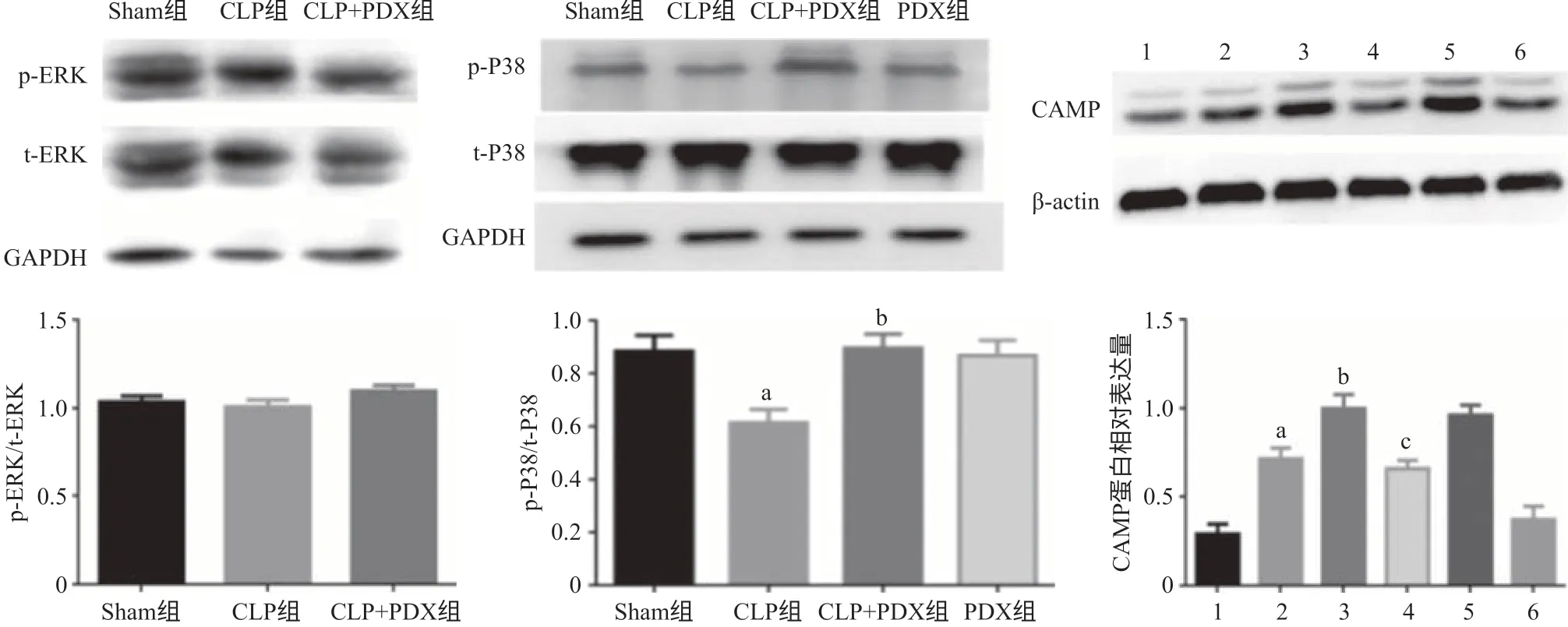
图5 Western blot检测P38 MAPK、ERK MAPK及CAMP蛋白的表达
本研究发现PDX通过P38 MAPK通路促进脓毒症性急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)CAMP的表达。盲肠结扎穿孔模型是经典的脓毒症模型,混合革兰氏阴性和革兰氏阳性菌群感染[13]。脓毒症多器官功能障碍最常累及的是肺组织[14],尽管ARDS多源自肺部本身,远处感染如腹部感染也是ARDS常见的诱发因素[15]。本研究采用CLP模型深入探讨脓毒症性ARDS发病机制。Serpina3、hsp70、lysozyme、CAMP是不同种类抗菌肽[16-18],本实验证实,PDX不影响serpina3、HSP70、lysozyme基因的表达,然而PDX能增加CAMP基因表达。Western blot的结果也提示PDX能增加脓毒症小鼠肺组织CAMP蛋白的表达。肺组织损伤评分结果提示PDX对于脓毒症模型下的肺损伤有显著保护作用。本研究结果提示:PDX可能通过增加小鼠肺组织CAMP的表达保护脓毒症造成的肺损伤。
为探究PDX对脓毒症小鼠的保护作用,使用HE染色观察PDX对脓毒症性ARDS肺损伤的影响。结果发现,PDX干预后肺组织间液渗出减少,炎性细胞浸润及出血明显缓解。同时,血清ELISA结果提示PDX显著抑制血清炎性因子TNF-α、IL-6水平,证实PDX对脓毒症性ARDS有保护作用。同时我们采用CFU检测菌落形成情况,结果发现PDX能抑制菌落形成,增加细菌清除率。
PDX是促炎症消退介质的一种,其受体未知,G蛋白偶联受体(G protein-coupled receptor,GPCR)120是可能受体之一[19]。本研究发现GPR120(数据未显示)变化不明显,提示PDX可能通过其他相关受体影响CAMP的表达。JUNG等[8]的实验研究证明,PDX可能通过过氧化物酶体增殖物激活受体(peroxisome proliferator-activated receptor α,PPARα)参与胰岛素抵抗;PDX同样通过PPARα受体参与到巨噬细胞的极化[20];因此,PDX通过何种受体影响CAMP的表达有待继续研究。
关于CAMP的表达机制有很多,黄芪多糖能激活P38 MAPK/JNK和NF-κB通路促进上皮细胞CAMP的表达[21];IL-12和IL-18共同作用激活P38 MAPK和STAT4通路,进而刺激人巨噬细胞和上皮细胞CAMP的表达[22];本研究探讨了MAPK通路中的ERK和P38通路。Western blot结果显示,PDX对ERK MAPK表达无明显影响,提示PDX可能通过其他通路影响CAMP表达。与此同时,Western blot结果发现,相对于Sham组,CLP组小鼠P38通路被抑制,然而PDX干预明显激活P38 MAPK通路,同时上调CAMP表达。加入P38 MAPK抑制剂SB203580后发现,PDX对CAMP的表达影响消失了,由此我们可以推断,PDX通过调控P38 MAPK通路影响CAMP的表达。研究显示,CAMP的表达与NF-κB[21,23-24]相关,然而PDX是否通过影响NF-κB的激活,从而影响CAMP的表达,这一点还需继续探索。
综上所述,PDX通过影响P38 MAPK通路,从基因水平以及蛋白水平增加脓毒症性ARDS抗菌肽CAMP的表达,进而增加细菌清除率,改善肺部炎症状态,促进炎症及时消退,保护脓毒症小鼠肺损伤。
