广东省中山地区汉族精神类疾病患者药物基因型及代谢表型分布研究*
2019-06-21平军娇高永双邓顺顺杜宝国
平军娇,高永双,邓顺顺,章 杰,万 静,杜宝国,钱 刚
(1.中山市第三人民医院a.检验科;b.药剂科;c.早期干预科,广东中山 528451;2.遵义医学院细胞生物学与遗传学教研室,贵州遵义 563099)
药物是精神分裂症、双相情感障碍等重性精神疾病的临床主要治疗方法。目前,重性精神疾病的药物治疗有效率仅为30%~50%,这不仅阻碍了患者的疾病康复,同时增加了患者家庭的经济负担[1]。在影响药物疗效的诸多因素中,抗精神病药物相关受体效应基因表型和肝脏药物代谢酶基因特征是影响药物生物学活性和体内代谢速率的关键因素。受体效应表型的基因多态性参与了重性精神疾病发病过程并部分影响了抗精神病药物的受体结合程度。Ⅰ 相代谢和 Ⅱ 相代谢能力的个体差异性是维持精神病治疗药物有效血药浓度的基础条件。既往研究结果证实,肝脏Ⅰ相代谢主要由细胞色素氧化酶(CYP450)和N-乙酰基转移酶2(N-acetyltransferase 2,NAT2)承担。其中,CYP450酶系及其多种同工酶(CYP2D6,CYP2C19,CYP3A4,CYP3A5和CYP1A2)参与了绝大多数精神科药物的代谢过程[2]。细胞色素氧化酶活性的个体差异主要受其基因多态性影响。少量研究发现,Ⅱ 相代谢中的尿苷二磷酸葡萄糖醛酸转移酶(UDP glucuronosyl transferase,UGT)酶系家族成员(UGT2B7和UGT2B15)主要参与了丙戊酸钠、卡马西平等情感稳定剂的代谢过程,其基因突变类型可能与药物的不良反应或中毒有关[3]。
既往关于精神疾病患者药物代谢酶类基因学研究多存在目标基因范围局限、基因位点缺乏临床相关性、疾病研究病种单一等不足,尚缺乏多种精神疾病间基因组学特征的研究结果。本研究拟利用基因组学分析技术,同时对精神类疾病患者进行基因组学(包括8个药物代谢基因及5个药物效应基因)检测,分析中山市重性精神疾病中药物基因型及代谢表型分布特征,分析疾病间的基因表型差异,为临床重性精神疾病的个体化治疗提供基因组学研究依据。
1材料与方法
1.1 研究对象 收集2018年1月~2019年2月在中山市第三人民医院住院患者155例,其中精神分裂症患者95例,对其临床资料进行回顾性分析。男性62例,女性33例,平均年龄37.68岁。所有患者均为汉族,且居住于中山地区,符合《国际疾病分类》第10版(ICD-10)精神分裂症诊断标准,排除并发有其他精神障碍患者。该研究患者均已签署知情同意书,将此精神分裂症患者设为研究组A。心境障碍患者30例,对其临床资料进行回顾性分析。男性19例,女性11例,平均年龄38.45岁。所有患者均为汉族,且居住于中山地区,符合《国际疾病分类》第10版(ICD-10)心境障碍诊断标准,排除并发有其他精神障碍患者。将此心境障碍患者设为研究组B。精神类疾病患者(排除精神分裂症和心境障碍患者)30例,对其临床资料进行回顾性分析。男性16例,女性14例,平均年龄33.40岁,所有患者均为汉族,且居住于中山地区,此类患者为研究组C。
本研究经本院医学伦理委员会批准,所有受试者均知情同意。
1.2 试剂和仪器 本研究共对13个基因的多态性进行检测,包含8个药物代谢基因及5个药物效应基因。本研究采用Agena Bioscience MassARRAY DNA 质谱基因分析系统、AB Sciex 3200MD液质串联(LC/MS/MS)三重四级杆质谱系统、Therom Fisher Applied Biosystems 7500实时荧光定量PCR系统、飞行时间质谱仪等来进行检测,仪器分析系统和检测由上海康黎医学检验所提供。
1.3 方法
1.3.1 标本采集:本研究所用实验标本为口腔拭子,从采样盒内取出口腔拭子套管,小心撕开外包装,拔掉保护套,握住手柄,将棉棒头放入口内腮帮处,分别由两侧上下剐蹭并旋转棉棒10~20次左右,刮取口腔内脱落细胞,将保护套盖回。
1.3.2 标本DNA提取:使用天根生化的DNA提取试剂盒(离心柱型)来提取基因组,具体操作步骤参照试剂说明书。
1.3.3 PCR扩增:采用Agena公司全套iPLEX Pro基因分型试剂盒进行PCR反应,PCR反应程序为:95℃预变性2 min,95℃变性30 s,60℃退火30 s,72℃延伸60 s,进行45次循环;最后72℃延伸5 min,4℃保存。
1.3.4 SAP反应:PCR反应结束后,将PCR反应液中每孔加入SAP buffer:0.17 μl,SAP Enzyme:0.3 μl,ddH2O:1.53 μl。反应程序为:37℃40 min,85℃5 min,4 ℃保存。
1.3.5 单碱基延伸反应:反应体系为纯化后PCR产物7 μl,iPLEX缓冲液0.2 μl,iPLEX特异性终止反应液0.2 μl,延伸引物0.94 μl,iPLEX酶0.041 μl,ddH2O 0.619 μl共9 μl。反应条件为:94 ℃预变性30 s;94 ℃变性5 s,52 ℃退火5 s,80 ℃延伸5 s,共进行40次循环(其中52 ℃退火5 s及80 ℃延伸5 s进行5次循环);最后72 ℃延伸3 min。样本脱盐调节及点样到芯片。
1.3.6 质谱结果分析:采用TyperAnalyzer软件分析基因分型数据。
1.4 统计学分析 采用SPSS 20.0 软件进行统计学处理,组间药物基因型及表型比较用卡方检验,以P<0.05为差异有统计学意义。
2结果
2.1 药物基因多态性检测位点 本研究共检测8个药物代谢基因的多态性和5个药物效应基因的多态性,药物代谢基因分别为:CYP2D6,CYP1A2,CYP3A4,CYP2C19,CYP3A5,N-乙酰基转移酶2(N-acetyltransferase 2,NAT2),葡萄糖醛酸转移酶2B7(glucuronosyltransferase,UGT2B7)和葡萄糖醛酸转移酶2B15(glucuronosyltransferase,UGT2B15)。药物效应基因分别为:黑素皮质素受体-4(melanocortin-4 receptor,MC4R),多巴胺D2受体(dopamine D2 receptor,DRD2),5-羟色胺受体2A(5-hydroxytryptamine,HTR2A),5-羟色胺受体2C(5-hydroxytryptamine,HTR2C)和他克莫司结合蛋白(FK506 binding protein 5,FKBP5)。13个药物基因多态性检测位点,见表1。

表1 药物基因多态性检测位点
2.2 精神类药物基因代谢表型分布 经检测结果分析,155例(男性=97例,女性=58例)精神疾病患者5个药物基因代谢表型分布频率见表2。CYP2D6,CYP2C19和NAT2基因中间代谢型频率最多,其次为广泛代谢型;CYP3A4基因表型全部为广泛代谢型;CYP1A2基因只发现两个表型,即超快代谢型和广泛代谢型,频率分别为50.3%和49.7%。
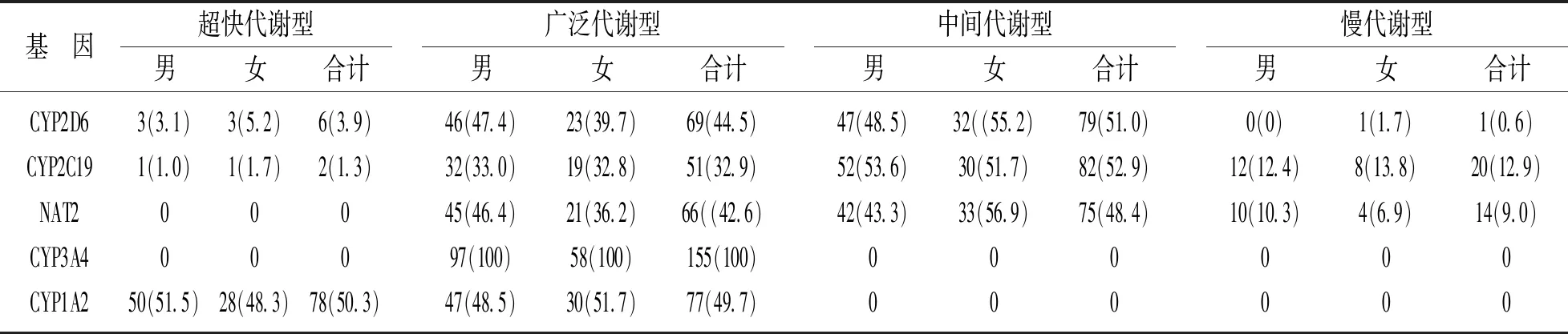
表2 药物基因代谢表型分布频率[n(%)]
2.3 精神类药物基因型分布 见表3。经检测结果分析,CYP3A5,UGT2B7,UGT2B15和FKBP5基因型中突变纯合型频率最多,其次为突变杂合型,野生纯合型频率最少。MC4R和DRD2基因型中野生纯合型出现频率最高,其次为突变杂合型,突变纯合型出现频率最少;HTR2A基因突变杂合型出现频率最高,HTR2C基因型在所测样本中突变杂合型频率为99.4%,只出现1例突变纯合型。
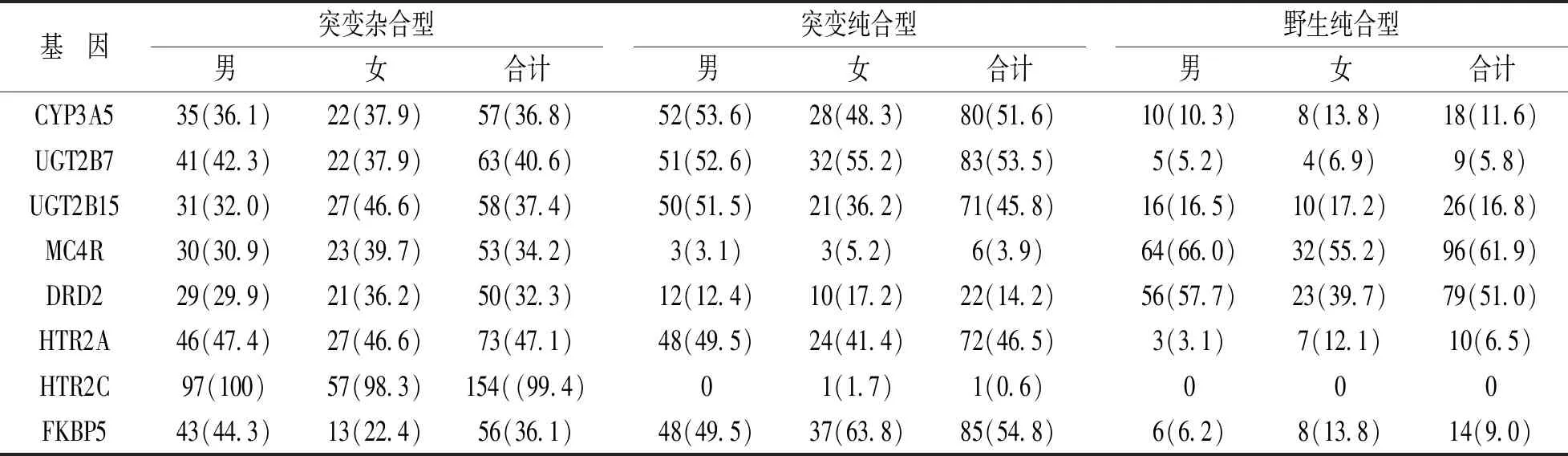
表3 药物基因型分布频率[n(%)]
2.4 组间药物基因代谢表型差异分析 见表4。本研究入组精神分裂症患者95例(A组),心境障碍患者30例(B组),其他精神类疾病30例(C组),对其进行药物代谢基因表型差异性分析。经三组间差异性统计分析发现CYP2C19基因慢代谢型和NAT2基因慢代谢型组间差异有统计学意义(P=0.002,0.040)。
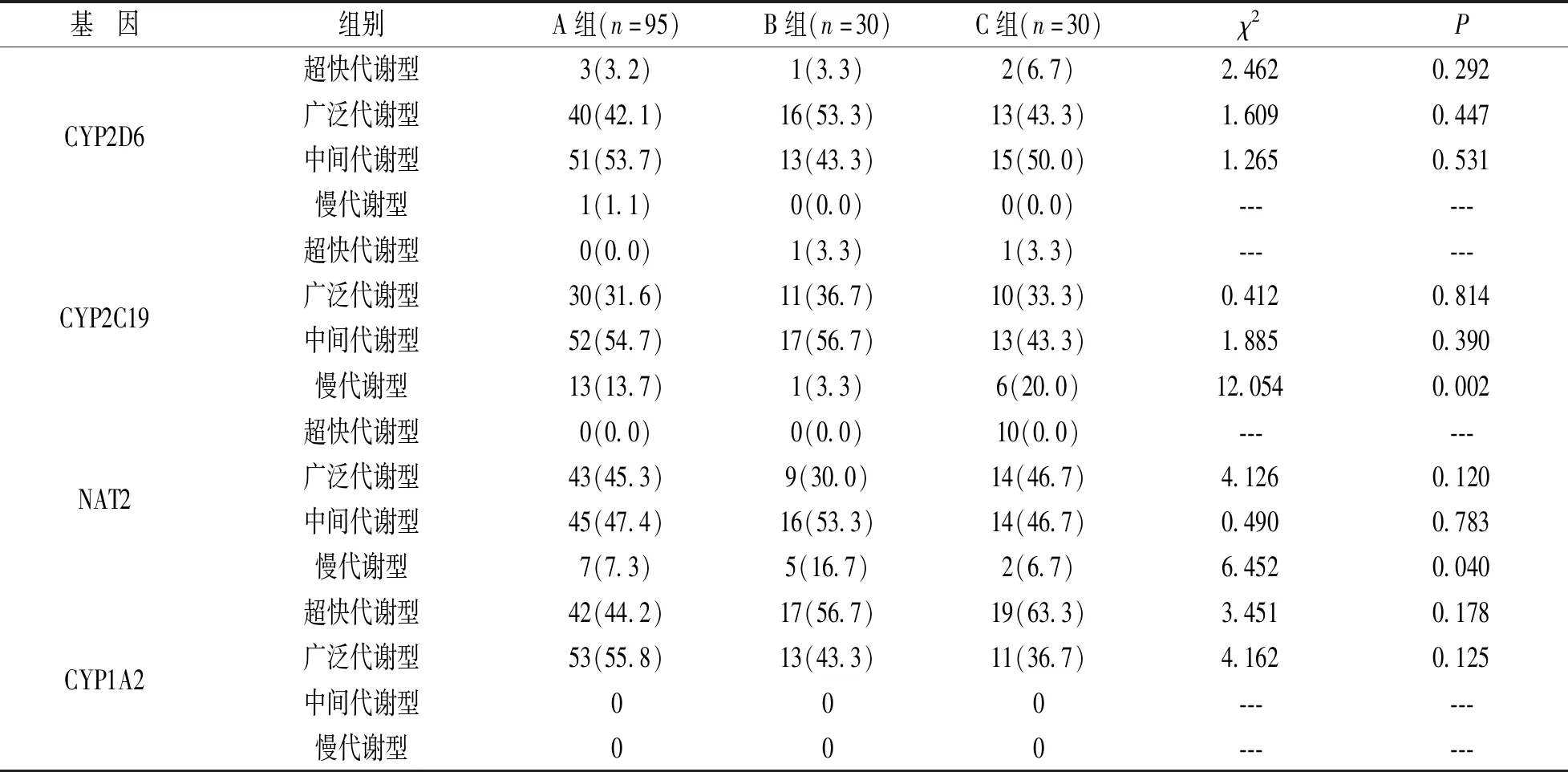
表4 组间药物基因代谢表型分析[n(%)]
2.5 组间药物基因型差异分析 见表5。CYP3A5基因野生纯合型,UGT2B15基因突变杂合型,MC4R基因野生纯合型和突变杂合型组间差异有统计学意义(P=0.02,0.029,0.048,0.049)。
3讨论遗传因素对抗精神病药物疗效的影响至关重要,药物基因组学随着分子遗传学技术的日新月异得到快速发展,目前多种抗精神病药物添加了药物基因组学的信息,逐渐成为指导临床合理用药的必要手段和强有力的工具。
由于药物基因的变异引起药物在体内药效及代谢过程改变,进而引起临床治疗效果改变和产生药物不良反应,本研究综合国内外精神类药物基因的有关报道,对13个药物基因的多态性进行检测。CYP2C19和CYP2D6参与多种抗精神病药物在体内的代谢,其基因具有高度遗传多态性[4]。CYP2C19功能缺失型等位基因表现为慢代谢型,会导致酶活性降低和代谢能力下降,常规剂量药物治疗出现较高血药水平,且存在着广泛的地域和种族差异[5-8],因此调查不同人群的CYP2C19基因多态性的分布特征有助于指导临床用药。本研究结果提示中山地区精神分裂症患者中有较多的慢代谢型,在使用经CYP2C19基因代谢的药物时,应结合患者基因代谢类型和血药浓度水平调整药物剂量。研究发现CYP2D6是细胞色素P450家族中唯一不能被诱导的酶,参与了抗精神分裂症药和抗抑郁药在体内的代谢[9]。CYP2D6基因在不同国家和地区中各代谢型的分布比例不同[10-11],据文献统计在亚洲人口中50%表现为中间代谢型(IMs)[12],仅1%左右出现慢代谢型(PMs),而西方人口中表现出较多的PMs型。本研究结果提示51.5%的精神类患者在服用经CYP2D6代谢的药物时存在药物代谢速率减慢,血药浓度升高,因此应结合患者的代谢类型调整药物剂量。NAT2在肝脏内可参与多种药物的代谢,并可引起肝损害[13],国内对精神类疾病NAT2基因多态性的研究鲜见,本研究结果推测57.4%的患者在服用经NAT2代谢的药物时会出现药物代谢减慢,药物浓度升高导致药物不良反应风险增加,应结合血药浓度监测,必要时更换其他药物。组间比较发现NAT2基因慢代谢型有统计学差异,心境障碍组有较多的慢代谢型患者,因此心境障碍患者应密切观察临床治疗效果和不良反应的发生。
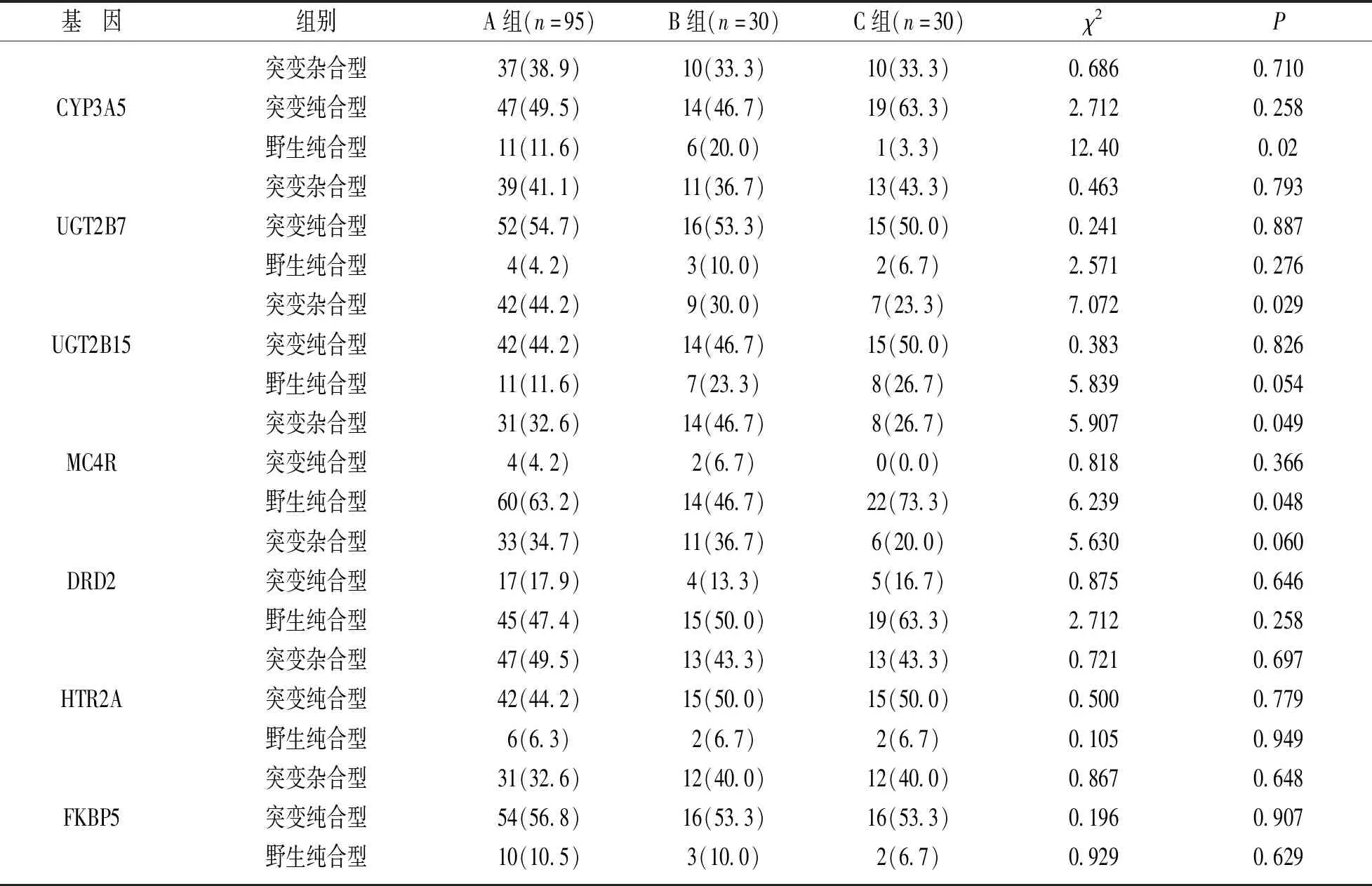
表5 组间药物基因型分析[n(%)]
CYP3A是药物代谢反应中主要的限速酶,其中CYP3A5参与了约50%常用药物的代谢,是CYP3A亚家族中最主要的肝外表达形式,其活性和表达主要由单核苷酸多态性位点(SNP)所决定,CYP3A5*3(rs776746) 是影响CYP3A5个体化差异和底物血药浓度的主要原因[14],本研究结果显示51.6%的突变纯合型患者会发生药物代谢减慢,血药浓度升高导致不良反应风险增加,三组间CYP3A5基因野生纯合型比较差异有统计学意义。心境障碍患者中有较多的野生纯合型,推测心境障碍患者在服用经CYP3A5代谢的药物时药物不良反应的风险较小。在已鉴定的多个细胞色素P450同工酶中,CYP1A2存在于肝脏,为“增毒”同工酶,研究发现其基因多态性与抗精神病药疗效及发生迟发性运动障碍有关[15]。本研究结果显示CYP1A2基因超快代谢型低于陈柯霖等[16]报道的68.1%,与美籍非洲精神分裂症患者(52%)和日本患者(49.7%)接近,提示该多态性存在地区和种族差异。
FKBP5基因多态性与抑郁症及自杀症状有显著相关性,增加抑郁症复发及药物抵抗的风险,预测抑郁症药物的治疗应答率[17]。国内关于MC4R和FKBP5基因多态性与精神类药物之间的研究比较鲜见,本研究结果提示中山地区3.9%的突变纯合型患者发生体重增加、高脂血症等不良反应的风险较高,在临床治疗中应密切观察不良反应发生情况;91.0%的患者FKBP5基因表现为突变型,对药物应答不佳,可适量增加剂量并结合血药浓度观察临床疗效。既往研究发现,药物效应基因DRD2基因多态性与抗精神病药物疗效相关[18-19]。本研究结果显示49%的突变型精神类疾病患者对利培酮等药物的应答不佳,治疗过程中应结合血药浓度水平调整药物剂量。UGT 酶系家族中UGT2B7和UGT2B15参与了丙戊酸钠、卡马西平、劳拉西泮、奥沙西和米格列奈等精神类药物的代谢,UGT2B7基因突变型个体药物应答较差,可能引起药物不良反应或药物中毒[3]。本研究结果显示94.2%的突变型患者药物应答和效果较差,应密切观察临床疗效和不良反应发生情况;45.8%的突变纯合型药物清除率增加,可能导致疗效降低,可根据临床实际反应适当增加剂量。HTR2A和HTR2C基因多态性同时和精神分裂症发病易感性以及抗精神病药物疗效联系紧密[20]。氯氮平通过拮抗HTR2A受体和HTR2C受体在难治性精神分裂症的治疗中发挥疗效[21]。血浆药物浓度水平是影响重性精神病治疗药物疗效和安全性的重要因素。有研究发现携带有HTR2A基因突变型患者使用抗精神病药物疗效好于野生型患者[20],本研究结果提示6.5%的野生纯合型患者治疗过程中结合代谢类型和血药浓度监测,密切观察临床疗效,必要时调整药物剂量或更换其他药物。
综上,本研究通过荟萃分析中山市重性精神疾病中药物基因型及代谢表型分布特征,以及疾病间的基因表型差异,为临床重性精神疾病的个体化治疗提供基因组学研究依据,今后本课题组将增加药物基因型与临床疗效方面的研究,将药物基因组学检测与临床实践密切结合,实现个体化精准治疗。
