老年心脑血管病影像学诊断与MTHFR基因多态性及同型半胱氨酸水平的相关性
2019-06-21李卓然高咏璇林楚莹秦琴保梁广铁阙志权雷秀霞江新青
李卓然 高咏璇 林楚莹 秦琴保 梁广铁 阙志权 雷秀霞 江新青
广州医科大学附属广州市第一人民医院1放射科,2检验科,3老年病科(广州510180)
近年心脑血管疾病已成为我国发病率及死亡率最高的疾病之一[1]。随着医学的发展,各种先进诊疗技术如电子计算机断层扫描(computed tomography,CT)/核磁共振成像(magnetic resonance imaging,MRI)以及分子诊断技术的广泛应用,使心脑血管疾病的早期诊疗成为可能。研究[2]发现高同型半胱氨酸血症(hyperhomocystinemia,HHcy)会引起血管内皮广泛受损,血液杂质容易沉积在血管内而引起血管硬化及血管闭塞,从而诱发心脑血管疾病的发生,是动脉粥样硬化与动脉硬化的独立危险因素。相关研究结果[3]显示:同型半胱氨酸(homocysteine,Hcy)每升高5 μmol/L 脑卒中风险升高59%,缺血性心脏病风险升高32%。体内Hcy 浓度除了受叶酸及B 族维生素等的影响外,还受一些代谢酶遗传多态性的限制,而亚甲基四氢叶酸还原酶(methylene tetrahydrofolate reductase,MTHFR)是Hcy 代谢过程中最重要的调节酶,该基因的C677T 位点发生突变将会导致体内Hcy 水平增高从而诱发心脑血管疾病的发生[4]。本研究拟对笔者医院收治的部分老年心脑血管疾病患者颅脑部CT/MRI 影像学、颈动脉内膜中层厚度(carotid intima-media thickness,IMT)的诊断结果及血浆Hcy 含量改变与MTHFR基因多态性的关系作回顾性分析,旨在为临床早期预测心脑血管疾病的发生及对不同基因型的人群进行早期预防管理提供实验依据。
1 对象与方法
1.1 研究对象 选取2015年12月至2018年1月,在广州医科大学附属广州市第一人民医院进行MTHFR基因多态性检测的年龄≥60 岁的老年住院患者864例,其中男525例,女339 例,年龄(79.47 ± 9.30)岁。在864 例患者中排除:(1)慢性肾功能不全患者、接受肾脏移植患者;(2)甲状腺功能亢进或甲状腺功能减退患者;(3)急性肝功能受损患者;(4)恶性肿瘤患者;(5)近期服用甲氨蝶呤、茶碱、B 族维生素及叶酸患者后,被纳入研究对象的患者共有294 例,均为年龄在65~89 岁范围内,无亲缘关系的患者,采集并记录其颈动脉彩超影像、颅脑CT/MRI、冠心病病史等资料。本研究所涉及患者均已签署知情同意书并符合伦理审核。
1.2 分组 根据1995年第4 届全国脑血管病学术会议修订的诊断标准,对已行颅脑部CT/MRI 检查的864 例老年患者结合临床资料分为两组:脑梗死组(n=468),其中男331 例,女137 例,年龄(82.49 ± 8.23)岁;非脑梗死组(n=396),其中男194 例,女202 例,年龄(75.90 ± 9.24)岁。294 例患者根据2012年美国心脏协会冠心病(coronary heart disease,CHD)诊断指南分CHD 组(n=96)与非CHD 组(n=198);排除40 例所需研究资料不全的患者,根据颅脑部CT/MRI 分腔隙性脑梗死(lacunar infarction,LI)LI 组(n=207)与非LI 组(n=47);排除46 例无颈动脉彩超资料的患者,根据MTHFR 基因多态性分为3 组:CC 组(n=99)、CT 组(n=87)、TT 组(n=62)。
1.3 研究方法
1.3.1MTHFR基因多态性检测 采集EDTA 抗凝血2 mL,然后进行全血DNA 抽提—PCR 扩增—杂交—扫片,记录结果。MTHFR基因C677T 位点基因型分为:野生CC 型、杂合突变CT 型和纯合突变TT 型。芯片试剂盒由上海BaiO 公司提供。
1.3.2 血浆Hcy 水平检测 清晨空腹抽取静脉血3~5 mL,4 000 r/min 离心5 min,采用AU5800全自动生化分析仪进行检测,试剂由金斯尔公司提供。
1.3.3 颅脑部CT/MRI 检查 CT检查:采用Philips公司64 排螺旋CT 扫描机,扫描条件为120 kV,399 mAs,层厚、层间距均为5 mm,螺距为1.5 mm,FOV 为25.0 cm × 29.2 cm。常规平扫后,肘前静脉注射对比剂行增强扫描,使用高压注射器。颅脑CT 图像见图1。
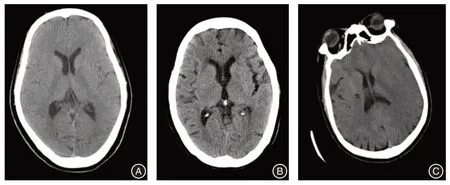
图1 颅脑CT 图像Fig.1 Brain CT imaging pictures
MRI 检查:采 用Philips Achieva1.5T MR 扫 描仪,采用常规自旋回波序列轴位T1W、T2W 和FLAIR序列。扫描参数:T1WI,TR 499 ms,TE 15 ms;T2WI,TR 3 567 ms,TE 100 ms;层厚6 mm,层间距0.5 mm,矩阵256×256。FLAIR序列,TR 6 000 ms,TE 120 ms。增强扫描参数同平扫T1WI,对比剂为Gd-DTPA,剂量0.1 mmol/kg 体质量,采用高压注射器自肘静脉注射。颅脑MRI 图像见图2。
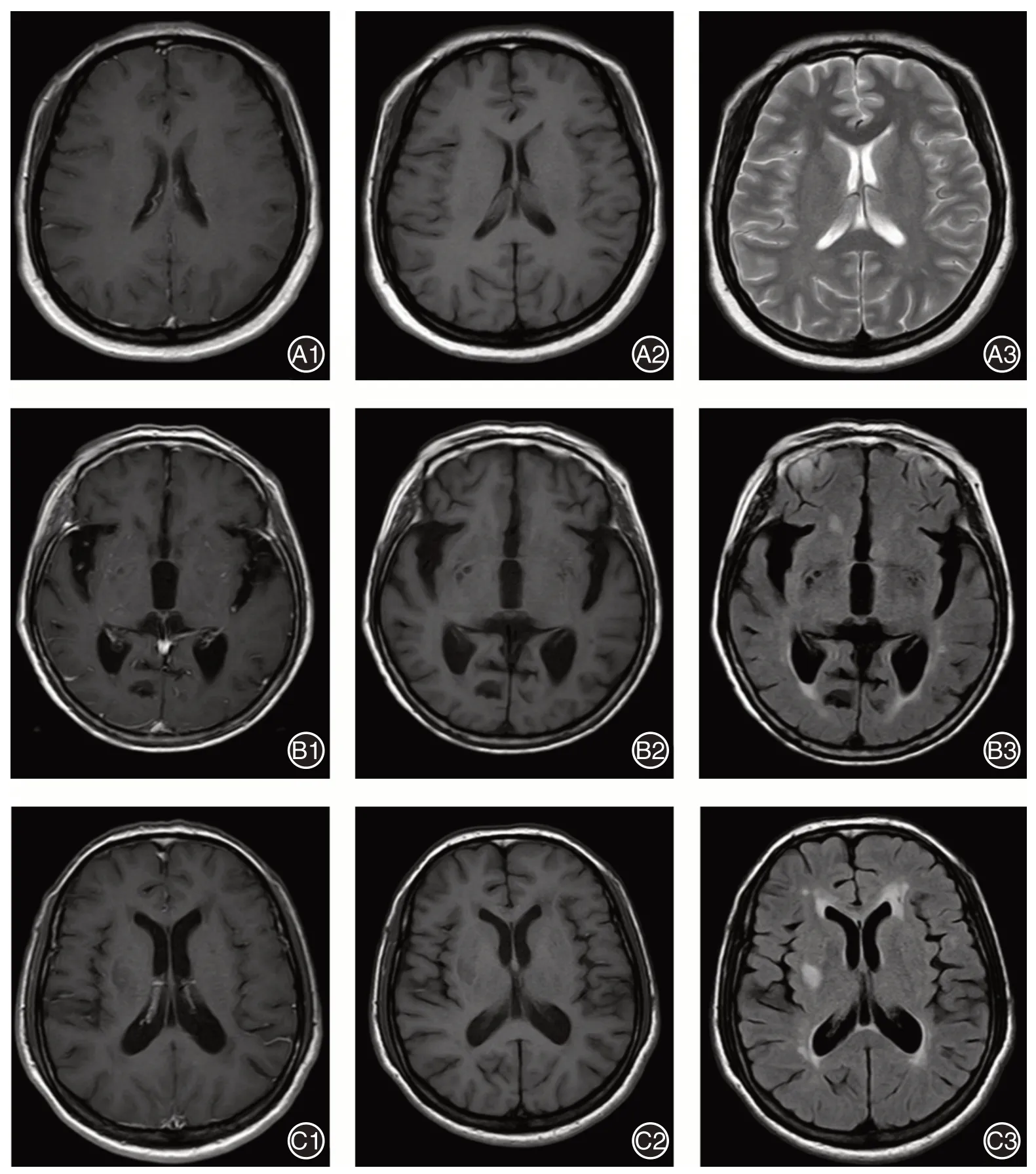
图2 颅脑MRI 图像Fig.2 Brain MRI imaging pictures
1.3.4 颈动脉内膜中层厚度测量方法及颈内膜分级标准 专业医师使用HP5500 彩色多普勒超声仪(4~10 MHz 线阵式探头),按标准操作规程测量颈动脉内膜中层厚度,通过测量血管内中膜厚度、血管腔直径以及观察血流情况等,判断颈动脉血管狭窄程度,并参照2003年北美放射年会中超声会议制定的诊断标准,将颈动脉内膜分为0~5级。见图3。
1.4 统计学方法 使用SPSS 22.0 统计软件,计量资料以表示,计数资料用百分比表示。计量资料采用t检验或非参数秩和检验,组间计量资料的比较若分布符合正态分布的采用t检验,相关性分析采用pearson 相关系数计算,不符合正态分布的数据采用非参数检验方法比较,相关性分析采用spearman 相关系数计算,计数资料采用χ2检验,P<0.05 为差异有统计学意义。采用Hardy-Weinberg(HWE)平衡检验进行群体遗传分析,P>0.05为符合HWE。
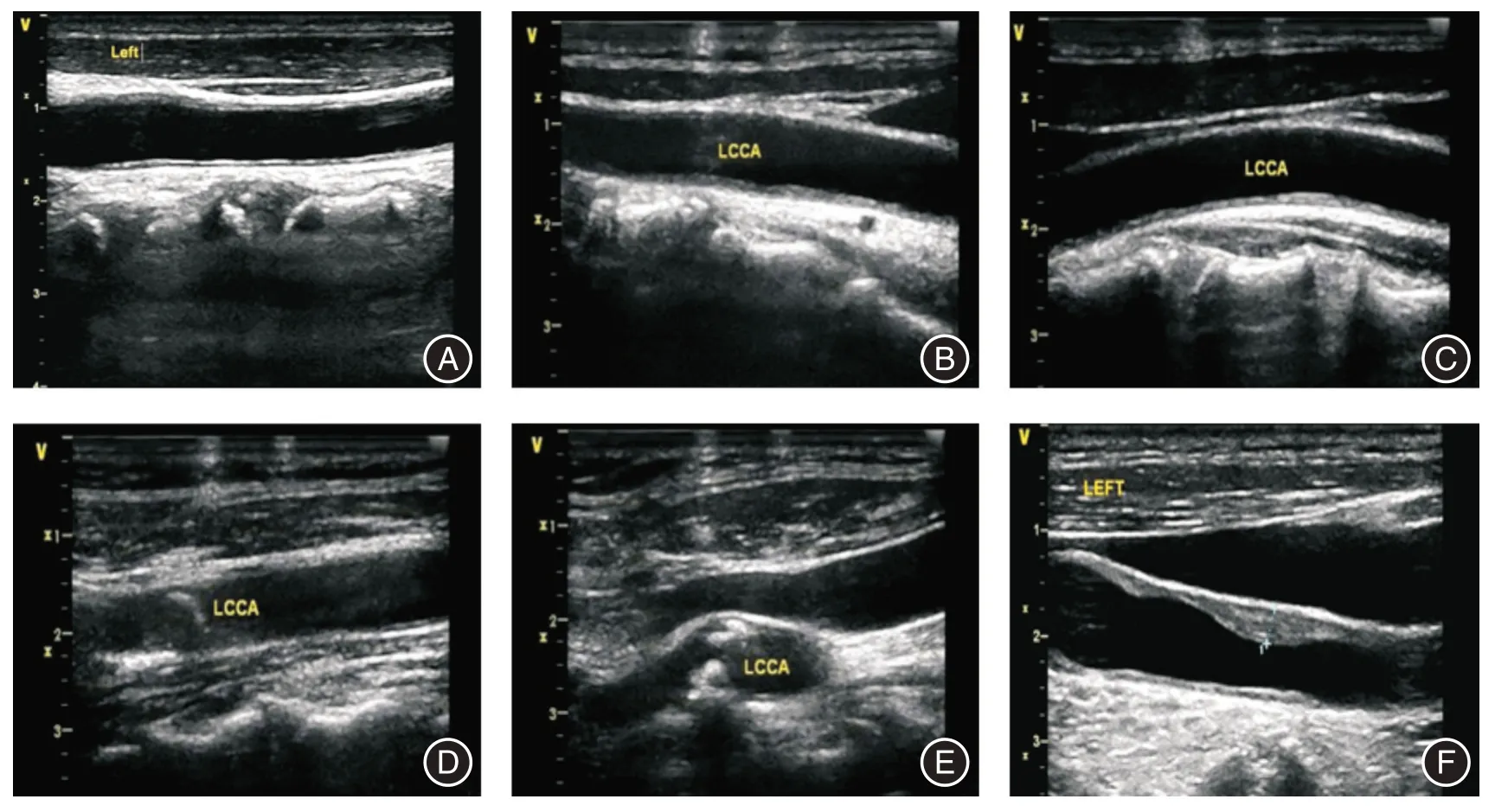
图3 颈动脉内膜0~5 级彩色多普勒超声图像Fig.3 Color doppler ultrasound image of carotid intima 0~5 level
2 结果
2.1 Hardy-Weinberg 平衡检验 864 例患者的基因检测结果,通过卡方检验计算实际基因型和理论基因型频数间的差异,结果显示3 种基因型符合遗传平衡定律(P>0.05),说明选取的研究对象具有群体代表性、恒定性。见表1。
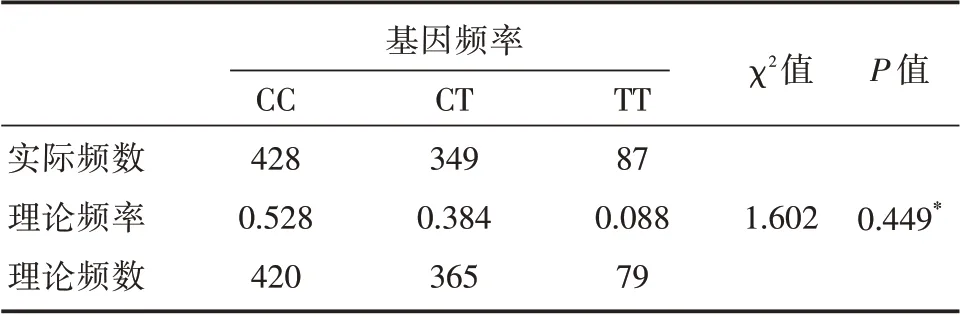
表1 MTHFR 基因型Hardy-Weinberg 平衡检验Tab.1 Hardy-Weinberg equilibrium test for MTHFR genotype
2.2 脑梗死组和非脑梗死组不同基因型占比比较 468 例脑梗死组患者CC 型、CT 型和TT 型3 种基因型所占百分率依次为43.38%、43.80%、12.82%;396 例非脑梗死组依次为56.82%、36.36%、6.82%,两组患者各基因型经Pearson 行列表卡方检验,差异有统计学意义(χ2=18.438,P<0.001)。见表2。另外,将两组患者中存在MTHFRC677T 位点突变的基因型(CT 型+ TT 型)和野生型(CC 型)进行四格表卡方检验,差异有统计学意义(χ2=15.505,P<0.001)。
2.3 CHD 组与非CHD 组结果分析
2.3.1 CHD 组与非CHD 组的MTHFR基因型及等位基因分组结果比较 从各基因型的频率分布来看,CHD 组与非CHD 组的MTHFRC677T 基因构成差异有统计学意义(χ2=7.187,P<0.05);前者的T/C 等位基因频率(109%)明显高于后者(66%)(χ2=8.129,P<0.05)。见表3。
2.3.2 CHD 组与非CHD 组患者血浆Hcy 水平比较 CHD 组与非CHD 组患者两组间血浆Hcy 水平比较差异无统计学意义(Z=-0.496,P>0.05)。两组组内TT 型患者的血浆Hcy 水平均显著高于CC型(Z=-2.032,Z=-2.630;均P<0.05);而CT型患者与CC 型患者的血浆Hcy 水平比较差异则无统计学意义(Z=-1.310,Z=-0.496;均P>0.05),但CT型患者血浆Hcy水平高于CC型患者。见表4。
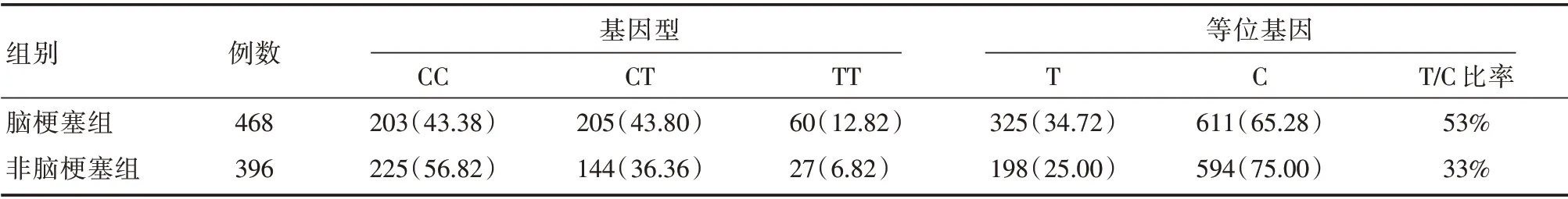
表2 脑梗塞组和非脑梗塞组的MTHFR 基因型分布Tab.2 Genotype frequency distribution of MTHFR genotype in cerebral infarction group and non-cerebral infarction group例(%)
2.4 LI 组与非LI 组结果分析
2.4.1 LI 组与非LI 组的MTHFR基因型及等位基因分组结果比较 从各基因型的频率分布来看,LI组与非LI 组相比差异有统计学意义(χ2=12.967,P<0.05);前者的T/C 等位基因频率(114%)明显高于后者(54%)(χ2=12.449,P<0.05)。见表3。
2.4.2 LI 组与非LI 组患者的血浆Hcy 水平比较 LI 组的血浆Hcy 水平与非LI 组相比差异无统计学意义(Z=-1.311,P>0.05)。两组组内的各基因型组患者的血浆Hcy水平比较差异均有统计学意义(χ2=183.338,χ2=138.872,均P<0.05);进一步比较发现TT 型、CT 型患者的血浆Hcy 水平均显著高于CC 型(Z=-12.841,Z=-5.694;Z=-3.326,Z=-3.976,均P<0.05)。见表4。
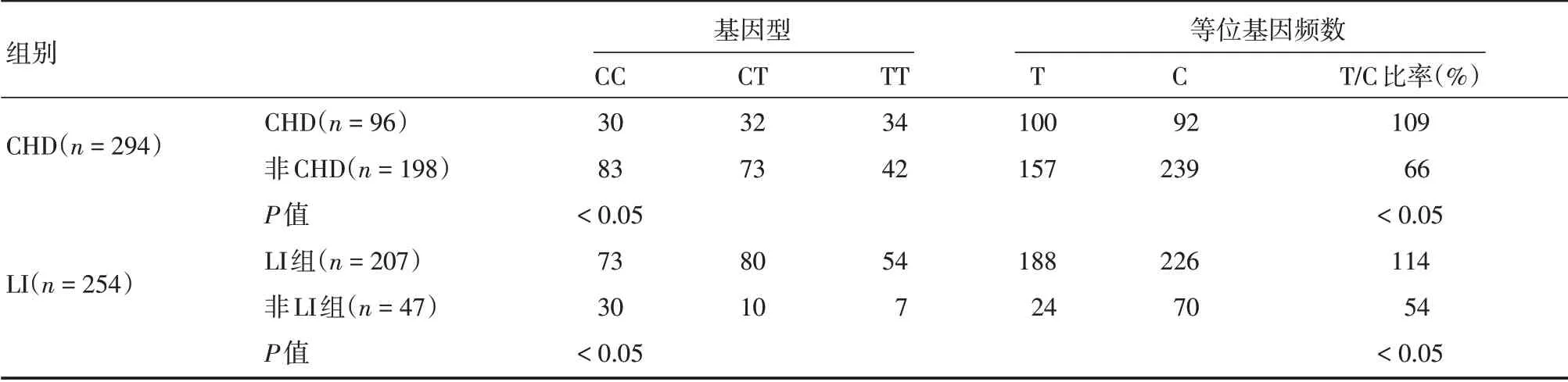
表3 两疾病组和对照组的MTHFR 基因型分布结果比较Tab.3 Genotype frequency distribution of MTHFR genotype in two diseases groups and control groups例
表4 两疾病组和对照组的血浆Hcy 水平结果比较Tab.4 Comparison of plasma Hcy levels in two diseases groups and control groups ±s,μmol/L
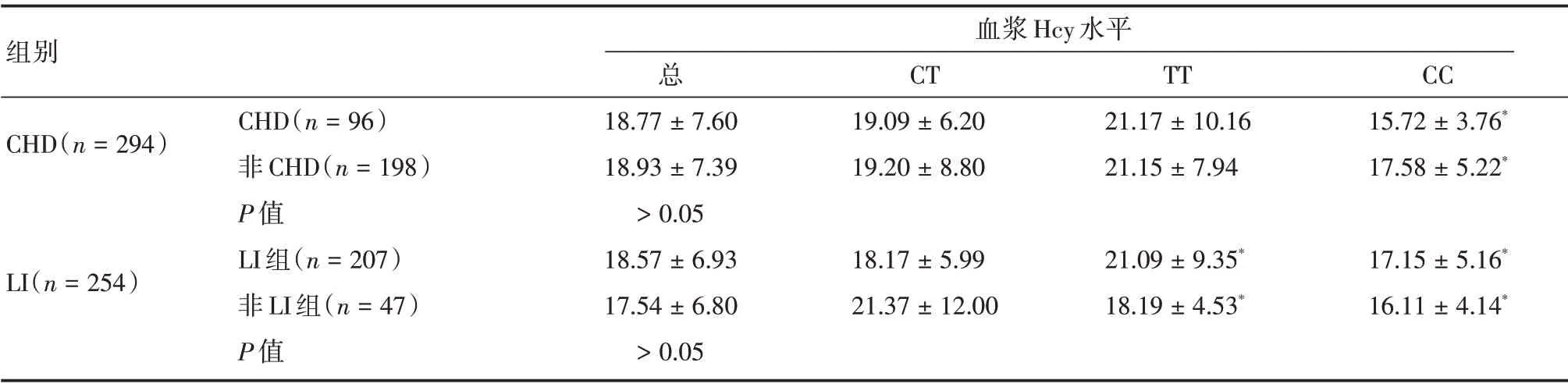
表4 两疾病组和对照组的血浆Hcy 水平结果比较Tab.4 Comparison of plasma Hcy levels in two diseases groups and control groups ±s,μmol/L
注:与TT 型经非参数秩和检验,*P <0.05
组别血浆Hcy 水平CHD(n=294)CT 19.09±6.20 19.20±8.80 TT 21.17±10.16 21.15±7.94 CC 15.72±3.76*17.58±5.22*LI(n=254)CHD(n=96)非CHD(n=198)P 值LI 组(n=207)非LI 组(n=47)P 值总18.77±7.60 18.93±7.39>0.05 18.57±6.93 17.54±6.80>0.05 18.17±5.99 21.37±12.00 21.09±9.35*18.19±4.53*17.15±5.16*16.11±4.14*
2.5 不同基因型颈动脉内膜中层厚度(IMT)及血浆Hcy 水平的比较 IMT 与血浆Hcy 水平的相关性分析结果显示两者无明显相关性(r2=0.016,P>0.05);各基因型组间的IMT 差异均无统计学意义(χ2=2.723,P>0.05),另各基因型组间颈动脉内膜分级构成差异亦无统计学意义(χ2=4.919,P>0.05)。见表5。
各基因型组血浆Hcy 水平差异有统计学意义(χ2=10.129,P<0.05),TT 型患者血浆Hcy 水平显著高于CC 型患者(Z=-3.206,P<0.05),CT 型患者血浆Hcy 水平高于CC 型,但差异无统计学意义(Z=-1.276,P>0.05)。见表6。
3 讨论
人体正常生理状态下空腹血浆Hcy 水平为5 ~15 μmol/L,当空腹血浆Hcy 水平持续高于15 μmol/L时就称为高同型半胱氨酸血症(HHcy)。血浆中Hcy 浓度水平受遗传因素、年龄、雌激素水平、营养状况、药物及疾病等多种因素影响[5],其中,遗传因素是影响HHcy 水平的重要因素,而MTHFR是Hcy 代谢最重要的调节酶,C677T 位点碱基纯合突变可作为HHcy 一个重要的遗传因素[6]。据文献[7]报道:MTHFRC677T 的TT 型突变可使正常酶活性降低70%,从而显著提高血浆内Hcy 水平。本研究结果显示,各心脑血管疾病组的突变纯合子TT 基因型平均Hcy 水平均显著高于野生CC 型,与以往研究报道一致[8]。说明TT 型基因突变确实会导致MTHFR 调节酶的活性减低。
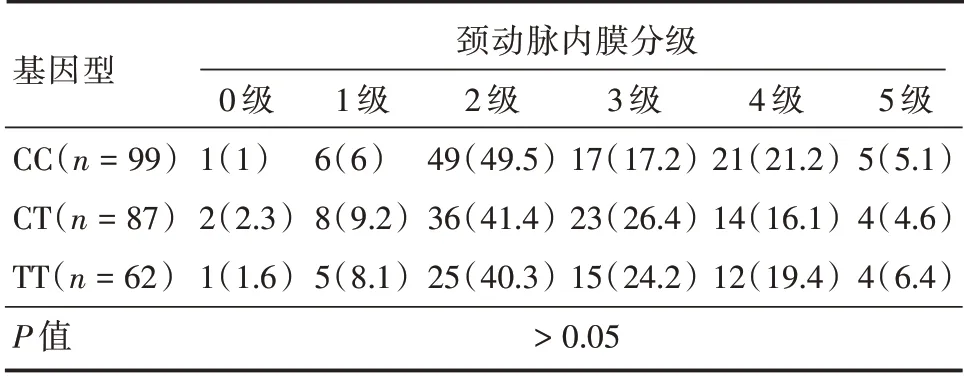
表5 不同基因型颈动脉内膜分级情况的比较Tab.5 Comparison of carotid intima level in different genotype 例(%)
表6 不同基因型颈动脉内膜厚度和血浆Hcy 水平的比较Tab.6 Comparison of carotid intima-media thickness,plasma Hcy levels in different genotype ±s
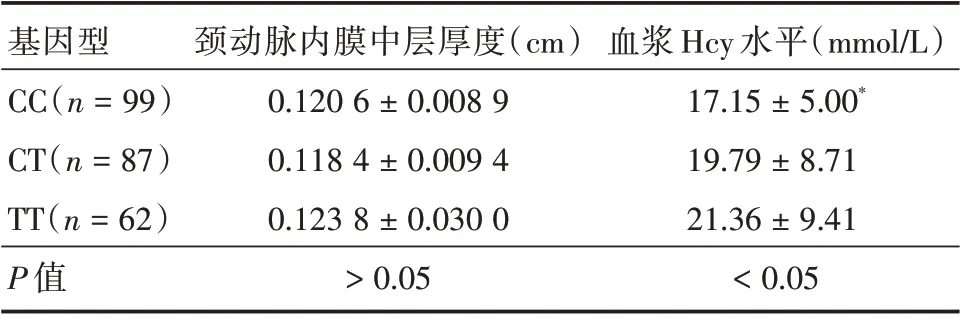
表6 不同基因型颈动脉内膜厚度和血浆Hcy 水平的比较Tab.6 Comparison of carotid intima-media thickness,plasma Hcy levels in different genotype ±s
注:与TT 型经非参数秩和检验,*P <0.05
基因型CC(n=99)CT(n=87)TT(n=62)P 值颈动脉内膜中层厚度(cm)0.120 6±0.008 9 0.118 4±0.009 4 0.123 8±0.030 0>0.05血浆Hcy 水平(mmol/L)17.15±5.00*19.79±8.71 21.36±9.41<0.05
冠心病(CHD)是指冠状动脉血管发生动脉粥样硬化病变而引起血管腔狭窄或阻塞,造成心肌缺血、缺氧或坏死而导致的心脏病,是动脉粥样硬化致器官病变的最常见的类型。黄晖等[9]认为血浆中Hcy 水平与冠状动脉病变的复杂程度密切相关,TANNE 等[10]研究发现血浆中高Hcy 水平与稳定性冠心病患者发生缺血性事件的风险相关;然而另一项Meta 分析[11]认为血浆中Hcy 水平与CHD的发病风险无相关关系,用叶酸和维生素B12 治疗并未发现可以降低心血管疾病高危人群的发病风险。本研究结果显示,CHD 组血浆Hcy 浓度水平与非CHD 组相比差异无统计学意义,提示在老年群体中,血浆Hcy 水平与冠心病发病风险未见直接相关关系。而WALD 等[12]从基因层面研究发现MTHFR基因C677T 基因突变纯合子TT 基因型人群发生冠状动脉疾病的风险更高,尤以低叶酸摄入的人群为著。本研究结果中也显示CHD 与非CHD 组的MTHFR基因构成分布及T/C 等位基因频率比较差异均有统计学意义,提示:携带T 等位基因的患者更容易发生CHD,MTHFRC677T 基因突变纯合子TT 型与CHD 发病风险密切相关。
脑小血管病(CSVD)主要以脑内微小动脉血管病变为主,是临床上常见的随年龄增长而伴发的一种疾病。CSVD 在MRI 上主要表现为腔隙性脑梗死(LI)、脑白质病变、陈旧性脑微出血、脑萎缩等。王立侠等[13]认为引起脑小动脉内皮损伤所需的Hcy 浓度低于在主动脉中引发同类效应所需的浓度,也就是说脑小血管对HHcy 水平更为敏感。有学者研究发现[14],Hcy 与CSVD 的预后与风险转归密切相关,血浆Hcy 水平越高,CSVD 患者的认知功能评分越低。JEON 等[15]研究也表明,TT型与血浆中高Hcy 水平有关,与动脉粥样硬化性大血管病及脑小血管病的发病无关,但RUTTEN等[16]发现,T 等位基因与LI 及脑白质病变均有关,且TT 型与LI 的发病具有强关联性。本研究结果显示,在脑小血管病中,LI 组与非LI 组之间的血浆Hcy 水平比较差异无统计学意义,提示在老年群体中血浆Hcy 水平与CVSD 无相关关系;但LI 组与非LI 组的TT 等位基因分布及T/C 等位基因频率比较差异有统计学意义,提示携带T 等位基因者LI 的发生风险增加。
颈动脉内膜中层厚度(IMT)是动脉粥样硬化的早期表现,颈动脉硬化及硬化程度可用来预测心脑血管疾病的发生风险。姜红霞等[18]在校正了性别、年龄、高血压、糖尿病等因素后,认为HHcy与颈动脉狭窄程度密切相关。另外,赵成敏等[19]研究表明在HHcy 人群中,血浆Hcy 水平与IMT 呈明显的正相关关系。CATENA 等[20]发现血浆Hcy水平与颈动脉斑块发生风险有关;聂颖等[21]认为血浆Hcy 水平与颈动脉斑块的分布与程度有关;吴庆庆等[22]研究表明MTHFRC677T 基因突变纯合子TT 型会导致较高的IMT 和颈动脉斑块发生率。但李振洲等[23]则认为MTHFR基因多态性突变对颈动脉粥样硬化无直接致病关系。本研究结果显示,血浆Hcy 水平与IMT 未见相关关系;MTHFR基因多态性C677T 基因突变纯合子TT 型对颈动脉粥样硬化的致病性及严重程度均未见直接相关关系,与李振洲等[22]的研究结果一致。
另外,本研究结果显示,脑梗死组MTHFR基因TT 型和CT 型患者比例显著高于非脑梗死组(P<0.01),说明MTHFRC677T 突变与脑梗死的发生密切相关,与文献[24-25]报道一致。
本研究结果显示:在CHD 和LI 分组中,疾病组和非疾病组的血浆Hcy 水平差异均没有统计学意义,可能与本研究入选病例年龄普遍较大、Hcy水平普遍较高有关;另外,本研究还存在一些不足之处,由于本研究研究对象为老年人群,受患者年龄和所需影像学检查数据等因素的限制,故最后能满足研究所需的完整病案资料的病例数较少,在864 例老年患者中只筛选出294 例,所以还缺乏大数据支持。同时本研究未对CHD 和LI 并发病例进行单独讨论,对患多种疾病病例的分析可能还不够全面。后续还将进一步扩大观察病例数和年龄段、细化入选对象、建立回归分析模型,并对影像学数据作进一步的量化处理以期得到更有效、更精准的实验数据。
近年,精准医学已得到学者们的高度重视,基因检测作为精准医学的重要组成部分,有望进一步结合临床影像学改变而助力预防医学发展,也就是说可通过对不同基因型的人群实施疾病的早期预防性管理、个体化用药,以达到降低心脑血管疾病的发生风险和致残风险的目的。
