肺癌组织中GARP阳性Treg细胞浸润水平及临床特征的关系
2019-06-21廖明王昂禤艺文彭丽君唐勇
廖明 王昂 禤艺文 彭丽君 唐勇
1 中国人民解放军南部战区总医院胸外科(广州510010);2广东省第二人民医院肿瘤一科(广州510317)
近年来,众多证据[1-2]表明肿瘤微环境在肿瘤病情进展、侵袭和转移中起重要作用。肿瘤具有先天性和获得性免疫的浸润细胞,例如髓源性抑制细胞,巨噬细胞,树突细胞,肥大细胞,嗜酸性粒细胞,中性粒细胞,NK 细胞和淋巴细胞[3],构成复杂的调节网络,促进了肿瘤逃避免疫监视和生长[4]。调节性T 细胞(regulatory T cells,Tregs)作为主要的免疫抑制细胞,可以抑制抗肿瘤免疫反应并促进肿瘤进展[5]。Tregs 的免疫抑制活性使其成为免疫治疗的有效靶点之一,但目前对于Tregs 在组织中的检测受到缺乏特异性标志物的限制。Foxp3 是Tregs 的发育和功能所必需的转录因子[6],但由于Foxp3 位于细胞核中,并且它也可以在常规T 细胞中表达[7],因此多种细胞表面和细胞内分子的Foxp3 影响了对组织中Tregs 浸润程度的判断。糖蛋白A 为主重复序列(glycoprotein A repetitions predominant,GARP),一种由662 个氨基酸残基组成的跨膜蛋白,在某些Tregs 亚群的表面高度表达,并通过T 细胞受体刺激激活[8]。GARP 阳性Tregs 成为TGF-β分泌的重要来源,因此,GARP 阳性Tregs 亚群具有很强的免疫抑制作用[9]。然而,GARP + Tregs 在肿瘤微环境中的浸润水平以及其作用值得进一步探讨。本研究拟通过检测肺癌肿瘤组织中GARP 阳性Treg 细胞浸润水平,并分析GARP 阳性Treg 浸润水平和肺癌患者临床特征的关系。
1 资料与方法
1.1 一般资料 选取2015年2月至2018年1月因肺癌于我院行手术治疗患者共93 例,纳入标准:(1)术后病理确诊为肺癌;(2)临床资料完整;(3)术前未进行放疗、化疗和靶向治疗;(4)获得患者知情同意;排除合并免疫性疾病以及全身多发肿瘤患者;本研究获得医院伦理委员会审核并批准。93 例肺癌患者中男51 例,女42 例,平均年龄(56.4±7.6)岁,范围38~76 岁,其中TNM 分期为Ⅰ期29 例,Ⅱ期27 例,Ⅲ期26 例,Ⅳ期11 例。
1.2 临床标本收集和免疫组化 免疫组化染色由我院病理科医师进行,取手术切除的肺癌组织样品,常规固定在10%中性缓冲福尔马林中并包埋在石蜡中。将石蜡包埋的肺癌组织和癌旁组织切成4 μm 厚的切片,并将切片脱蜡脱水后,采用3%过氧化氢处理组织切片,再用PBS 冲洗3 遍。按照以下步骤进行抗原修复:将切片浸入EDTA 溶液(pH8.0)中,并用微波加热样品。采用胎牛血清处理30 min 以减少非特异性结合,一抗Anti-GRAP antibody 够自(Abcam,ab97344),在4 ℃孵育过夜。在第一抗体反应后,将样品与HRP 标记的山羊抗兔二抗(Abcam,ab6721)室温孵育30 min。通过使用二氨基联苯胺底物显色,然后用苏木精复染载玻片后封片。由两名病理科医师随机选择肺癌癌组织和癌旁组织切片的5 个视野(×200)进行拍照后进行分析。
1.3 免疫组化评估 通过Image-Proplus 6.0 软件测量组织照片中肺癌组织和癌旁组织的GRAP 阳性Treg 细胞在组织中的浸润密度。所有图像均使用相同的显微镜和相机组拍摄。具体操作为先通过软件使所有测量照片的背景一致后,采用软件分析GRAP 阳性Treg 细胞的特征颜色,再根据该颜色计算整个照片中的细胞数,采用“细胞数/视野”表示组织中GRAP 阳性Treg 细胞的浸润密度,其中93 例肺癌患者肺癌GARP 阳性Treg 的中位阳性细胞数为28 个/视野,因此以肺癌组织中浸润GARP 阳性Treg>28 个/视野的为高浸润组(46 例),≤28 个/视野的患者为低浸润组(47 例)。具体GARP 阳性Treg 在肺癌组织和正常肺组织中的浸润情况见图1。
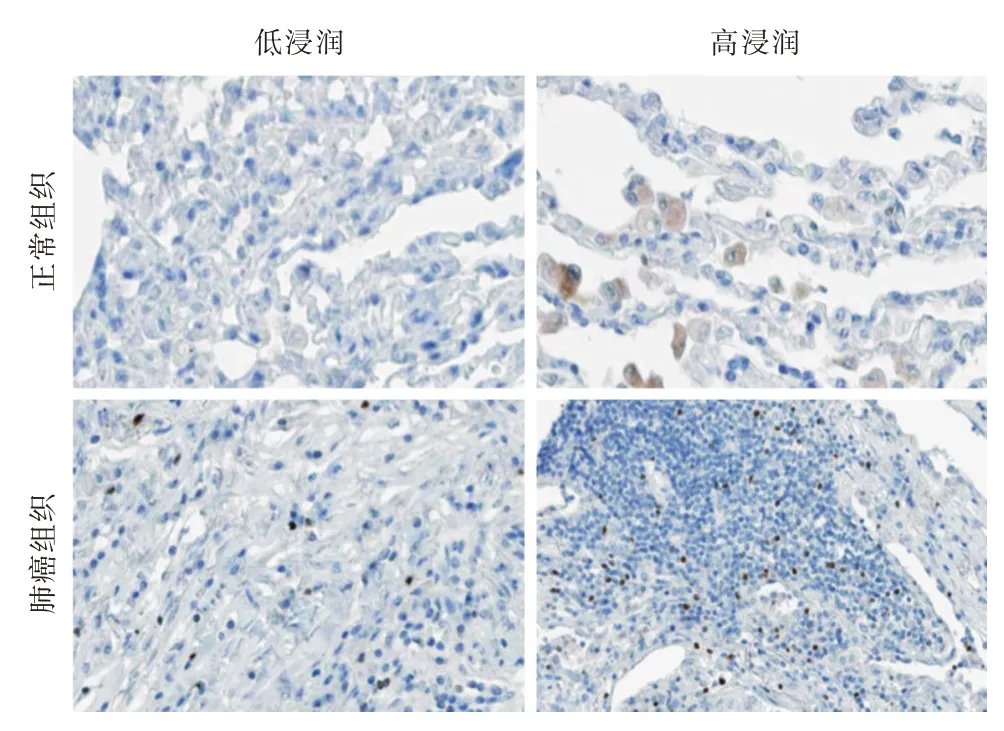
图1 GARP 阳性Treg 在肺癌组织中的浸润情况(×200)Fig.1 Infiltration of GARP-positive Tregs in lung cancer tissues
1.4 临床资料收集 记录所有纳入研究患者的年龄、性别、吸烟史、病理组织分型、淋巴结转移、远处转移情况、临床TNM 分期。比较GRAP 阳性Treg 细胞浸润高浸润和低浸润的患者其临床特征的关系,对比两组患者的随访预后结果。
1.5 统计学方法 采用SPSS 24.0 软件进行统计,计量资料采用表示,比较采用t检验,计数资料采用百分比表示,比较采用χ2检验。使用Kaplan-Meier 生存曲线对比肺癌患者GARP 阳性Treg 浸润高浸润和低浸润组患者的生存情况,并使用Logrank 检验对比两组生存差异,以P<0.05 为差异具有统计学意义。
2 结果
2.1 癌组织和癌旁组织的GARP 阳性Treg 浸润密度对比 其中93 例肺癌患者中,癌组织的平均GARP 阳性Treg 浸润密度为(25.3 ± 8.6)个/视野,癌旁正常肺组织的GARP 阳性Treg 浸润密度为(7.2±4.6)个/视野,其中肺癌组织中的GARP 阳性Treg 浸润密度显著高于癌旁正常组织,差异具有统计学意义(P<0.001)。
2.2 GARP 阳性Treg 在肺癌中的浸润水平与临床特征的关系 其中肺癌组织中GARP 阳性Treg高浸润水平与患者TNM 分期、淋巴结侵袭和远处转移密切相关,其中TNM 分期为Ⅲ-Ⅳ期、淋巴结存在侵袭、出现远处转移的肺癌组织其高浸润GARP 阳性Treg 的患者比例显著增高(P<0.05),而GARP 阳性Treg 的浸润密度在患者的性别、年龄、是否吸烟、组织类型上差异没有统计学意义(P>0.05)。见表1。
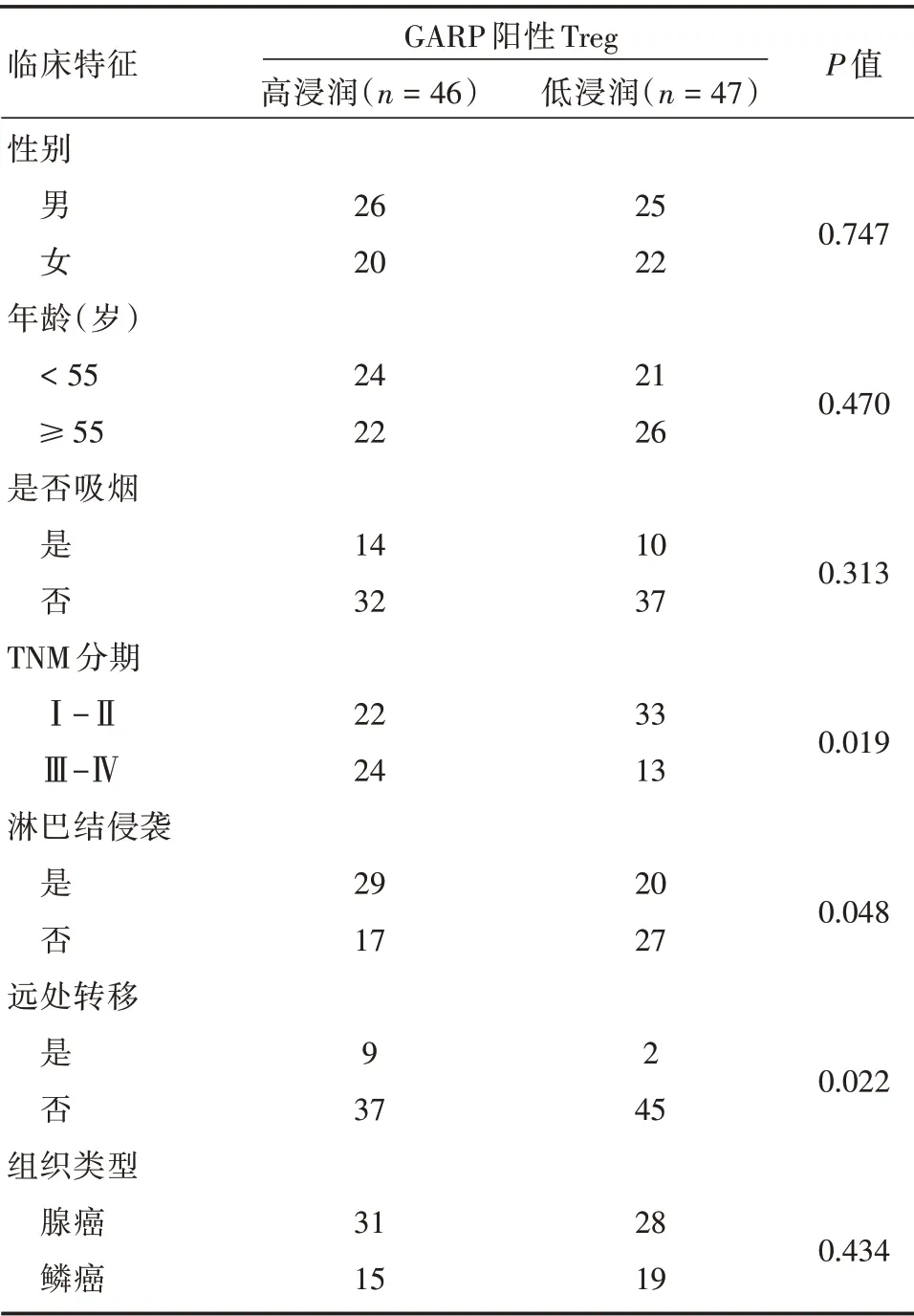
表1 GARP 阳性Treg 在肺癌中的浸润水平与临床特征的关系Tab.1 Relationship between GARP-positive Treg infiltration and clinical features in lung cancer例
2.3 肺癌组织中GARP 阳性Treg 浸润密度对肺癌临床预后的影响 93 例肺癌患者随访时间为8~46 个月,中位随访时间为32 个月,GARP 阳性Treg 高浸润的患者其总体生存率为65.2%(30/46),而GARP 阳性Treg 低浸润的患者其总体生存率为87.2%(41/47),其中GARP 阳性Treg 高浸润的肺癌患者其总体生存率显著低于低浸润的患者,差异具有统计学意义(HR=2.521,95CI%:1.087 ~5.850,P=0.031)。见图2。
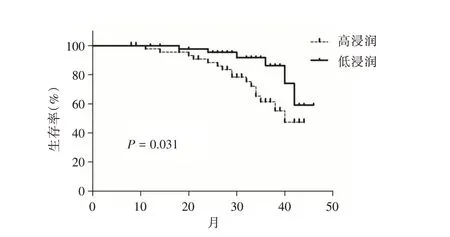
图2 GARP 阳性Treg 在肺癌组织的浸润程度对肺癌患者总体生存率的影响Fig.2 Effect of GARP-positive Treg on the degree of invasion of lung cancer tissue on overall survival of lung cancer patients
2.4 肺癌患者预后的多因素Logistic回归分析 将纳入的因素采用Logistic 回归模型进行分析,变量与赋值如下:TNM 分期(Ⅰ~Ⅱ=0,Ⅲ~Ⅳ=1);淋巴结侵袭(否=0,是=1);远处转移(否=0,是=1);GARP 阳性Treg(低浸润=0,高浸润=1);结局(存活=0,死亡=1)。发现肺癌患者远处转移(OR=6.55,P=0.011)与GARP 阳性Treg 高浸润(OR=4.29,P=0.036)是患者预后不良的风险因素。
3 讨论
Tregs 作为主要免疫抑制细胞,在肿瘤的病情进展和转移中发挥重要的作用。研究[10]表明,如细胞毒性T 淋巴细胞相关抗原4(cytotoxic T lymphocyte-associated antigen 4,CTLA-4)、肿瘤坏死因子受体2(tumor necrosis factor receptor 2,TNFR-2)、淋巴细胞活化基因3(lymphocyte activation gene 3)、T 细胞膜蛋白3(T cell membrane protein 3)和GARP分子均有助于增强Tregs 的免疫抑制,但对于Tregs具体调节其免疫抑制功能的确切机制尚不清楚,这些分子在调节Tregs 作用中的确切作用也未明确。GARP 也称为富含亮氨酸重复序列32,研究[11]表明GARP 可以在活化的CD4+Foxp3+Tregs 和巨核细胞/血小板的表面上结合TGF-β/LAP。GARP且能诱导Foxp3 表达,使Tregs 抑制效应细胞活化[12]。既往研究[13]表明,GARP 表达阳性的Tregs具有很高的免疫抑制作用,而GARP 可以促进转化生长因子β信号通路是该表型的集中Tregs 发挥抑制功能的主要方式。目前对于GARP 主要在乳腺癌、结肠癌和黑色素瘤中进行了初步的研究[14],但对于GARP 阳性的Treg 浸润与肺癌的临床特征的关系仍未完全明确,因此,本研究拟探讨GARP 阳性的Treg细胞的浸润水平与临床特征的关系。
本研究首先比较了肺癌组织和癌旁组织中GARP 阳性Tregs 的浸润程度,结果显示了癌组织中的GARP 阳性Tregs 浸润密度显著高于正常的肺组织。既往研究报道肺癌患者中血液的Tregs 细胞比例比健康的人群显著增高[15],进一步揭示了来自肿瘤组织中能募集GARP 阳性的Tregs 从而发挥免疫抑制的效果。本研究进一步分析GARP 阳性Tregs 浸润密度与肺癌患者临床特征的关系,结果发现GARP 阳性Treg 高浸润水平与患者TNM分期、淋巴结侵袭和远处转移密切相关。这表明GARP 阳性Treg 在肿瘤中浸润时能发挥促进肿瘤侵袭和转移的作用。目前对于癌组织中的GARP表达和功能仍未完全明确,在免疫抑制的肿瘤微环境中可能是促进肿瘤免疫逃逸和治疗失败的重要因素,其中抑制性免疫细胞如Tregs 和抑制性因子如TGF-β 等在癌症发展和进展中起重要作用。体外研究[16]表明,从通过诱导Tregs 的GARP表达可以促进黑素瘤组织中M2 型肿瘤相关巨噬细胞的转化并抑制效应T 细胞的功能。用T 细胞抗原受体刺激T 辅助细胞中强制表达GARP,可诱导细胞进入功能抑制性Foxp3 + Tregs,敲除Foxp3+ Tregs 上的GARP 表达会降低Treg 的免疫抑制活性[17]。因此,GARP 可能是调控Treg 细胞的重要因子,其表达水平与Treg 的抑制功能密切相关。
本研究的病理结果也显示肺癌组织中GARP能作为Tregs 表面特异性表达的分子标记物,笔者进一步对比分析了GARP 阳性Treg 高浸润和低浸润肺癌患者的预后情况,结果显示肺癌组织GARP阳性Treg 高浸润的患者显著预后不良。排除其它因素的影响后,多因素Logistic 回归分析的结果也显示了肺癌组织GARP 阳性Tregs 高浸润是肺癌患者预后不良的独立风险因素,表明GARP 阳性Tregs 有机会成为反映肺癌患者预后的重要生物分子标记物。因此,在Tregs 上发现GARP 作为标记物能为阐明Tregs 的功能和机制具有重要作用,但具体其在肺癌中的调控机制仍需要进一步深入研究。
由于本研究纳入的患者比较少,仍需要进一步加大样本量进行评估。综上,肺癌患者中的肺癌组织GARP 阳性Treg 浸润显著增高,GARP 阳性Treg 高浸润水平与患者TNM 高分期、淋巴结侵袭、发生远处转移以及患者的不良预后密切相关。
