LINC00158通过促进脾酪氨酸激酶基因的表达抑制膀胱癌细胞增殖和迁移
2019-06-21程树林李雨根陈双全黄静朱平宇龚志勇
程树林 李雨根 陈双全 黄静 朱平宇 龚志勇
川北医学院附属医院泌尿外科(四川南充637000)
膀胱癌是泌尿生殖系统最常见的恶性肿瘤之 一,发病率呈逐年上升态势[1]。近年来,针对膀胱癌发生发展的机制研究不断为临床治疗提供新的思路。长链非编码RNA(lncRNA)是一类长度超过200 个核苷酸的转录本,随着lncRNA 研究领域的不断深入,越来越多的lncRNAs 被发现在肿瘤中异常表达,lncRNA 可能成为一种新型的基因治疗工具或肿瘤诊断预后标志物[2-3]。LINC00158 是一种新发现的lncRNA,其在肿瘤尤其是膀胱癌中的作用机制研究未见报道。本研究旨在检测LINC00158 在膀胱癌组织和细胞中的表达,并通过构建转染LINC00158至膀胱癌细胞,观察LINC00158对膀胱癌细胞增殖和迁移的影响,探究LINC00158可能的作用机制。
1 材料与方法
1.1 材料 14 例膀胱癌组织标本来源于2016年11月至2018年2月川北医学院附属医院泌尿外科手术切除标本,置于液氮中保存,标本均经病理学确诊。患者均签署本院伦理委员会批准的知情同意书。14 例膀胱癌患者术前均未接受过放化疗。RPMI-1640 培养基、胎牛血清(FBS)和DMEM 培养基购自美国Gibco 公司。膀胱癌细胞株(T24、BIU-87、UMUC-3、J82)和正常膀胱上皮细胞(SV-HUC-1)购自武汉典型培养物保藏中心,T24、BIU-87 和J82 细胞使用含10% FBS 的RPMI-1640 培 养 基 培 养,UMUC-3 和SV-HUC-1 使 用 含10% FBS 的DMEM 培养基,培养条件为37 ℃、5%CO2。逆转录试剂盒和荧光实时定量聚合酶链反应(qPCR)试剂盒购自美国Fermentas 公司;含有LINC00158 全长的质粒和对照质粒购自上海捷瑞生物科技有限公司。转染试剂LipofectamineTM2000 Reagent 购自美国Invitrogen 公司;Cell Counting Kit-8(CCK-8)试剂盒购自福州迈新生物技术开发有限公司;一抗β-微管蛋白(β-Tubulin)、脾酪氨酸激酶(spleen associated tyrosine kinase,SYK)、细胞周期蛋白A2(CyclinA2)、细胞周期蛋白依赖性激酶2(CDK2)、β-连环蛋白(β-catenin)和神经型钙黏蛋白(N-cadherin)购自美国BD 公司;辣根过氧化物酶偶联的羊抗兔二抗购自武汉博士德生物工程有限公司。
1.2 检测方法
1.2.1 细胞转染 在转染前1 天,将生长状态良好的T24 细胞接种于6 孔板。将T24 细胞分为对照组(转染对照质粒)和实验组(转染含有LINC00158全长的质粒),根据LipofectamineTM2000 Reagent 说明书准备脂质体和质粒的稀释液,混匀静置15 min后加入6 孔板。转染8 h 后更换为含10%FBS 的RPMI-1640 培养基。
1.2.2 qPCR 检测LINC00158 和SYK mRNA 的表达 采用Trizol 法提取组织或细胞总RNA,逆转录为cDNA。以GAPDH 为内参,依据qPCR 试剂盒操作说明,分别检测LINC00158 和SYK mRNA 的表达。采用特异性引物序列如下:GAPDH:上游:CTGGGCTACACTGAGCACC,下游:AAGTGGTCGTTGAGGGCAATG;LINC00158:上游:CCACGATAAAAGGGAACCCTGA,下游:GCGACGACCGCTTTCTTAAA;SYK:上游:CATGGAAAAATCTCTCGGGAAGA,下游:GTCGATGCGATAGTGCAGCA。
1.2.3 Western Blot 检测蛋白表达 细胞裂解液裂解提取细胞总蛋白,调整蛋白浓度,取50 μg 总蛋白上样后进行SDS-PAGE 电泳,转印至硝酸纤维素膜,5%脱脂牛奶封闭1 h,相应一抗4℃孵育过夜,洗膜后相应二抗孵育2 h,洗膜后化学发光法曝光显影。
1.2.4 CCK-8 法检测细胞增殖 取对数生长期的两组细胞以每孔2 × 103个接种于96 孔板,每组设置4 个复孔,每组5 个96 孔板,分别记录1、2、3、4、5 d 细胞吸光度。在每个时间点,吸出培养基后加入配置好的CCK-8 溶液,培养箱内孵育4 h,取出后酶标仪检测在490 nm 处96 孔板每孔的吸光度(OD)值。以时间为横坐标,以吸光度为纵坐标,绘制细胞生长曲线。
1.2.5 细胞划痕实验 将两组细胞消化接种到新的6 孔板,次日细胞长满后,采用10 μL 移液器枪头在6 孔板底部进行划痕,采用磷酸盐缓冲液(PBS)冲洗3 次,去除脱落细胞,培养箱内培养24 h后,采用倒置显微镜观察划痕愈合情况并拍照。划痕愈合率=(0 h 划痕宽度-24 h 划痕宽度)/0 h 划痕宽度×100%。
1.3 统计学方法 以上实验所获得的数据均采用SPSS 17.0 软件进行统计分析。计量数据以均数±标准差表示,实验至少重复4 次,组间采用独立样本t检验比较差异。P<0.05 为差异有统计学意义。
2 结果
2.1 膀胱癌组织和癌旁组织中LINC00158 的表达 见图1。LINC00158 在膀胱癌组织和癌旁组织中的相对表达分别为(0.90 ± 0.07)和(4.20 ±0.29),LINC00158 在膀胱癌组织中的相对表达低于癌旁组织,差异有统计学意义(P<0.01)。
2.2 膀胱癌细胞株中LINC00158的表达 见图2。 LINC00158在膀胱癌细胞株(T24、BIU-87、UMUC-3、J82)和正常膀胱上皮细胞(SV-HUC-1)中的相对表达分别为(0.23±0.03)、(0.75±0.04)、(0.36±0.03)、(0.61 ± 0.03)和(1.01 ± 0.08),LINC00158 在膀胱癌细胞株中的相对表达低于正常膀胱上皮细胞,差异有统计学意义(P<0.01),在T24 细胞中的相对表达最低(P<0.01)。
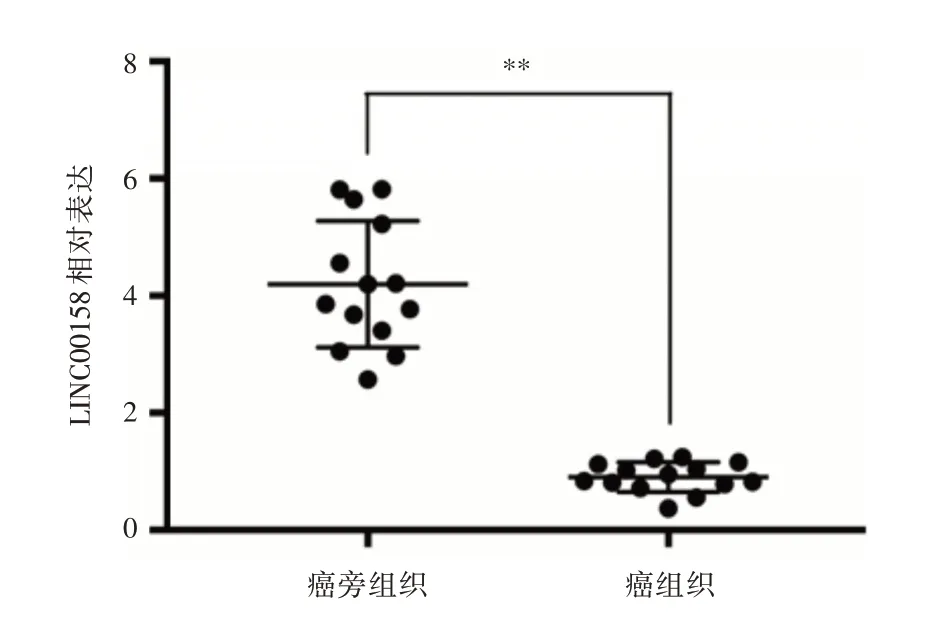
图1 qPCR检测LINC00158在膀胱癌组织和癌旁组织中的表达Fig.1 qPCR was used to detect the expression of LINC00158 in bladder cancer tissues and adjacent tissues
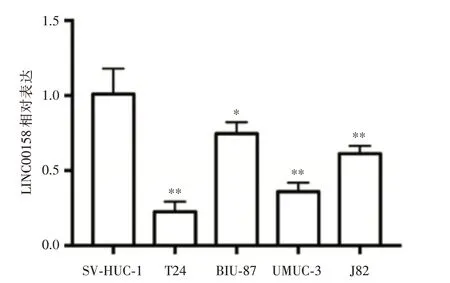
图2 qPCR 检测LINC00158 在膀胱细胞株中的表达Fig.2 qPCR was used to detect the expression of LINC00158 in bladder cell lines
2.3 两组T24 细胞中LINC00158 和SYK mRNA的表达 见图3。对照组和实验组T24 细胞中LINC00158 的相对表达分别为(1.05 ± 0.18)和(5.71± 0.49),两组比较有统计学意义(P<0.01),实验组中LINC00158 的相对表达明显增加。对照组和实验组T24 细胞中SYK mRNA 的相对表达分别为(1.02 ± 0.12)和(3.21 ± 0.28),两组比较差异有统计学意义(P<0.01),实验组中SYK mRNA 的相对表达明显增加。
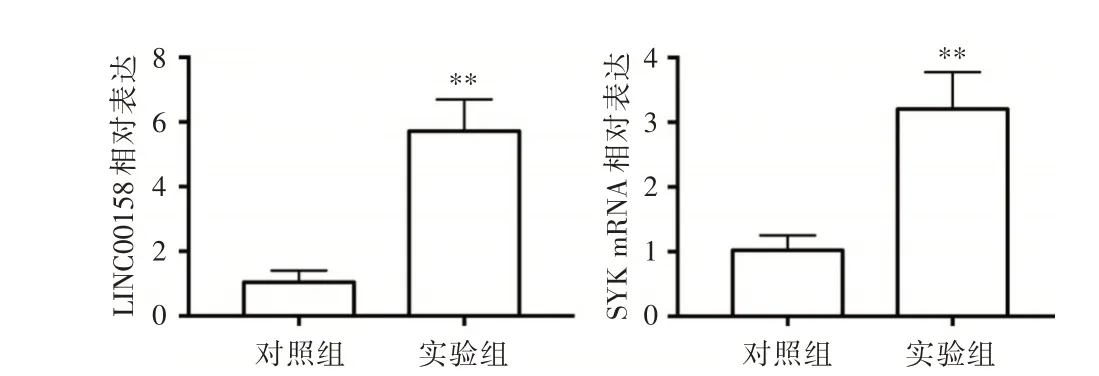
图3 qPCR 检测LINC00158 和SYK mRNA 在两组膀胱细胞株T24 中的表达。Fig.3 qPCR was used to detect the expression of LINC00158 and SYK mRNA in two groups of bladder cell lines T24
2.4 SYK 和细胞增殖迁移相关蛋白表达变化 见图4。膀胱癌细胞转染LINC00158 后,SYK 蛋白表达明显升高,与细胞增殖密切相关的蛋白CyclinA2和CDK2 表达明显降低,上皮表型β-catenin 表达显著升高,间质表型N-cadherin 表达明显降低。
2.5 LINC00158 对膀胱癌T24 细胞增殖的影响见图5。CCK-8 法检测两组T24 细胞的增殖能力,酶标仪检测并绘制生长曲线。结果显示与对照组相比,实验组T24 细胞由第3 天开始,细胞生长速度明显减慢,提示LINC00158 可以抑制T24 细胞的增殖能力,差异有统计学意义(P<0.05)。
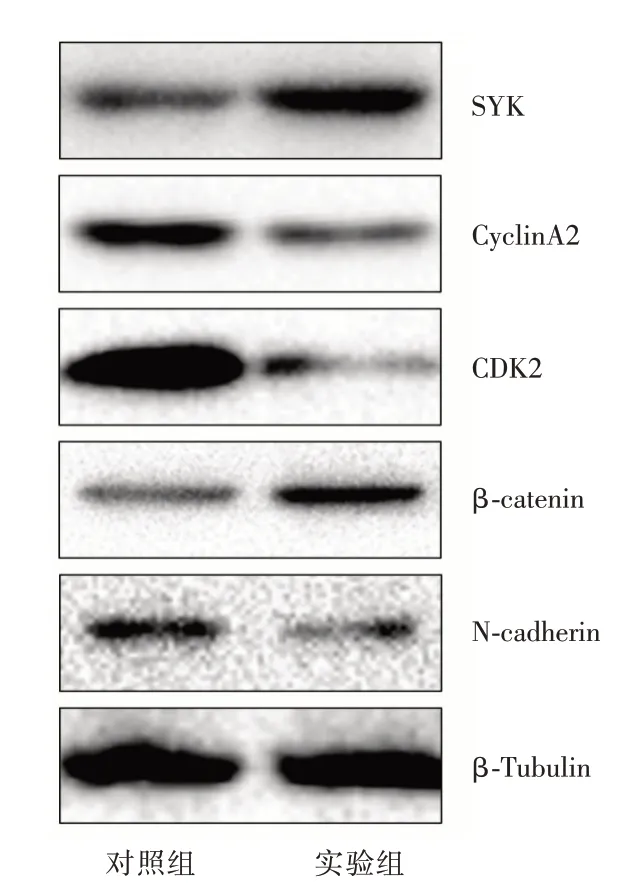
图4 Western Blot 检测两组细胞中SYK 蛋白的表达Fig.4 Western Blot was used to detect the expression of SYK protein in the two groups of cells
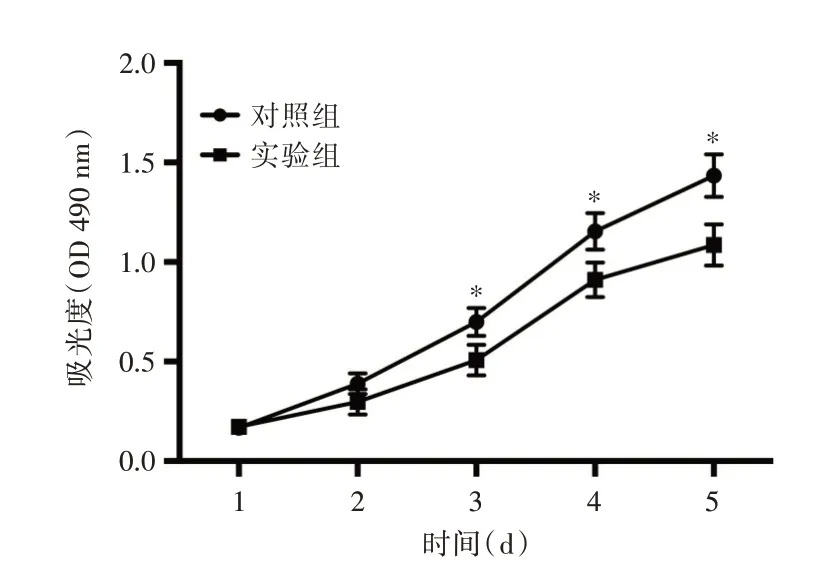
图5 CCK-8 法检测两组T24 细胞的增殖能力。Fig.5 The proliferation ability of the two groups of T24 cells was detected by CCK-8 method
2.6 LINC00158 对膀胱癌T24 细胞迁移能力的影响 见图6。划痕实验检测两组T24 细胞的迁移能力,对照组和实验组T24 细胞在24 h 的划痕愈合率分别为(69.82±5.42)%和(40.23±5.73)%,实验组T24 细胞迁移速度明显低于对照组(P<0.05)。提示LINC00158 可抑制T24 细胞的迁移能力。
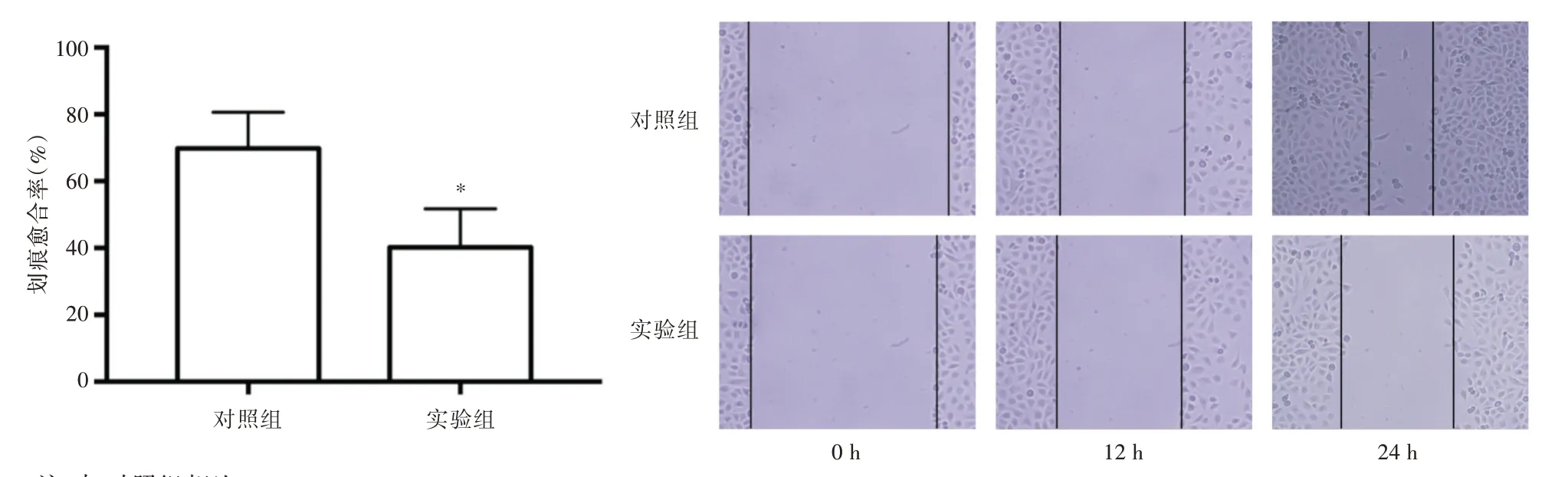
图6 划痕实验检测两组T24 细胞的迁移能力(100×)Fig.6 Scratch test was used to detect the migration ability of two groups of T24 cells
3 讨论
LncRNA 是近年来非编码RNA 研究领域的热点,自发现起就引起了极大的关注,由于lncRNA 缺乏有效的开放阅读框或者包含多个终止密码子,lncRNA并不能编码蛋白[4]。lncRNA主要通过转录及转录后水平调控基因的表达,影响细胞的增殖、分化、凋亡、衰老、转移等各种生理活动[5]。随着lncRNA 研究领域的不断拓展,lncRNA 在肿瘤特别是膀胱癌中的作用引起研究者广泛的关注,lncRNA对肿瘤细胞的生命活动具有显著的调节作用[6]。目前,多条lncRNAs被发现与膀胱癌的发生发展相关,包括CASC2、UCA1、GAS5、LOC572558等[7-10]。
本研究通过检测膀胱癌组织和细胞中LINC00158 的相对表达,发现LINC00158 在膀胱癌组织和细胞中表达明显降低,提示LINC00158 可能成为一种新型的膀胱癌诊断标志物。通过瞬时转染技术,在膀胱癌细胞系T24 中转入含有LINC00158 全长的质粒,并检测LINC00158 在转染后的相对表达,表明转染可明显提高LINC00158的表达。脾酪氨酸激酶(spleen associated tyrosine kinase,SYK)是一种非受体型的酪氨酸激酶,在信号转录过程发挥重要调控作用[11]。SYK 具有抑癌基因的作用,在很多恶性肿瘤中表达降低,与肿瘤的发生发展相关,SYK 高表达可显著抑制肿瘤细胞的增殖和转移,SYK 为寻找肿瘤新的诊断标志物和分子治疗靶点提供了重要方向[12-13]。本研究结果显示,高表达LINC00158 后,T24 细胞中SYK蛋白表达显著升高,与细胞增殖密切相关的蛋白CyclinA2 和CDK2 表达明显降低,表明LINC00158可能抑制了T24 细胞的增殖能力。膀胱癌迁移最重要的调控机制之一是上皮间质转化(EMT),是指在特殊情况下,上皮细胞向间质细胞转化,主要特征为间质表型如N-cadherin 的获得和上皮表型如β-catenin 的丧失[14-18]。高表达LINC00158 后,上皮表型β-catenin 表达显著升高,间质表型N-cadherin 表达明显降低,表明LINC00158 可以抑制T24细胞EMT 的发生,T24 细胞在体外的迁移能力可能降低。本研究进一步通过CCK-8 法和划痕实验检测发现,高表达LINC00158后,T24细胞的增殖能力和迁移能力明显降低,提示LINC00158 可以抑制T24 细胞的体外增殖能力和迁移能力。LINC00158调控SYK蛋白表达的具体机制有待进一步探究。
综上所述,LINC00158 可以明显抑制膀胱癌细胞增殖和迁移能力,LINC00158 可能是通过促进SYK 基因的表达,从而抑制膀胱癌细胞的恶性生物学行为。本研究为LINC00158 作为新型基因工具治疗膀胱癌提供了理论依据。
