多壁碳纳米管/氧化亚铜的制备及其对N-甲酰吗啉的光催化性能
2019-06-21车春波左金龙
车春波,左金龙
(哈尔滨商业大学 食品工程学院,哈尔滨 150076)

基于以上观点,本文采用液相还原法,在阳离子型分散剂十六烷基三甲基溴化铵(CTAB)存在的条件下,以多壁碳纳米管为载体与Cu2O复合制取复合催化剂,并探讨其对N-甲酰吗啉的光催化性能。
1 材料与方法
1.1 主要实验材料
MWCNTs,外径20~40 nm,长度5~20 μm,纯度大于90%,中国科学院成都有机化学有限公司;CTAB,分析纯,上海山浦化工有限公司;水合肼(80%),分析纯,天津博迪化工股份有限公司;CuSO4,分析纯,天津市科密欧化学试剂有限公司;NaOH,分析纯,天津市大陆化学试剂厂;K2Cr2O7,分析纯,天津市福晨化学试剂厂;(NH4)2Fe(SO4)2·6H2O,分析纯,天津市双船化学试剂厂;H2SO4,分析纯,哈尔滨市新达化工厂。
1.2 MWCNTs/Cu2O复合催化剂的制备
将MWCNTs与浓HNO3混合超声30 min后,纯化处理24 h,洗至中性真空抽滤,于80 ℃烘干。在50 mL水中加入纯化处理后的MWCNTs(分别为0、0.065、0.125、0.25、0.5 g),超声15 min后,得到溶液A,同时,另0.3 g分散剂CTAB加50 mL水混合后,于50 ℃磁力搅拌,得到透明溶液B,把A、B两种溶液于恒温搅拌条件下混合,缓慢加入0.1 mol/L的CuSO4溶液100 mL,升温至70 ℃,逐滴滴加2 mol/L的NaOH,使溶液pH值约为9.3,老化10 min后,得到深蓝色溶液,最后滴加2 mol/L的N2H4溶液7.5 mL,此时,溶液呈深红色,反应3 h后,离心得到固体,80 ℃真空干燥12 h,得到复合催化剂产品。
1.3 MWCNTs/Cu2O复合催化剂对NFM的光催化性能测试
取NFM含量为1 100 mg/L的溶液400 mL,调节pH值后,加入一定量催化剂,于暗处搅拌30 min,以达到吸附平衡,再以20 W的白炽灯为可见光光源,照射距离为20 cm,每隔10 min取上清液测其COD,再根据式(1)计算COD的去除率。

(1)
式中:COD光照前为暗搅拌30 min后溶液的COD值;COD光照后为光照一定时间后溶液的COD值。
1.4 分析测试方法
采用Spectrum100型傅立叶变换红外光谱仪(IR)对纯化前后的MWCNTs样品进行有机官能团变化情况分析,采用日本东芝S4700型扫描电子显微镜(SEM)对复合催化剂样品进行形貌观察,采用日本理学D/max-γB型X射线衍射仪(XRD)进行复合催化剂样品物相分析,采用国家标准HJ/T 399―2007进行COD测定。
2 结果与分析
2.1 MWCNTs的纯化效果分析
图1是纯化前后MWCNTs的红外图谱,通过对比两个图谱可以看出,纯化后的MWCNTs在3 432.64 cm-1处出现明显的—OH伸缩振动吸收峰,在1 630.64 cm-1处出现C=O伸缩振动吸收峰,在1 381.17 cm-1处出现了—OH面内弯曲振动吸收峰,在1 082.57 cm-1处出现C—O伸缩振动吸收峰。这些表明,经浓HNO3和超声处理后的MWCNTs表面存在—OH和—COOH官能团,这将提高MWCNTs的亲水性和在水中的分散性能。
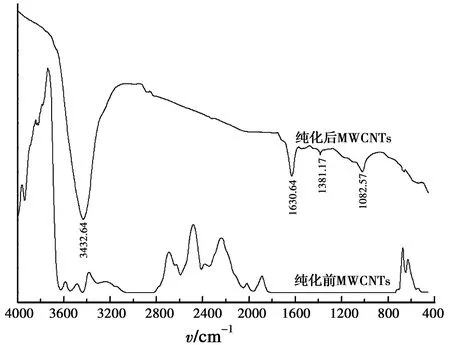
图1 纯化前后MWCNTs的红外光谱图Fig.1 Infra-red spectrogram of MWCNTs before and
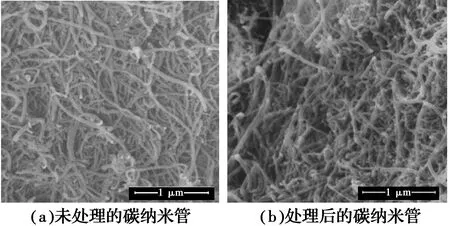
图2 纯化前后MWCNTs的SEM图像Fig.2 SEM graphics of MWCNTs before and after
对比图2(a)、(b),图2(a)的MWCNTs管子较长且管口端封闭,但经过浓HNO3和超声处理后的MWCNTs如图2(b)所示,管子较短且管口被打开,说明HNO3和超声的协同作用使其具有高化学活性的微缺陷结构和端口碳原子处引入了含氧官能团,而这些官能团可以作为负载金属催化剂粒子的吸附位或活性中心。
2.2 MWCNTs/Cu2O复合颗粒的结构分析

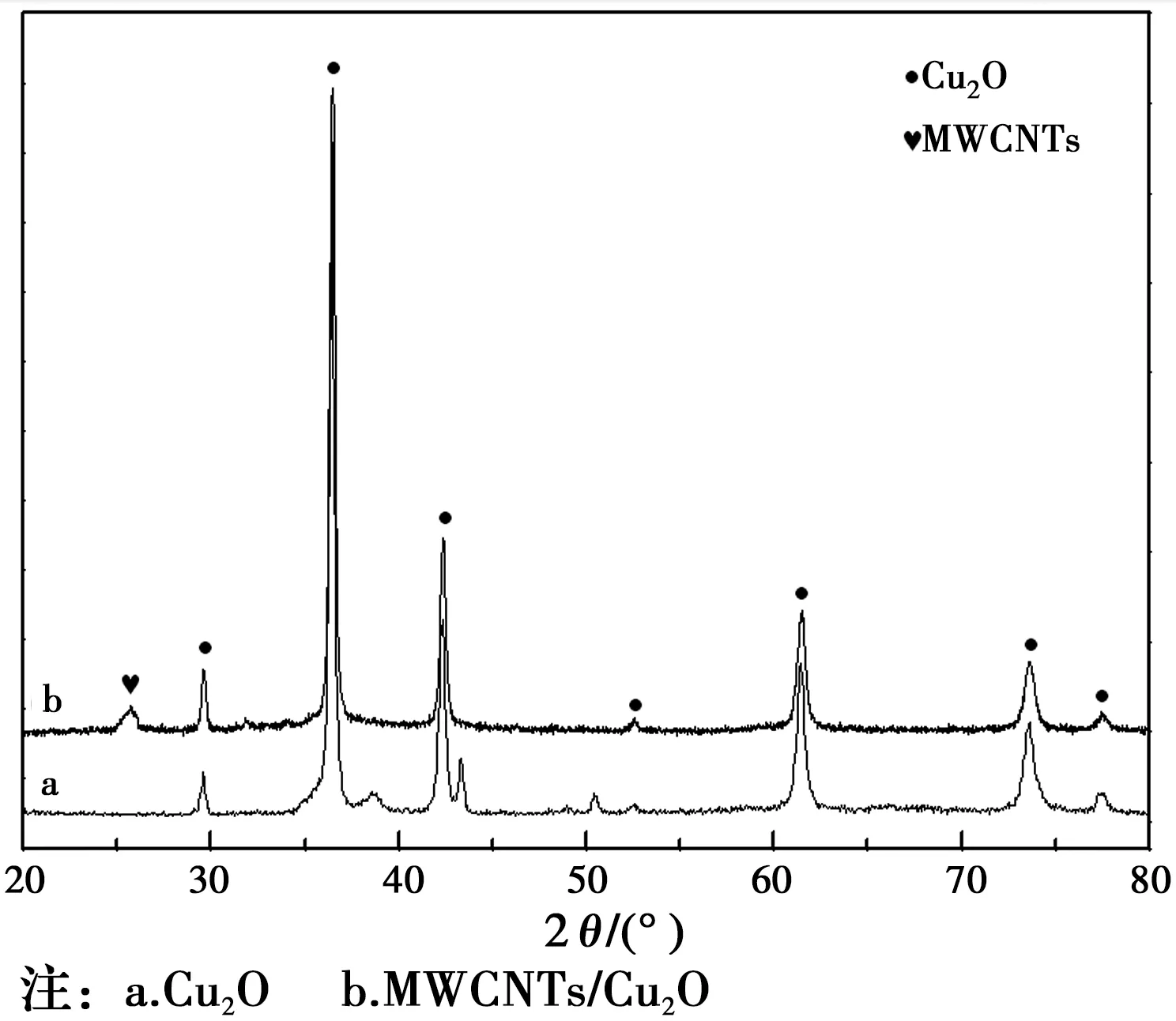
图3 样品的XRD图谱Fig.3 XRD chromatogram of
图3的a、b两条XRD谱图分别在29.55°、36.42°、42.30°、52.45°、61.34°、73.53°及77.32°处出现衍射峰,其对应的晶面指数分别为(110)、(111)、(200)、(211)、(220)、(311)及(222),对比Cu2O标准图谱,表明样品中有立方面心晶型Cu2O。而图3的b在26.61°处出现的衍射峰是碳纳米管的石墨态特征峰,由此可见,实验制得的样品是MWCNTs和Cu2O的复合体。
由图4(a)可见,未添加分散剂CTAB制得的Cu2O,以枝晶状生长,颗粒彼此相互黏附,出现团聚现象,且粒径较大。由图4(b)可见,添加分散剂制得的MWCNTs/Cu2O,颗粒分散良好,无团聚,呈大小均匀的规则球形,粒径介于200~400 nm之间,且颗粒表面被纵横交错的MWCNTs缠绕。
CTAB属于阳离子型分散剂,在碱性(pH值约为9.3)条件下,通过静电作用吸附溶液中的OH-负离子,使Cu(OH)2生成在分散剂表面,利用分散剂的空间位阻作用,阻止了Cu(OH)2相互聚集,从而达到良好的分散效果。与此同时,纯化后的MWCNTs含有—OH和—COOH等官能团,也会与分散剂发生静电吸附,所以,在溶液中存在着Cu(OH)2-CTAB-MWCNTs吸附体,加入N2H4后,使Cu2+被还原为Cu+,并形成Cu2O晶体。

图4 催化剂SEM图像
2.3 催化剂对NFM的催化氧化活性
2.3.1 催化剂添加量对催化氧化NFM的影响 在无光照搅拌条件下吸附30 min后,测得溶液的COD值,以Cu2O为催化剂时,COD值基本保持不变;以MWCNTs为催化剂时,随着催化剂用量的递增,溶液COD值分别为1 062、1 031、1 008、993 mg/L,以MWCNTs/Cu2O为催化剂时,随着催化剂用量的递增,溶液COD值分别为1 076、1 045、1 029、1 017 mg/L,通过对比3种催化剂的吸附实验结果可知,MWCNTs对NFM具有一定的吸附作用。

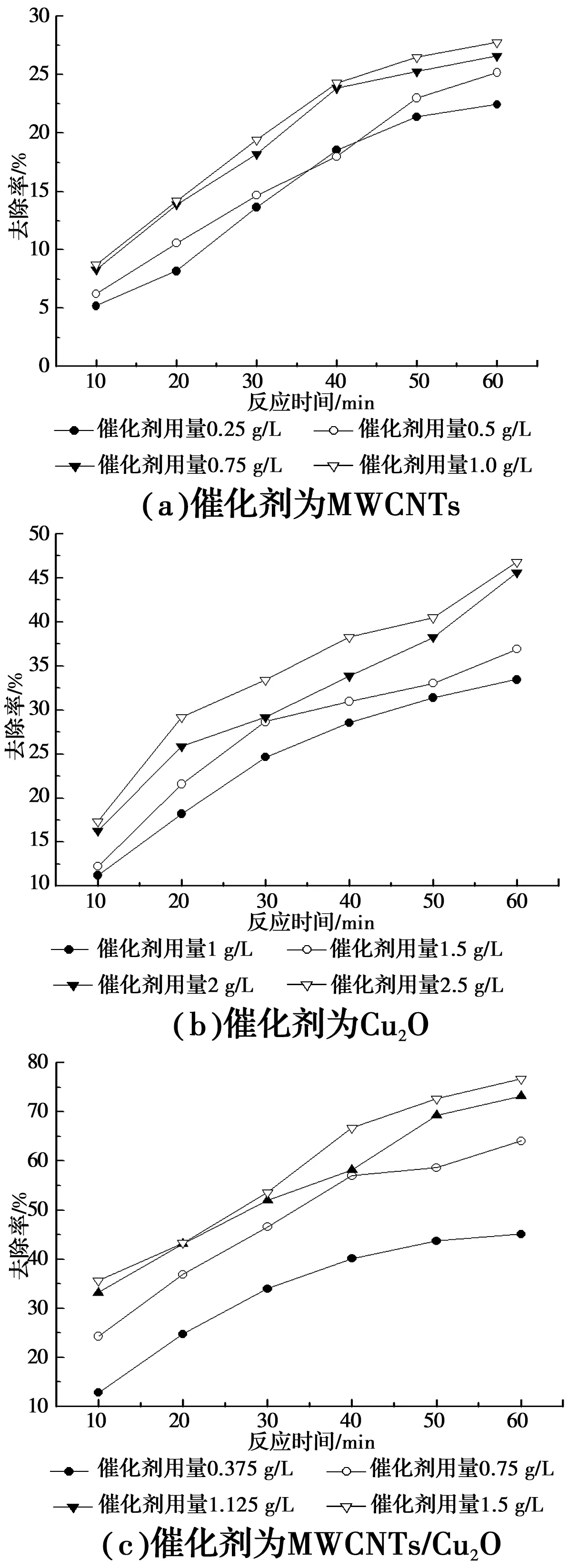
图5 不同的催化剂添加量对NFM催化氧化活性的影响Fig.5 Effect of the different catalyst additions on the catalytic oxidation activity of
2.3.2 溶液初始pH值对催化剂催化氧化NFM的影响 对比图6(a)、(b)可以看出,两种催化剂对水样初始pH值的适应能力表现出了差异。以Cu2O为催化剂时,水样初始pH为9时,催化剂对NFM显示出较好的催化氧化活性,且催化活性受pH值的影响比图6(b)明显;而以MWCNTs/Cu2O为催化剂时,水样初始pH为6时,催化剂的活性最高,而此pH值条件为原始水样的pH值。由此可知,初始pH值为6或9时对NFM的去除率较高,说明溶液中的·OH主要通过光生空穴与水分子作用产生。
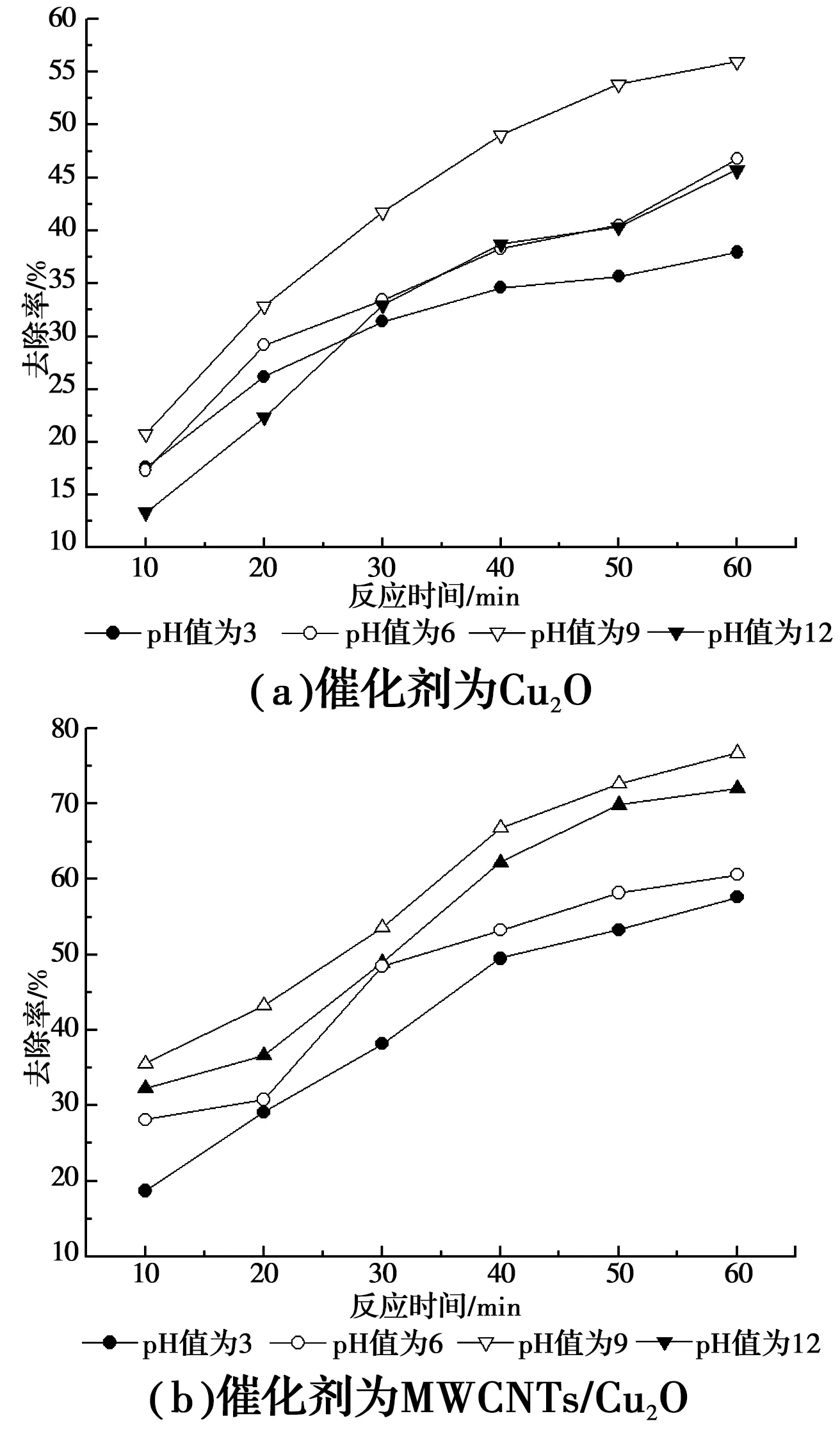
图6 溶液不同的初始pH值对NFM催化氧化活性的影响Fig.6 Effect of the different initial pH value on the catalytic
2.3.3 反应时间对催化剂催化氧化NFM的影响 对比图7中a、b两种催化剂对含有NFM水样的催化氧化结果可知,反应90 min后,去除率分别为57.87%和82.63%,以MWCNTs/Cu2O为催化剂能够更有效地降解有机物NFM,且在前40 min内,去除率增长显著。

图7 不同反应时间对NFM催化氧化活性的影响Fig.7 Effect of the different reaction time on the catalytic oxidation activity of

结合以上分析及相关文献报道[16-17],认为MWCNTs/Cu2O复合催化剂对NFM的光催化降解途径为:

产生光生电子-空穴对

·OH
空穴氧化生成羟基自由基
生成阴离子超氧化自由基
生成羟基自由基
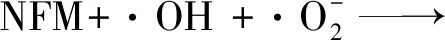
有机物氧化降解
3 结论
1)利用分散剂CTAB的静电吸附和空间位阻作用制备的催化剂粒径均匀,并使MWCNTs以纵横穿插方式与Cu2O形成复合球形颗粒。
2)分别以Cu2O和MWCNTs/Cu2O为催化剂,对有机物NFM进行光催化降解,结果表明,MWCNTs/Cu2O对有机物NFM具有更好的降解效果。
