miR-199a-3p对脂肪变性的肝细胞TG含量及Sp1表达的影响
2019-06-21侯天禄陈天阳
侯天禄,陈天阳,成 扬,3
上海中医药大学附属曙光医院 1.人力资源部; 2.肝硬化科,上海 201203; 3.上海浦东新区传染病医院肝病科
随着人们生活水平的提高,非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)的发病率逐渐升高,发病年龄渐趋低龄化,其可进一步发展为非酒精性脂肪性肝炎、肝纤维化及肝硬化,严重危害人类健康[1-3]。由于NAFLD的发病机制较为复杂,其具体机制仍未明确,但多数学者比较认可“二次打击”学说[4],所以进一步明确发病机制对于NAFLD的预防和治疗非常重要。
微小RNA(microRNA,miRNA)是一类由20~22个核苷酸构成的单链非编码RNA,它们主要是通过结合在靶基因mRNA的3′非翻译区来降解该基因mRNA或阻碍其翻译[5],在细胞凋亡、细胞增殖、肿瘤及脂质代谢等方面发挥了调控作用[6]。相关研究表明,miRNA在NAFLD和1型糖尿病这两种肝脏能量代谢过程中发挥了重要的调控作用,并可能参与了NAFLD的病理、生理学过程[7]。课题组前期的研究发现,高脂饮食诱导NAFLD模型小鼠肝脏miRNA表达谱中miR-199a-3p的下调与肝脏脂肪变性有密切关系[8]。本研究以油酸酯和棕榈酸酯诱导Hepa 1-6细胞,建立肝细胞脂肪变性体外模型,观察miR-199a-3p对肝细胞内甘油三酯(TG)含量及Sp1表达的影响,以探讨肝细胞脂肪变性与miR-199a-3p之间的关系,为NAFLD的防治提供潜在的药物靶点。
1 材料与方法
1.1 细胞与试剂小鼠肝细胞Hepa 1-6和NCTC1469细胞株(中国细胞培养中心,中国上海)、质量浓度为100 g/L的胎牛血清(Gibco BRL,Carlsband,CA,USA)、低葡萄糖DMEM(Invitrogen)、油酸酯和棕榈酸酯(HFFA,Sigma,St Louis,MO,USA)、miR-199a-3p模拟物和抑制剂及阴性对照(NC)[GenePharma(上海)]、DharmaFect1(Dharmacon,Lafayette,CO)、miScript Ⅱ RT试剂盒(QIGEN,上海)、磷酸酶抑制剂(Millipore,USA)、Sp1(1∶4 000,Abcam,ab13370)或β-肌动蛋白(1∶2 000,Abcam,ab8227)、二抗(1∶1 000,上海生物科技,中国,#8214)、ECL法(Millipore)。
1.2 细胞培养及转染Hepa 1-6细胞在质量浓度为100 g/L胎牛血清的常规DMEM中培养。将NCTC1469细胞在低葡萄糖DMEM中培养。所有细胞在37 ℃,体积分数为5%的CO2条件下补充有100 U/ml青霉素和100 μg/ml链霉素的潮湿孵化器中培养。HFFA用于诱导细胞脂肪过载。在质量浓度为10 g/L牛血清白蛋白(BSA)的培养基中制备5 mmol/L油酸盐和5 mmol/L棕榈酸盐的储备溶液。待Hepa 1-6细胞融合达80%时换BSA培养基,加入油酸酯和棕榈酸酯储备液以达到2∶1的最终比例和1 mmol/L的终浓度,继续37 ℃培养箱培养24 h,建立肝细胞脂肪变性体外模型。以油红O染色评估模型建立成功[9]。随后分别用miR-199a-3p模拟物、抑制剂、阴性对照(NC)及pcDNA3.1-Sp1质粒转染细胞48 h,收集细胞样本,进行后续实验。
1.3 定量实时PCR根据制造商的说明书,使用标准TRIzol方法从细胞中提取总RNA。使用SYBR Green Premix Ex Taq在Light Cycler480上20 μl反应体系中进行实时PCR。对于miRNA的检测,使用miScript Ⅱ RT试剂盒逆转录总RNA。通过归一化到内部不变量对照U6或β-肌动蛋白确定miRNA或mRNA的相对表达水平。每次反应一式三份进行。本研究中使用的引物如下:FASN正向:5′-ACAGCGGGGAATGGGTACT-3′,FASN反向:5′-GACTGGTACAACGAGCGGAT-3′;SREBP1正向:5′-ACAGTGACTTCCCTGGCCTAT-3′,SREBP1反向:5′-GCATGGACGGGTACATCTTCAA-3′;反应条件为:95 ℃ 10 min,随后40次循环,每次循环95 ℃变性15 s,60 ℃退火1 min和72 ℃延伸1 min。相对表达水平用2-ΔΔCt法测定。
1.4 Western blotting分析使用补充有蛋白酶的50 mmol/L Tris-HCl(pH 8.0),150 mmol/L NaCl,5 mmol/L MgCl2,2 mmol/L EDTA,1 mmol/L NaF,质量浓度为10 g/L的NP40和1 g/L SDS的放射免疫沉淀(RIPA)缓冲液制备来自指定细胞的蛋白质和磷酸酶抑制剂。蛋白质浓度通过BCA方法定量。将细胞裂解物加载到质量浓度为100 g/L的SDS-PAGE上进行分离,转移到PVDF膜上,用质量浓度为50 g/L的脱脂奶粉封闭,并与Sp1(1∶4 000)或β-肌动蛋白(1∶2 000)在4 ℃下过夜。在TBST洗涤3次后,采用相应二抗(1∶1 000)1 h室温孵育。ECL底物化学发光显色后曝光显影。目标条带使用图像分析软件进行分析,目标蛋白表达量使用GAPDH或β-actin进行校正。
1.5 细胞TG测量通过参照商业化学比色试剂盒说明书测定细胞内TG含量。
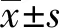
2 结果
2.1 各组细胞中miR-199a-3p表达与NC组相比,转染miR-199a-3p模拟物后,细胞内miR-199a-3p表达显著升高(P<0.05);转染miR-199a-3p抑制剂后,细胞内miR-199a-3p表达显著降低(P<0.01)(见表1)。

表1 miR-199a-3p模拟物及抑制剂对细胞中miR-199a-3p表达水平的影响 Tab 1 Effects of mimics and inhibitors of miR-199a-3p on the expression of miR-199a-3p in cells
注:与NC组相比,*P<0.05,**P<0.01。
2.2 各组Hepa 1-6细胞内TG含量与NC组相比,转染miR-199a-3p模拟物后,细胞内TG含量显著降低(P<0.05);转染miR-199a-3p抑制剂后,细胞内TG含量显著升高(P<0.05);转染miR-199a-3p模拟物和pcDNA3.1-Sp1后,细胞内TG含量升高,但差异无统计学意义(P>0.05)(见表2)。

表2 miR-199a-3p模拟物、抑制剂及模拟物+pcDNA3.1-Sp1对Hepa 1-6细胞中TG含量的影响Tab 2 Effects of miR-199a-3p mimics, inhibitors and mimics+ pcDNA3.1-Sp1 on the expression of TG in Hepa 1-6 cells
注:与NC组相比,*P<0.05。
2.3 各组Hepa 1-6细胞内FASN和SREBP1表达与NC组相比,转染miR-199a-3p模拟物后,细胞内FASN表达显著降低(P<0.01),细胞内SREBP1的表达降低,但差异无统计学意义(P>0.05);转染miR-199a-3p抑制剂后,细胞内FASN和SREBP1表达显著升高(P<0.05);转染miR-199a-3p模拟物和pcDNA3.1-Sp1后,细胞内FASN及SREBP1的表达升高,但差异无统计学意义(P>0.05)(见表3)。

表3 miR-199a-3p模拟物、抑制剂及模拟物+pcDNA3.1-Sp1对Hepa 1-6细胞中FASN和SREBP1表达的影响Tab 3 Effects of miR-199a-3p mimics, inhibitors and mimics+ pcDNA3.1-Sp1 on the expressions of FASN and SREBP1 in Hepa 1-6 cells
注:与NC组相比,*P<0.05,**P<0.01。
2.4 各组细胞中Sp1 mRNA表达Hepa 1-6细胞:与NC组相比,转染miR-199a-3p模拟物后,Hepa 1-6细胞内Sp1 mRNA表达显著降低(P<0.05);NCTC1469细胞:与NC组相比,NCTC1469细胞内Sp1 mRNA表达显著降低(P<0.05)(见表4)。
2.5 各组细胞中Sp1蛋白表达Hepa 1-6细胞:与NC组相比,转染miR-199a-3p模拟物后,Hepa 1-6细胞内Sp1蛋白表达显著降低(P<0.01);转染miR-199a-3p模拟物和pcDNA3.1-Sp1后,Hepa 1-6细胞内Sp1蛋白表达显著升高(P<0.01);与NC组相比,NCTC1469细胞内Sp1蛋白表达显著降低(P<0.01)(见图1)。

表4 miR-199a-3p模拟物对Hepa 1-6和NCTC1469细胞中Sp1 mRNA表达的影响Tab 4 Effects of miR-199a-3p mimics on the expression of Sp1 mRNA in Hepa 1-6 and NCTC1469 cells
注:与NC组相比,*P<0.05。
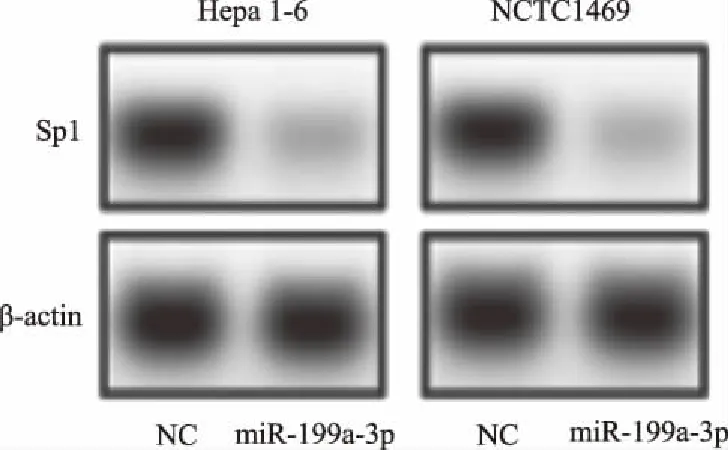

图1 各组细胞Sp1蛋白的表达(Western blotting分析)Fig 1 Expression of Sp1 protein in cells of each group (Western blotting analysis)
3 讨论
NAFLD目前已成为全球慢性肝病的主要原因,肥胖或糖尿病人群的患病率明显高于一般人群,以男性多见,且与胰岛素抵抗、氧化应激密切相关,可增加亚临床动脉粥样硬化和冠状动脉疾病的风险[10-11]。随着人们对NAFLD的关注度增加,与之相关的发病机制逐渐被发现,如固有淋巴细胞(ILC2s)的缺失或异常改变、肠道菌群失调、肝内视黄酸(RA)水平升高、CC细胞因子受体9(CCR9)通路等均可引起NAFLD的发生、发展[12]。尽管以上机制可以部分解释NAFLD的发病机制,但具体机制仍不清楚。近年来研究发现,miRNA在肝脏的分化及其形态和功能的维持中发挥重要作用,也与肝癌、病毒性肝炎、肝纤维化、肝硬化及酒精与NAFLD的发生、发展、治疗及预后密切相关,同时大规模的队列研究探索了miRNA作为生物标志物用于肝脏疾病无创诊断的可行性,可作为组织学损伤的独立预测因子,具有很高的临床价值[12-13]。
Sp1是一种序列特异性的DNA结合蛋白,其广泛存在于所有组织的细胞核中,参与多种生理及病理过程的调控,作为细胞内的重要转录因子,其信号传导通路的活化参与细胞癌变、增殖、凋亡、新生物的分化等多种生物学效应及免疫反应和脂肪及胆固醇生成的大量基因的表达[14-16]。
本研究为了评估miR-199a-3p在脂质代谢中的潜在作用,在HFFA诱导下建立肝细胞脂肪变性体外模型,通过转染miR-199a-3p模拟物、miR-199a-3p抑制剂来检测其对细胞内TG含量、FASN及SREBP1基因表达的影响。结果显示,与NC组相比,miR-199a-3p可显著降低Hepa 1-6细胞内TG含量、FASN、SREBP1基因表达,而miR-199a-3p抑制剂可以显著升高Hepa 1-6细胞内TG含量及FASN、SREBP1基因表达。为了研究Sp1是否是miR-199a-3p的直接靶标,以miR-199a-3p模拟物转染在Hepa 1-6和NCTC1469细胞以检测两种细胞内Sp1 mRNA及Sp1蛋白质的表达。与NC组相比,miR-199a-3p模拟物可显著抑制Sp1 mRNA及Sp1蛋白质的表达。为进一步检测Sp1介导miR-199a-3p在肝脂肪变性中的功能作用,我们在Hepa 1-6细胞模型中恢复了Sp1表达,以pcDNA3.1-Sp1质粒的转染恢复了miR-199a-3p对Sp1蛋白表达、细胞内TG含量和脂肪生成基因表达的抑制作用。上述数据表明,miR-199a-3p介导的Sp1下调涉及肝脂肪生成和脂肪变性。
本实验结果提示,脂质在肝细胞内的降低可能与细胞内miR-199a-3p表达下调有关,miR-199a-3p表达下调来抑制Sp1的表达,降低脂肪变性肝细胞内TG含量,改善肝细胞脂肪变性,但其确切机制有待进一步深入研究。
