胰腺神经内分泌肿瘤的临床特征与预后分析
2019-06-20孙文白张蓬波张冲张易张秀忠任泽强
孙文白,张蓬波,张冲,张易,张秀忠,任泽强
作者单位:徐州医科大学附属医院肿瘤外科,江苏 徐州 221002
胰腺神经内分泌肿瘤(pancreatic neuroendocrine tumors,pNENs)是一种临床上较为罕见的来源于神经内分泌细胞和肽能神经的胰腺肿瘤,约占全身肿瘤的1%~2%,占全身内分泌肿瘤的4%~8%[1-2]。近20年来,随着生活方式的改变,诊断水平的提高,pNENs的发病率显著上升[3]。由于pNENs的临床表现各异且发病率低,从而出现误诊误治,延误病情。国内关于pNENs的流行病学数据尚不全面,笔者回顾性研究55例pNENs病人的临床及病理资料,探讨pNENs的外科诊疗要点及影响预后的相关因素。
1 资料与方法
1.1 一般资料收集徐州医科大学附属医院2011年1月至2017年5月间收治并经病理证实的55例pNENs病人的临床资料。55例病人中,男性19例,女性36例,男女比例为1∶1.9,年龄范围为13~75岁,平均年龄46岁。大于等于40岁的有39(70.91%)例,小于40岁的16(29.09%)例。本研究符合《世界医学协会赫尔辛基宣言》相关要求。所有病人或其近亲属均知情同意。
1.2 研究方法回顾性分析55例pNENs病人的临床症状、影像学检查、肿瘤大小及部位、TNM分期、手术方式及病理免疫组化等方面,分析相关因素与预后的关系。
依据WHO2010年第4版分级标准[4]及ACJJ8版(2017)[5]分期标准,对所有病例进行分级分期。术后通过电话或门诊复诊的方式予以随访,随访时间截至2017年10月。
1.3 统计学方法采用SPSS 21.0进行统计分析,使用Kaplan-Meier法描述生存曲线行生存分析,Log-rank检验行单因素分析,将单因素分析中差异有统计学意义的变量行进一步COX回归多因素分析,变量筛选采用向后逐步(似然比)法,变量纳入标准为0.05,剔除标准为0.1。P<0.05认为差异有统计学意义。
2 结果
2.1 临床表现55例病人中功能性肿瘤26例(47.27%),无功能性肿瘤29例(52.33%)。功能性肿瘤中胰岛素瘤22例(40.00%),均具有Whipple三联征表现,主要表现为大汗心慌(19例),发作性意识障碍、晕厥(17例),精神异常(7例)和四肢抽搐(5例),发作时测血糖均低于2.8 mmol/L,空腹胰岛素与血糖之比>0.3;胃泌素瘤2例,首诊原因均为长期上腹部疼痛,服用质子泵抑制剂难以缓解,胃镜示有不同程度的消化道溃疡。血管活性肠肽瘤2例,长期严重腹泻为就诊原因。无功能性肿瘤19例,多为无特异性的消化道症状,包括腹痛不适(11例),腹胀恶心(7例),黄疸(6例)及腹部肿块(1例),有6例病人通过体检发现,无明显不适。
2.2 影像学检查术前19例行腹部B超检查,8例(42.11%)提示胰腺占位,表现为胰腺内实性或囊实性占位,低回声或不均匀回声像。51例行CT检查,44例(86.27%)提示胰腺占位,表现为胰腺内低回声肿块,动脉期不均匀强化病灶,部分囊实性占位。17例病人行MRI检查(MRCP4例),14例(82.35%)提示胰腺内占位,大部分肿瘤表现为TlW1低信号、T2W1高或略高信号,强化后表现为动脉期明显强化,部分病人轻度强化或不强化。13例病人行超声内镜(EUS),多数病人因肿瘤体积较小,CT/MRI无法明确或定位不清进而行敏感性较高的EUS,11例(84.62%)提示胰腺内占位。对于诊断pNENs,腹部B超与CT、MRI之间差异有统计学意义(P<0.05)。术前经影像学检查明确肿瘤部位,胰头部20例,胰颈部7例,胰体部5例,体尾交界部3例,胰尾部19例,1例病人于胰头与胰尾部各有一肿块。
2.3 手术治疗55例病人均行手术治疗,根治性手术51例,1例病人于胰头与胰尾部各有一肿块,行全胰切除术;2例病人有单灶肝脏转移,行原发肿瘤+肝转移灶根治性切除,见表1。姑息性切除4例,2例病人因术中探查发现有多处肝脏转移,1例病人术中发现腹腔转移,予以切除原发灶解除梗阻压迫等症状;1例病人肿瘤侵犯肠系膜上动脉,并与小肠无法分离,予以活检并行胆肠吻合。

表1 51例pNENs根治性手术方式
2.4 术后病理及免疫组化55例肿瘤直径0.8~8 cm,平均直径3.34 cm;胰腺高分化神经内分泌肿瘤(NET)47例,胰腺神经内分泌癌(NEC)8例,G1、G2、G3级肿瘤分别为38、9、8例;TNM分期IA、IB、ⅡA、ⅡB、Ⅲ、Ⅳ分别为18、24、4、3、1、5例,侵犯血管7例,侵犯神经4例,淋巴结转移6例,肝转移4例,腹腔多处转移1例。免疫组化中CgA阳性率为78.18%(43/55),其中NET阳性率为80.85%(38/47),NEC阳性率为62.50%(5/8),Syn阳性率为92.73%(51/55),其中NET阳性率为93.62%(44/47),NEC阳性率为87.50%(7/8)。
2.5 随访至2017年10月,49(89.10%)例病人获得随访,失访6例,随访时间4~75个月,无瘤生存31例,8例出现肿瘤复发或进展,死亡10例,主要死亡原因均为肿瘤转移扩散,4例于术后一年内死亡,6例分别于术后19、25、28、28、30、41个月后死亡。随访病人术后1、3、5年总生存率分别为92.6%、79.6%、75.6%;。对相关数据进行单因素分析,显示肿瘤分级、肿瘤分期TNM、手术方式、远处转移、淋巴结转移等与预后有关(表2)。不同影响因素作用下的生存曲线见图1~6。多因素分析结果显示,肿瘤TNM分期和手术方式是影响病人预后的独立影响因素(P<0.05)(表3)。

表2 55例pNENs病人临床病理因素单因素分析
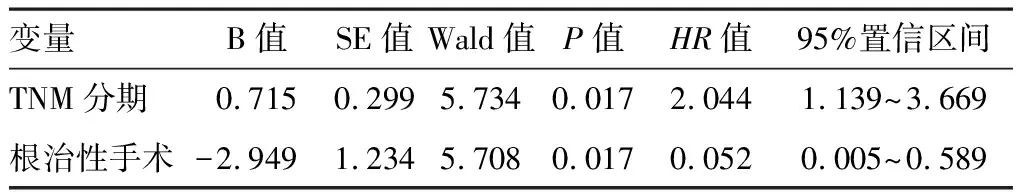
表3 pNENs 49例病人临床病理因素分析

图1 pNENs 49例根治或姑息切除的相关生存曲线

图2 pNENs 49例TNM分期的相关生存曲线

图3 pNENs 49例肿瘤分级的相关生存曲线
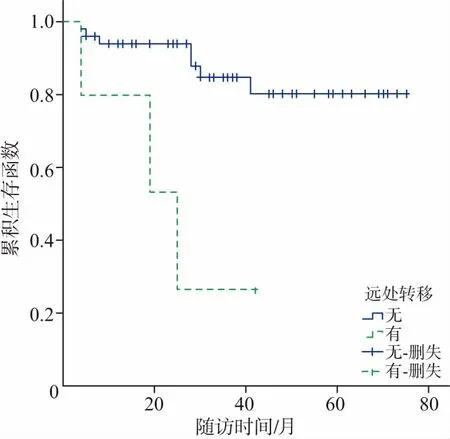
图4 pNENs 49例远处转移的相关生存曲线

图5 pNENs 49例淋巴结转移的相关生存曲线
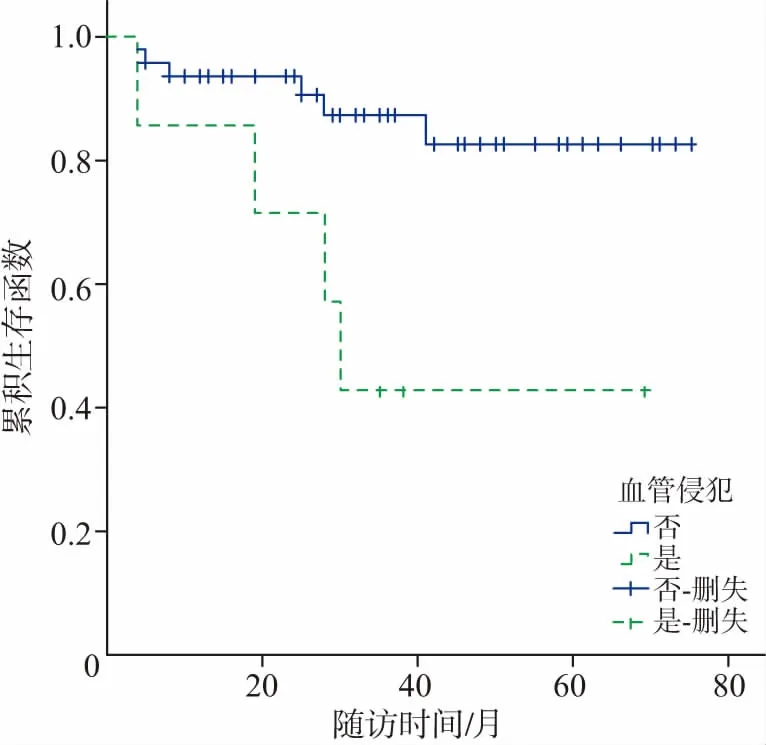
图6 pNENs 49例血管侵犯的相关生存曲线
3 讨论
pNENs的发病率逐年上升,约为每年0.32/10万,约占胃肠胰神经内分泌肿瘤的30%[6]。
pNENs根据肿瘤是否具有内分泌功能,分类为F-pNENs和NF-pNENs,F-pNENs又主要包括胰岛素瘤、胃泌素瘤、胰高血糖素瘤、血管活性肠肽瘤等。其中胰岛素瘤最为常见,由于胰岛素不受血糖调节而过量分泌,导致病人出现Whipple三联征表现;本研究中22例病人最终经病理证实为胰岛素瘤,均有不同程度的Whipple三联征表现,部分病人因神经精神症状明显,首诊时被误诊,故应注意到低血糖发作间隙病人可完全正常,怀疑低血糖时应反复检测血糖并考虑到胰岛素瘤可能性。胃泌素瘤主要表现为胃酸分泌过多所产生的卓艾综合征,引起消化性溃疡、食管返流同时可伴腹泻,后期可因反复的消化道溃疡出现穿孔或狭窄,随着质子泵抑制剂类药物的广泛使用,多数病人症状易被掩盖;本研究中两例病人均有消化道溃疡,服用质子泵抑制剂仍难缓解,进一步查血清胃泌素发现明显升高,予以考虑胃泌素瘤。血管活性肠肽瘤发生率为1/100万/年,典型症状为水样腹泻和低钾,本文中2例病人腹泻脱水症状典型。无功能性肿瘤占pNENs的45%~60%,在部分文献中可达90%[7],因肿瘤多为惰性且生长较为缓慢,导致较晚期才出现如肿瘤占位压迫或转移而导致的腹痛腹胀、梗阻性黄疸和门静脉高压等症状,距肿瘤发生已有平均约5~7年时间,多数NF-pNENs在诊断时已处在进展期,三成以下病人可接受根治性治疗[8-9],可考虑与病人病情隐匿、症状不典型从而导致延误治疗有关。随着影像学检查技术的发展,偶然发现的NF-pNENs正逐渐增多,本研究中有6例病人通过体检发现胰腺占位。
腹部B超、CT、MRI和EUS为诊断pNENs主要影像学手段。其中B超常用于筛查;CT和增强CT为pNENs的首选检查,灵敏度较高,MRI对肝转移灶较CT准确率高,CT与MRI联合诊断敏感性可达75%以上[10],同时均能反应肿瘤的位置特点,术前预测分期,对手术治疗有指导性意义[11]。本研究中CT检查阳性率为86.27%,MRI检查阳性率为82.35%,准确率均较高,与B超(42.11%)比较差异有统计学意义(P<0.05)。EUS检出率可达90%,在明确直径较肿瘤(<1 cm)及局部淋巴结转移时具有独特诊断优势,同时可在EUS引导下行穿刺活检术[12-13];本研究中3例直径较小病灶未能在CT/MRI下发现,而通过EUS明确。生长抑素受体显像特异性及敏感性均较高,且对肝转移灶灵敏度最高,PET-CT对恶性程度高、代谢旺盛的肿瘤有较好诊断效果。
手术是治疗pNENs的主要方式,根治性手术应完整切除原发灶及可能存在的局部转移淋巴结或远处转移,是病人得到治愈的唯一手段[14]。手术方式根据病灶所处部位、大小、浸润程度、是否存在淋巴或远处转移等所决定。即使病人已明确有发生转移,也应行手术尽量切除病灶,以减轻肿瘤负荷,控制相关症状并提高生存质量。本研究中所有病人均行手术治疗,多因素分析显示手术方式是影响病人预后的独立影响因素,接受根治性手术的病人预后显著好于姑息性切除的病人。对于胰岛素瘤或小于2 cm的无功能性肿瘤,并与主胰管分界清晰时,可行腹腔镜下局部剜除术,可减少对胰腺功能的损伤,利于术后的快速康复;有7例病人术前明确定位后,行腹腔镜下肿瘤剜除术均获得较好效果。肝转移是pNENs最常见的转移部位,早期除肝转移外无其他转移的肿瘤行减瘤术可能延长病人的生存率[15]。本研究中2例病人存在单灶肝转移,行根治性切除后与姑息切除病人相比,术后平均生存期显著延长(33.5比13.5个月)。本研究中单因素分析显示淋巴结转移影响病人预后,这与Hashim等[14]研究结果相符,但其病人五年生存率较本研究高;术中建议对除<2 cm的胰岛素瘤外,其他肿瘤应行周围淋巴结清扫。无法手术根治性切除的局部晚期及转移性 pNENs可行生长抑素类似物治疗以延长生存期,包括奥曲肽、兰瑞肽和帕瑞肽,DCR可达50%~60%[16]。根治性手术治疗后病理报告为G3级病人,可按照导管腺癌的治疗原则给予全身辅助治疗和(或)局部治疗[17]。
2010年《消化系统肿瘤WHO分类》对根据核分裂像数和(或)Ki-67标记率对pNENs进行分级。本研究中以G1级肿瘤为主,共38例(69.1%),可能与G1级肿瘤发展缓慢,侵袭程度低有关,G3级为8例(14.55%);G1、G2、G3级肿瘤术后五年生存率为92.8%、47.6%、33.3%,单因分析差异有统计学意义(P<0.05)。AJCC(2017)根据肿瘤大小、侵犯范围和有无转移等进行分期,本研究中以Ⅰ期(76.36%)最多见,Ⅰ、Ⅱ、Ⅲ、Ⅳ期的5年总生存率为90.5%、51.4%、0%(仅1例,存在偏倚)、20%,差异有统计学意义(P<0.05)。多因素分析显示TNM分期为影响预后的独立影响因素(P<0.05),所以对于该疾病应提高意识,争取做到早期诊断,并及时予以治疗。
综上所述,pNENs临床表现各异,易误诊漏诊;根治性手术切除可较好改善病人预后;通过TNM分期和WHO分级,并结合淋巴结及远处转移、血管侵犯等因素可对疾病预后进行指导。
