茶树胡萝卜素合成关键基因CsLCYb和CsLCYe的克隆与功能鉴定
2019-06-20刘关华杨梅付建玉
刘关华,杨梅,付建玉
茶树胡萝卜素合成关键基因和的克隆与功能鉴定
刘关华1,2,3,杨梅1,2,3,付建玉1,2*
1. 中国农业科学院茶叶研究所,浙江 杭州 310008;2. 农业农村部茶叶质量安全控制重点实验室,浙江 杭州 310008 3. 中国农业科学院研究生院,北京 100081
胡萝卜素是茶树叶片色素重要的组分之一,具有参与光合作用、保护光合系统的功能。从茶树叶片转录组中获得两个胡萝卜素合成关键基因:番茄红素--环化酶基因()和番茄红素--环化酶基因(),它们分别含含1 515 bp和1 524 bp的开放阅读框,编码504和507个氨基酸残基,与其他植物的同源基因高度相似。利用多基因串联表达证明能够将番茄红素环化成胡萝卜素,而则无此活性。通过ELISA分析胡萝卜素生成效率,发现含有表达载体的菌落能够产生大量胡萝卜素,与阴性对照差异极显著,而含有表达载体的菌落则与阴性对照一致,无胡萝卜素产生。这与茶树中胡萝卜素的种类和含量水平一致,说明茶树主要是通过LCYb途径产生胡萝卜素。qRT-PCR分析表明,在黄化品种中黄2号的不同叶位中表达水平与其黄化程度呈正相关,与胡萝卜素含量水平相一致,并且该基因在正常叶色品种龙井43和中黄2号的相对表达结果也符合这一规律。这充分证明在黄化茶树叶片的胡萝卜素合成和叶色变化过程中扮演了重要的角色。本研究阐明了茶树胡萝卜素合成的关键基因和主要途径,为揭示茶树黄化的分子机理提供了重要的遗传基础。
茶树;番茄红素环化酶;胡萝卜素;基因表达;黄化
高等植物叶片中的色素主要分为4大类:类黄酮化合物,以花色素苷类为主;甜菜红素类,包括甜菜黄素和-花青苷,这类物质仅存在于石竹目植物中;类胡萝卜素,包括叶黄素和胡萝卜素;叶绿素类,主要包括叶绿素a和叶绿素b。正常绿色叶片中叶绿素含量高于其他色素含量,叶片呈绿色[1-2]。当不同色素含量比率发生变化时,叶片颜色也随之发生改变。如类胡萝卜素较叶绿素含量高时,叶片就会呈现黄色[3-4]。胡萝卜素广泛存在于植物叶绿体中,是人类和动物膳食中维生素A的前体物质,且广泛应用于食品、化妆品、动物饲料等行业[5-6],其氧化裂解后形成的脱辅基类胡萝卜素可以生成植物激素,如脱落酸和独脚金内酯,参与植物的生长发育[7-8]。在叶色特异植物中,叶片色素组成比例的变化,是植物适应周围环境和保护光合系统的策略[9]。在光合作用的过程中,光合系统生成的氧化性很强的单线态氧可被类胡萝卜素有效地淬灭,保护光合系统[5]。
胡萝卜素为四萜类化合物,其主要通过MEP(甲基赤藓醇-4-磷酸途径)途径合成[10-13]:IPP在DXS(1-脱氧--木酮糖-5-磷酸还原异构酶)的催化下合成1-脱氧--木酮糖-5-磷酸,再由DXR(脱氧木酮糖-5-磷酸合酶)、CMK(4-二磷酸胞苷-2--甲基赤藓糖激酶)、MCS(2-甲基赤藓糖-2,4-环二磷酸合酶)、HDS(1-羟基-2-甲基-2-()-丁烯基4-二磷酸合酶)经过一系列催化,合成胡萝卜素前体物质香叶基香叶基焦磷酸(GGPP)[14],两分子GGPP在八氢番茄红素合成酶的催化下缩合成八氢番茄红素(phytoene),phytoene在PDS(八氢番茄红素脱氢酶)和ZDS(-胡萝卜素脱氢酶)的催化下,生成番茄红素(lycopene),lycopene在番茄红素--环化酶(-LCY)催化下,生成-胡萝卜素和-胡萝卜素,或经番茄红素--环化酶(-LCY)作用生成-胡萝卜素[15]。
细菌、藻类和高等植物均存在番茄红素环化酶(LCY),它们分成三个类型:第一类是细菌类的CrtY、藻类和植物的CrtL型(包括-LCY),植物的-LCY和细菌的番茄红素-单环化酶也属于这一类型;第二类是细菌的CrtYc和CrtYd,以及真菌类的CrtYB型;第三类是仅在绿硫菌和蓝藻细菌的CruA/CruP型[16-17]。多基因串联表达是研究植物胡萝卜素合成途径相关基因功能的有效方法之一,即在一个载体中串联胡萝卜素合成途径的关键基因,转入大肠杆菌中表达,通过观察菌落的颜色可以直接鉴定各基因的功能[18-20]。
茶叶中总胡萝卜素含量约占鲜叶干重的0.06%,包括-胡萝卜素、-胡萝卜素和-胡萝卜素[21]。中黄2号等叶色黄化的茶树是近年来选育的特异新品种,因其特殊的叶色和滋味、香气而备受关注,黄化茶树叶片中类胡萝卜素的总量较正常品种(福鼎大白)高,且相关基因的表达量也较福鼎大白高[22-23]。茶叶中关于胡萝卜素的研究主要集中在含量的测定及其不同品种间的差异[24],无相关分子机理的研究报道。本文首次获得了茶树胡萝卜素合成的两个关键基因:茶树番茄红素--环化酶基因()和番茄红素--环化酶基因(),利用体外胡萝卜素合成途径重构方法,构建了多基因串联表达载体,通过显色反应和胡萝卜素含量测定明确了两个基因的生化功能,并分析了其在中黄2号茶树不同叶位中的表达情况,为解析黄化茶树叶色变异的分子机理,发掘利用特异茶树种质资源提供了重要理论依据。
1 材料和方法
1.1 茶树CsLCYb和CsLCYe基因克隆
龙井43叶片转录组筛选得到的[25]Unigene与其他物种蛋白序列比对选用NCBI的Blastp(https://blast.ncbi.nlm.nih.gov/Blast.cgi),使用Primer primer 6.0根据转录组筛选出来的两个基因序列设计扩增全长引物(表1)。茶树叶片总RNA采用植物多糖多酚总RNA提取试剂盒(天根生物技术有限公司,北京)提取,RNA浓度采用NanoDrop1000分光光度计(Thermo Fisher Scientific,Waltham,MA,USA)测定,RNA质量采用变性琼脂糖凝胶电泳检测。叶片总RNA(100 ng·μL-1)经反转录试剂盒PrimeScript™ RT Reagent Kit with gDNA Eraser(TaKaRa, Co. Ltd, Dalian, China)反转录成cDNA。PCR反应程序如下:94℃预变性2 min;98℃变性10 s,56℃退火30 s,68℃延伸2 min,共35个循环;72℃延伸10 min。1%琼脂糖凝胶电泳检测PCR产物,131 V电压电泳25 min,采用琼脂糖凝胶回收试剂盒回收目的条带,亚克隆至pClone700载体上,采用M13通用引物双向测序(杭州擎科梓熙生物技术有限公司)。

表1 茶树CsLCYe和CsLCYb基因克隆与表达引物
1.2 多基因串联共表达载体的构建
表达载体利用pAC-LYC质粒为骨架构建,该载体上串联了番茄红素合成的3个关键基因:E(AAA64977.1,合成前体香叶基香叶基焦磷酸GGPP);B(AAA64982.1,将GGPP催化生成八氢番茄红素phytoene);I(AAA64981.1,将八氢番茄红素脱氢生成番茄红素lycopene)。在基因两端引入SacⅠ酶切位点,同时将基因和pAC-LYC质粒用SacI酶切再后插入基因E和I之间区域,构建pAC-LYC-多基因串联表达载体。采用同样方法,在两端引入HindⅢ和SpeⅠ酶切位点,构建pAC-LYC-多基因串联表达载体。
1.3 基因表达与生化功能分析
采用热激法将pAC-LYC-和pAC-LYC-质粒及3个对照质粒(空白对照pAC-I:只含1个番茄红素合成相关基因I,菌落无颜色变化;阴性对照pAC-LYC:含有番茄红素合成的3个关键基因I、B、E,能够生成番茄红素而使菌落呈粉红色;阳性对照pAC-BETA:含有拟南芥胡萝卜素合成的4个关键基因:I、B,E、Y,能够将番茄红素环化成-胡萝卜素而使菌落呈橘黄色)分别同时转入100 µL的DH5α化学感受态细胞中[26],加入1 mL预冷的LB培养基,在37℃下复苏1 h后,均匀涂布于含氯霉素(3.2 mg·mL-1)的LB平板上,37℃倒置培养24 h后,室温下(25℃)避光培养3 d。如果有功能,则能够将pAC-LYC质粒编码的蛋白生成的番茄红素环化生成-胡萝卜素而呈橘黄色,若有功能,则能将pAC-LYC质粒编码的蛋白生成的番茄红素环化生成-胡萝卜素而呈黄色,无活性则两者都依然呈现番茄红素的粉红色。因此先通过观察含有不同质粒的菌落显色变化,再从含有空白对照质粒和两个茶树番茄红素环化酶基因质粒的菌落中分别随机挑取12个等面积的菌落(各约10 mg),每个菌落用100 μL PBS的比例稀释后,测定其胡萝卜素含量。菌落胡萝卜素含量用胡萝卜素ELISA试剂盒经酶标仪Rayto RT-6100测定:先用胡萝卜素标准品浓度梯度测定440~454 nm处的特征吸收峰值,绘制标准曲线,再用同样方法测定每个菌落样品的特征吸收峰值,根据标准曲线计算其胡萝卜素含量[27-28]。
1.4 CsLCYb和CsLCYe基因在黄化茶树叶片中的表达分析
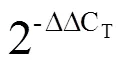
2 结果与分析
2.1 CsLCYe和CsLCYb基因克隆与生物信息学分析
(ADK74376.1)和(KM519983.1)基因的开放阅读框为1 524 bp和1 515 bp,分别编码507个氨基酸残基和504个氨基酸残基长度的蛋白质。NCBI比对结果显示,CsLCYe序列与猕猴桃(PSS20792.1)、映山红(BAS69437.1)、麻风树(XP_012076949.1)番茄红素环化酶的同源性较高,分别为88%、85%和84%。CsLCYb序列与猕猴桃(PSS33530.1)、映山红(BAS69436.1)番茄红素环化酶和葡萄番茄红素环化酶2(AFP28799.1)的同源性较高,分别为91%、91%和89%。
经MAGE 7.0蛋白序列分析显示,CsLCYe和CsLCYb含有植物番茄红素环化酶保守的二核苷酸信号结合保守区域(FAD结合区域),环化酶保守结构域1和2,以及带电保守结构域(图1)。ExPASy-ProtParam(http://web. expasy. org/protparam)在线分析蛋白理化性质[29]显示,CsLCYe蛋白分子量为59.42 kD,理论等电点pI=7.29;CsLCYb蛋白的分子量为56.67 kD,理论等电点pI=8.3。
采用MAGE 7.0的NJ(Neighbor Joining)法将CsLCYe和CsLCYb与其他植物的同源蛋白进行系统发育分析[30],结果显示,茶树的两个番茄红素环化酶与猕猴桃的番茄红素环化酶聚在了同一支上(图2)。茶树与猕猴桃同属山茶目植物,最近公布的茶树基因组的研究结果也显示,茶树与猕猴桃的亲缘关系最近[31],相关基因聚在一支与物种的分类地位相一致。CsLCYb与黄龙胆科的黄龙胆(ABK57115.1)和椴树科的黄麻(OMO58144.1)的LCYb距离的较远,CsLCYe与兰科的铁皮石斛(PKU88076.1)和石蒜科的水仙LCYe(PKU88076.1)亲缘关系较远。
2.2 基因表达与功能鉴定
图3-A为重组质粒结构图。体外多基因串联表达显示,含有pAC-LYC-的菌落呈粉红色,与不含胡萝卜素合成基因的阴性对照pAC-LYC一致。含有pAC-LYC-的菌落呈橘黄色,与含拟南芥胡萝卜素合成基因的阳性对照pAC-BETA颜色一样(图3-B)。该结果说明,茶树的两个番茄红素环化基因中,只有具有活性,它能将粉红色的番茄红素环化成橘黄色的-胡萝卜素,而则无番茄红素环化功能,不能生成胡萝卜素。
为进一步验证茶树两个番茄红素环化酶转化生成胡萝卜素的活性,用ELISA方法分析了含有其表达质粒菌落中的胡萝卜素含量。分别利用胡萝卜素标准品建立的标准曲线都为:=348.63+1.807 8,2=0.990 1。结果显示,含表达载体的菌落特征吸收峰值与-胡萝卜素标准品一致,菌落中的-胡萝卜素平均含量为740.228 mg·mL-1,与阴性对照相比差异极显著(<0.01);含表达载体的菌落则在-胡萝卜素特征吸收峰值处无结果,测定其-胡萝卜素含量与阴性对照相比无显著差异(>0.05)(图4)。该生化测定结果充分表明,在体外具有将番茄红素环化成-胡萝卜素的功能,酶活性较高,而则无环化番茄红素的功能。

注:AtLCYe:拟南芥番茄红素-ε-环化酶;AtLCYb:拟南芥番茄红素-β-环化酶

注:CsLYCe:茶树;AcLYCe:猕猴桃;QsLYCe:栓皮栎;VvLYCe:葡萄;ToLYCe:山麻黄;IbLYCe:甘薯;MnLYCe:桑科;DcLYCe:胡萝卜;EuLYCe:银叶胡颓子;FaLYCe:草莓;CmLYCe:甜瓜;GlLYCe:黄龙胆;NtLYCe:烟草;AtLYCe:拟南芥;AaLYCe:金盏菊;CoLYCe:长蒴黄麻;NtaLYCe:水仙;SoLYCe:菠菜;GsLYCe:野生大豆;HiLYCe:紫花风铃;RcLYCe:蓖麻;LsLYCe:莴苣;AcoLYCe:菠萝;DcaLYCe:铁皮石斛;AcLYCB:猕猴桃;QsLYCB:栓皮栎;HiLYCb:紫花风铃;McLYCb:博落回;CcLYCB:麻黄;NaLYCB:烟草;DhLYCB:牛耳草;DcLYCB:胡萝卜;GsLYCB:野生大豆;MnLYCB:桑树;IbLYCB:红薯;RjLYCB:杜鹃;ToLYCB:蒲公英;DzLYCB:榴莲;MdLYCB:苹果;ElLYCB:透骨草;RrLYCB:玫瑰;CsLYCB:茶树;VvLYCB:葡萄;DkLYCB:柿树;ClLYCB:西瓜;GlLYCB:黄龙胆;CpLYCB:番木瓜;AaLYCB:夏侧金盏花;CsiLYCB:甜橙
2.3 CsLCYb和CsLCYe基因在黄化茶树叶片中的表达分析
表型观察发现,黄化期的中黄2号顶芽至第二叶为黄色,第三叶完全变成了绿色[32]。为进一步确定和在中黄2号不同叶位的表达量,以qRT-PCR方法测定了两个基因在中黄2号黄化期的顶芽、顶芽下第一叶、第二叶、第三叶的表达谱,以转绿程度最高的第三叶为对照。结果显示,和在第一叶中表达量最高,分别是第三叶的13.50倍和6.99倍,其中,在第一叶中的表达量较第三叶差异显著(<0.05);而在第二叶和顶芽的表达水平较为接近,其表达量分别是第三叶的6.62倍和6.43倍;在顶芽的表达量为第三叶的3.94倍,第二叶的表达量仅为第三叶的1.58倍(图5)。相同叶位基因表达结果显示,的表达量较高。
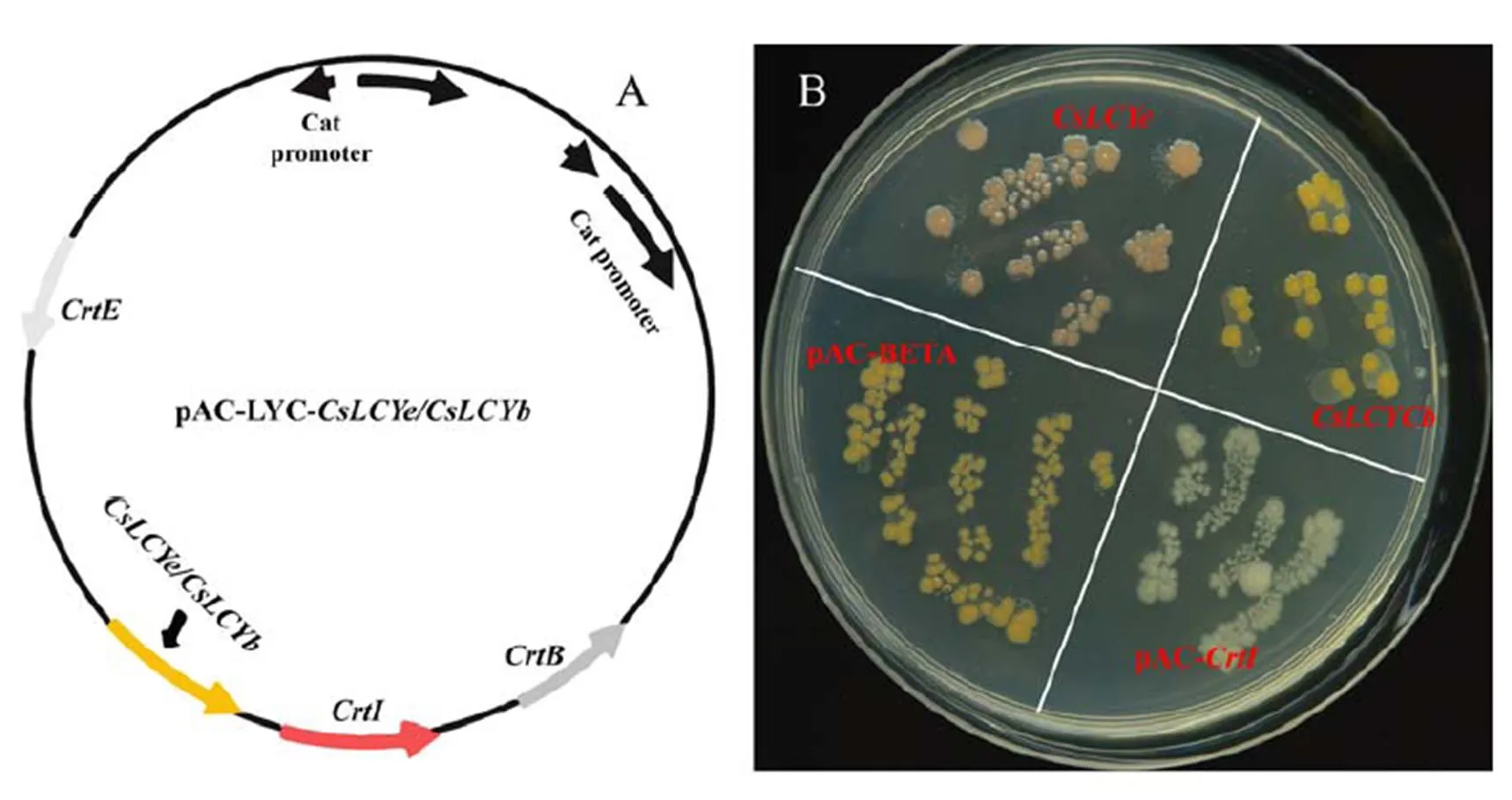
注:A. pAC-LCY重组质粒结构图。CrtE:香叶基香叶基焦磷酸合成酶基因;CrtI:番茄红素合成酶基因;CrtB:八氢番茄红素合成酶基因;CsLCYe和CsLCYb:茶树番茄红素环化酶基因。B. 粉红色菌落:CsLCYe;黄色菌落:CsLCYb和pAC-BETA;白色菌落:pAC-CrtI空白对照。pAC-BETA:番茄红素-β-环化酶阳性对照
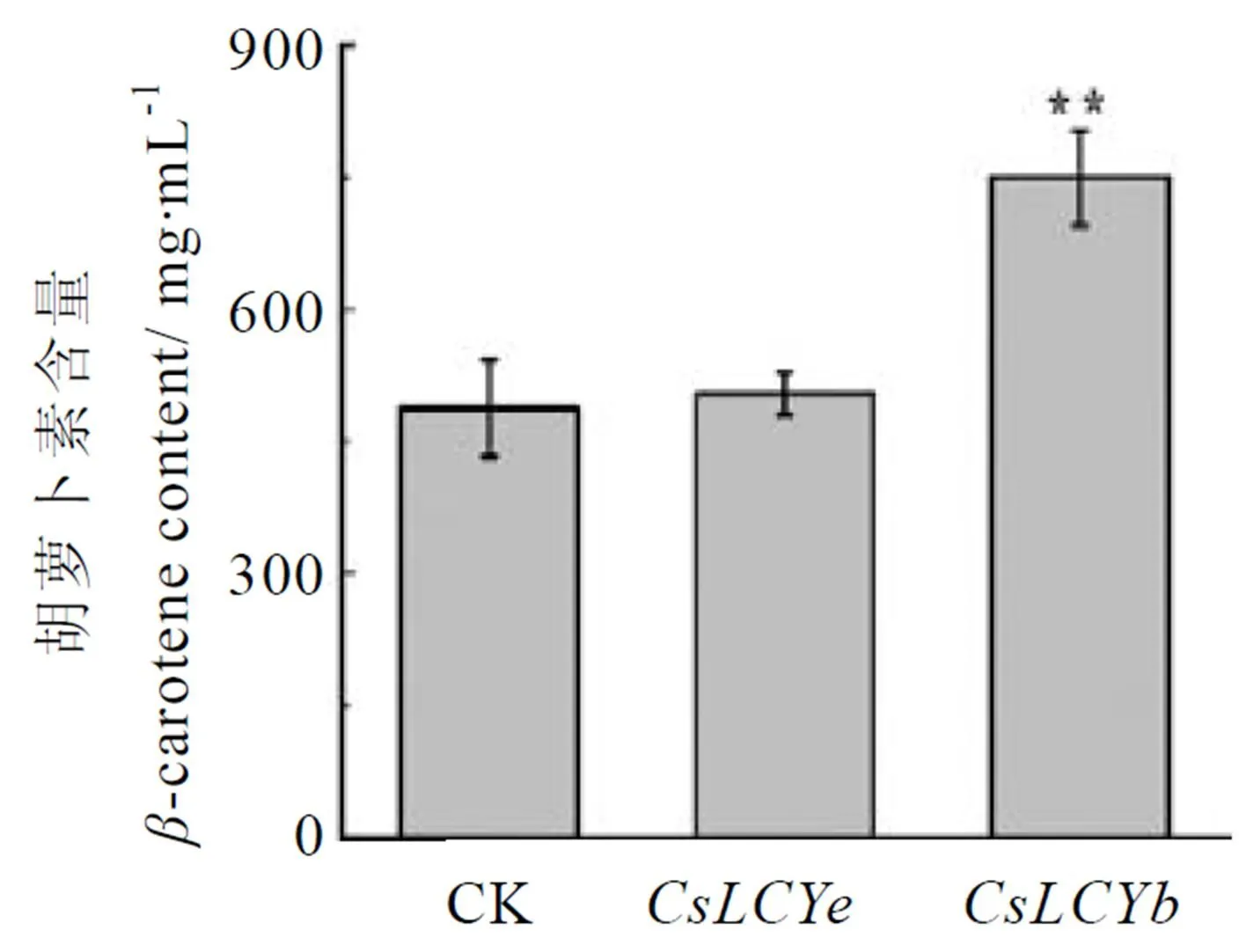
注:与对照相比,**:P<0.01
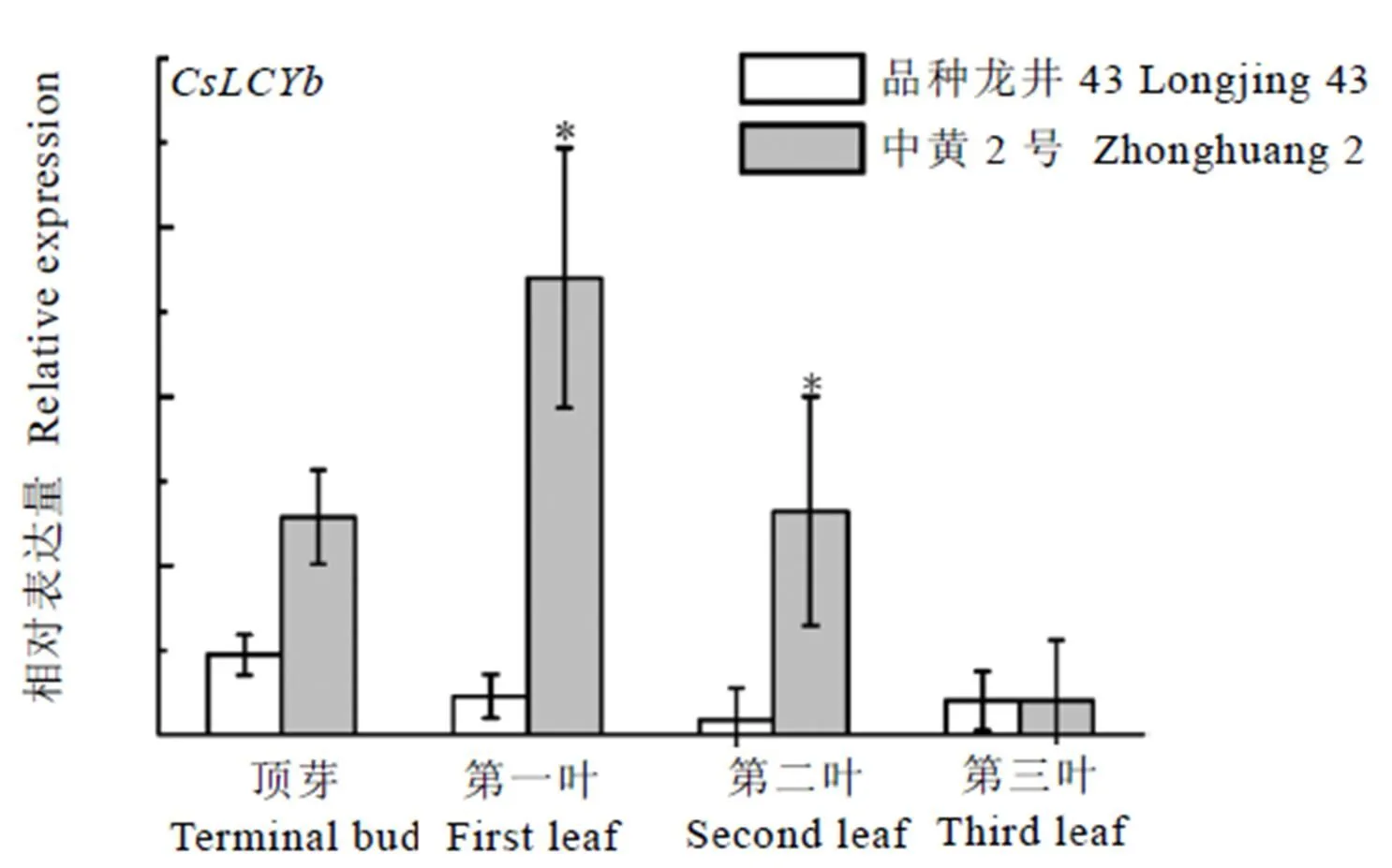
在确定了具有生化活性的基础上,测定了该基因在龙井43和中黄2号不同叶位的表达谱。结果显示,该基因在中黄2号黄化叶位的相对表达量均高于龙井43,在黄化程度较高的第一叶(<0.05)和第二叶(<0.05)差异显著,转绿的第三叶的表达水平则和龙井43基本一致(图6)。
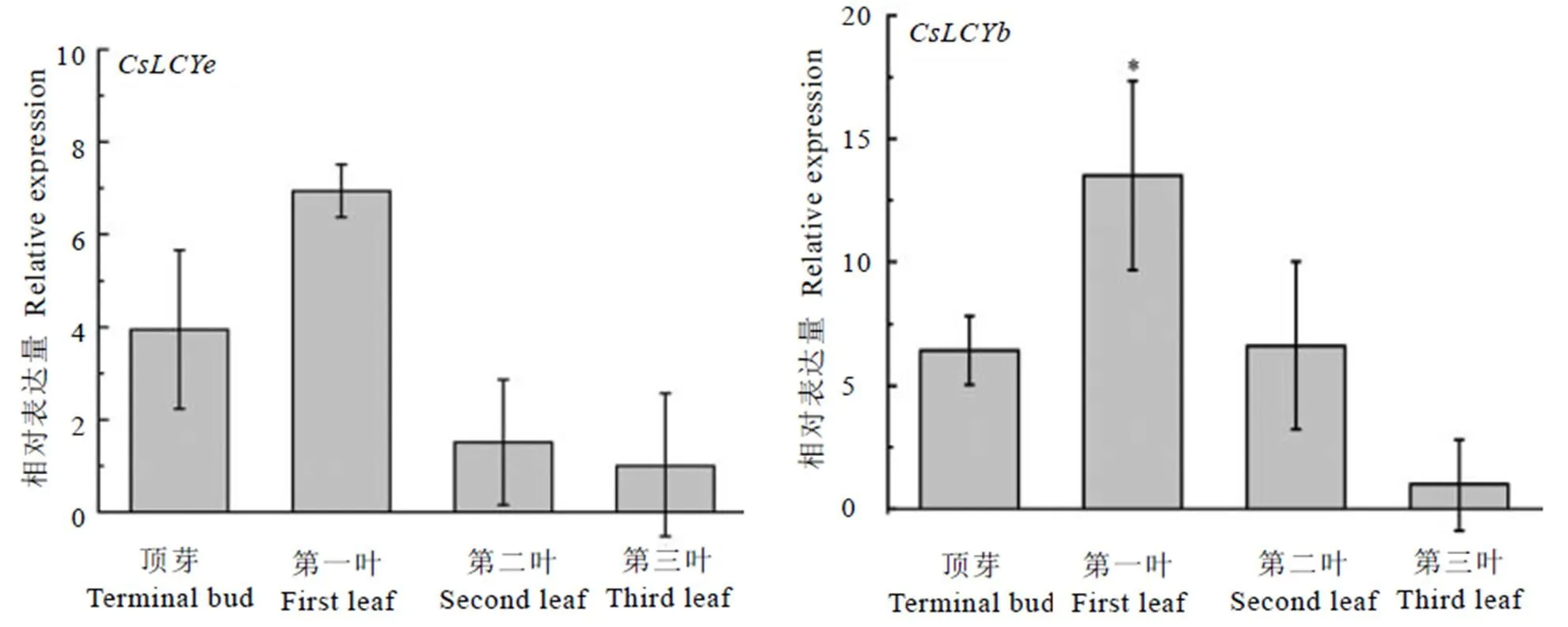
注:与第三叶相比,*:差异显著(P<0.05)
注:*:差异显著(<0.05)
Note: *: The difference is statistically significant (<0.05)
图6在顶芽不同叶位的相对表达量
Fig. 6 Relative expression level ofin terminal bud and different leaves
3 讨论
大多数植物的LCYe仅可以催化线性的番茄红素生成单环的-胡萝卜素,-胡萝卜素在LYCb的进一步催化下生成含-环和-环的-胡萝卜素,而LCYb则能独立地将番茄红素环化成-胡萝卜素,也能将-胡萝卜素环化成-胡萝卜素和-胡萝卜素[27,33]。植物的LCYe和LCYb的底物都是番茄红素,因此其结合底物的结构域和稳定反应中间产物的活性位点高度相似[34-35]。本研究分离得到的茶树两个番茄红素环化酶CsLCYe和CsLCYb,其序列高度相似,含有与其他植物同源蛋白一致的保守结构域(图1和图2)。LCYe/LCYb蛋白的比例也一直被认为是控制植物-胡萝卜素、叶黄素、玉米黄素等的生物合成及其含量比例的基础[36]。茶树新梢中含有-胡萝卜素、-胡萝卜素和-胡萝卜素,未发现单环的-胡萝卜素,其中-胡萝卜素含量占了茶叶总类胡萝卜素的80%[21]。在胡萝卜素合成相关基因的串联表达反应中,含番茄红素的菌落呈粉红色,而产生胡萝卜素的菌落则呈黄色或橘黄色[15],因此通过颜色变化可直观的判定基因的功能。本研究通过多基因串联反应证明了茶树CsLCYb具有将番茄红素环化成-胡萝卜素的功能,ELISA测定其产物与-胡萝卜素标准品特征吸收峰值一致,且酶活性较高。说明是茶树中生成胡萝卜素的关键基因,这与茶树中已知的胡萝卜素种类与含量相吻合。同时CsLCYe无生成-胡萝卜素的活性,而茶树中也未发现单环的-胡萝卜素,充分表明CsLCYb将直链的番茄红素两端环化形成带双环的-胡萝卜素是茶树中生成胡萝卜素的主要途径。
已有研究表明,在黄化茶树品种中,顶芽下第一叶的胡萝卜素含量最高,其次是第二叶,在顶芽和第三叶含量最低[23,37-38]。在中黄2号不同叶位的相对表达水平与该结果相一致,其表达量与黄化程度呈正相关,即顶芽下第一叶表达量最高,其次是第二叶和顶芽,基本转绿的第三叶表达量最低。在正常叶色品种龙井43和中黄2号的相对表达量水平也符合这一规律。基因表达水平分析进一步表明,在黄化茶树叶片中的胡萝卜素合成和叶色变化过程中扮演了重要的角色,它是茶树叶片黄化的重要调控基因。
致谢:感谢开国银教授提供质粒pAC-LYC。
[1] Tanaka Y, Sasaki N, Ohmiya A. Biosynthesis of plant pigments: anthocyanins, betalains and carotenoids [J]. The Plant Journal, 2008, 54(4): 733-749.
[2] Nishio J N. Why are higher plants green?Evolution of the higher plant photosynthetic pigment complement [J]. Plant Cell & Environment, 2010, 23(6): 539-548.
[3] Grotewold E. The genetics and biochemistry of floral pigments [J]. Annual Review of Plant Biology, 2006, 57(1): 761-780.
[4] Rockwell N C, Su Y S, Lagarias J C. Phytochrome structure and signaling mechanisms [J]. Annual Review of Plant Biology, 2006, 57(1): 837-858.
[5] Frank H A, Cogdell R J. Carotenoids in photosynthesis [J]. Photochem Photobiol, 1996, 63(3): 257-264.
[6] Lintig J V. Colors with functions: elucidating the biochemical and molecular basis of carotenoid metabolism [J]. Annual Review of Nutrition, 2010, 30(1): 35-56.
[7] Nambara E, Marion-Poll A. Abscisic acid biosynthesis and catabolism [J]. Annual Review of Plant Biology, 2005, 56: 165-185.
[8] Al-Babil S, Bouwmeester H J. Strigolactones, a novel carotenoid-derived plant hormone [J]. Annual Review of Plant Biology, 2015, 66(1): 161-186.
[9] Tanaka R, Tanaka A. Tetrapyrrole biosynthesis in higher plants [J]. Annual Review of Plant Biology, 2007, 58: 321-346.
[10] Bach T J. Some new aspects of isoprenoid biosynthesis in plants—a review [J]. Lipids, 1995, 30(3): 191-202.
[11] McGarvey D J, Croteau R. Terpenoid metabolism [J]. Plant Cell, 1995, 7(7): 1015-1026.
[12] 李莉, 高凌云, 董越, 等. 植物类异戊二烯生物合成相关酶基因研究进展[J]. 浙江师范大学学报(自然科学版), 2008, 31(4): 461-466.
[13] 高慧君, 明家琪, 张雅娟, 等. 园艺植物中类胡萝卜素合成与调控的研究进展[J]. 园艺学报, 2015, 42(9): 1633-1648.
[14] Cheng A, Lou Y, Mao Y, et al. Plant terpenoids: biosynthesis and ecological functions [J]. Journal of Integrative Plant Biology, 2007, 49(2): 179-186.
[15] Cunningham F X Jr, Gantt E. Genes and enzymes of carotenoid biosynthesis in plants [J]. Annual Review of Plant Physiology and Plant Molecular Biology, 1998, 49(1): 557-583.
[16] Takaichi S. Carotenoids in algae: distributions, biosyntheses and functions [J]. Marine Drugs, 2011, 9(6): 1101-1118.
[17] Takaichi S. Tetraterpenes: carotenoids [M]∥Merillon J M, Ramawat K G. Berlin: Springer: Natural Products, 2013: 3251-3283.
[18] Schnurr G, Misawa N, Sandmann G. Expression, purification and properties of lycopene cyclase from[J]. Biochemical Journal, 1996, 315(3): 869-874.
[19] Hisashi H, Norihiko M. Novel approaches and achievements in biosynthesis of functional isoprenoids in[J]. Applied Microbiology & Biotechnology, 2009, 84(6): 1021-1031.
[20] Sugiyama K, Ebisawa M, Yamada M, et al. Functional lycopene cyclase (crua) in cyanobacterium, arthrospira platensis nies-39, and its role in carotenoid synthesis [J]. Plant & Cell Physiology, 2017, 58(4): 831-838.
[21] 宛晓春. 茶叶生物化学[M]. 3版. 北京: 中国农业出版社, 2003, 23-29.
[22] Wang L, Yue C, Cao H, et al. Biochemical and transcriptome analyses of a novel chlorophyll-deficient chlorina tea plant cultivar [J]. BMC Plant Biology, 2014, 14: 352. doi.org/10.1186/s12870-014-0352-x.
[23] Li N, Yang Y, Ye J, et al. Effects of sunlight on gene expression and chemical composition of light-sensitive albino tea plant [J]. Plant Growth Regulation, 2016, 78(2): 253-262.
[24] 邓静, 王远兴, 丁建. 白茶与安吉白茶的研究进展[J]. 食品工业科技, 2013, 34(4): 369-374.
[25] Grabherr M G, Haas B J, Yassour M, et al. Full-length transcriptome assembly from RNA-Seq data without a reference genome [J]. Nature Biotechnology, 2011, 29(7): 644-652.
[26] Cunningham F X Jr, Sun Z, Chamovitz D, et al. Molecular structure and enzymatic function of lycopene cyclase from the cyanobacterium synechococcus sp. strain PCC7942 [J]. Plant Cell, 1994, 6(8): 1107-1121.
[27] Francis X C, Barry P, Zairen S, et al. Functional analysis of the beta and epsilon lycopene cyclase enzymes of Arabidopsis reveals a mechanism for control of cyclic carotenoid formation [J]. Plant Cell, 1996, 8(9): 1613-1626.
[28] 金应福, 韩莉, 张莎莎, 等. 通过番茄红素环化酶的优化构建-胡萝卜素高产菌株[J]. 生物工程学报, 2017, 33(11): 1814-1826.
[29] Gasteiger E, Hoogland C, Gattiker A, et al. Protein identification and analysis tools on the ExPASy Server [M]∥John M Walker. The proteomics protocols handbook. humana press, 2005: 571-607.
[30] Kumar S, Stecher G, Tamura K. MEGA7: molecular evolutionary genetics analysis version 7.0 for bigger datasets [J]. Molecular Biology and Evolution, 2016, 33(7): 1870-1874.
[31] Wei C, Yang H, Wang S, et al. Draft genome sequence ofvar.provides insights into the evolution of the tea genome and tea quality [J]. Proc Natl Acad Sci U S A, 2018, 115(18): E4151-E4158.
[32] 虞富莲. 中黄1号、中黄2号的特异性、一致性和稳定性[J]. 中国茶叶, 2016, 38(3): 14-16.
[33] Pecker I, Gabbay R, Cunningham F X Jr, et al. Cloning and characterization of the cDNA for lycopene-cyclase from tomato reveals decrease in its expression during fruit ripening [J]. Plant Molecular Biology, 1996, 30(4): 807-819.
[34] Pogson B, McDonald K A, Truong M, et al. Arabidopsis carotenoid mutants demonstrate that lutein is not essential for photosynthesis in higher plants [J]. Plant Cell, 1996, 8(9): 1627-1639.
[35] 朱跃辉, 姜建国. 类胡萝卜素代谢途径中相关番茄红素环化酶的功能[J]. 中国食品添加剂, 2005(5): 40-43.
[36] Ronen G, Cohen M, Zamir D, et al. Regulation of carotenoid biosynthesis during tomato fruit development: expression of the gene for lycopene epsilon cyclase is down-regulated during ripening and is elevated in the mutant delta [J]. Plant Journal, 1999, 17(4): 341-351.
[37] Norman I K, Elizabeth J J. Carotenoid actions and their relation to health and disease [J]. Molecular Aspects of Medicine, 2005, 26(6): 459-516.
[38] Feng L, Gao M J, Hou R Y, et al. Determination of quality constituents in the young leaves of albino tea cultivars [J]. Food Chemistry, 2014, 155(11): 98-104.
Cloning and Functional Analysis ofandfor Carotene Biosynthesis in Tea Plant()
LIU Guanhua1,2,3, YANG Mei1,2,3, FU Jianyu1,2*
1. Tea Research Institute, Chinese Academy of Agricultural Sciences, Hangzhou 310008, China; 2. Key Laboratory of Tea Quality and Safety Control, Ministry of Agriculture and Rural Affairs, Hangzhou 310008, China; 3. Graduate School of Chinese Academy of Agricultural Sciences, Beijing 100081, China.
Carotene, participating in photosynthesis and protecting photosynthetic system, is one of the important pigments of tea leaves. Two key genes [lycopene-cyclase gene () and lycopene-cyclase gene ()] of carotene biosynthesis in tea plant were cloned from transcriptome. They are 1 515 bp and 1 524 bp in length, and encode 504 and 507 amino acid residues, respectively. Based on sequences alignment,andare highly conserved as compared with the homologous genes from other plants. Multiple-gene tandem expression indicated thatcan cyclize lycopene to-carotene whilewas inactive. The enzymatic activities of the two genes were further confirmed by ELISA method in. It showed thatwas able to generate a large amount of carotene, which was significantly different from the negative control. However, no carotene was detected in the colonies with the expression plasmid of pAC-LYC-. The type and content of carotene in tea foliage were consistent with previous reports, which proved that carotene was mainly produced by the LCYb pathway in tea plant. The qRT-PCR analysis revealed that the expression level ofin buds and different leaves of Zhonghuang 2 was positively correlated with the degree of chlorisis and the content of carotene. Furthermore, its relative expression in normal cultivar Longjing 43 and chlorisis cultivar Zhonghuang 2 also showed similar pattern. These findings confirmed thatplays a key role in the carotene biosynthesis and leaf color changing in tea plant, which also provided an important genetic basis for uncovering the molecular mechanism of chlorisis in tea cultivars.
tea plant, lycopene cyclase, carotene, gene expression, chlorisis cultivars
S571.1;Q52
A
1000-369X(2019)03-257-10
2019-01-23
2019-02-13
国家自然科学基金(31470693,31100503)、浙江省自然科学基金(LY18C160006)、中央级公益性科研院所基本科研业务费专项(1610212018004,1610212016017)、中国农业科学院科技创新工程(CAAS-ASTIP-2014-TRICAAS)
刘关华,男,主要从事茶树栽培与育种的研究,E-mail: m15079683172@163.com。*通信作者:mybatigoal@mail.tricaas.com
