睡眠时相相关阻塞性睡眠呼吸暂停对急性脑梗死患者睡眠结构及预后的影响
2019-06-20陈沁李洁毛成洁沈赟傅翔刘昱璐刘春风
陈沁,李洁,毛成洁,沈赟,傅翔,刘昱璐,刘春风,2
约72%急性卒中患者合并睡眠呼吸障碍,其中OSA与急性脑梗死(acute ischemic stroke,AIS)有密切关系[1-3]。OSA是脑梗死的一项独立危险因素[4]。本课题组既往研究显示,AIS患者总睡眠时间减少、睡眠效率降低,合并OSA时浅睡眠l期延长、深睡眠缩短,出院3个月mRS评分显著高于不合并OSA的AIS患者[5]。近期一项研究发现,非快动眼睡眠(non-rapid eye movement,NREM)期相关OSA更为严重,其冠状动脉疾病发病率也高于REM期相关OSA[6]。REM期相关OSA和NREM期相关OSA是否对脑梗死患者睡眠结构和预后存在不同的影响,这方面的研究较少。因此,本研究通过观察AIS患者睡眠情况、情绪、认知、梗死部位及预后,探讨REM期相关OSA和NREM期相关OSA对AIS患者睡眠结构和预后的影响。
1 研究对象与方法
1.1 研究对象 本研究为回顾性研究,收集2011年2月-2018年8月于苏州大学附属第二医院就诊的AIS患者。入选标准:①发病7 d以内;②年龄≥18岁;③符合《中国急性缺血性卒中诊治指南2014》的诊断标准,明确诊断为AIS的患者;④病情稳定,可配合完成量表评分和PSG。排除标准:①并发肺部感染等急性疾病或生命体征不稳定、需行去骨瓣减压术等;②有严重认知功能障碍无法配合检查或拒绝配合检查;③有OSA相关手术或呼吸机治疗史;④有严重心、肝、肾疾患或合并其他躯体疾病(如帕金森病、肌张力障碍等);⑤关键数据缺失的病例。
1.2 一般资料收集 基线资料包括年龄、性别、受教育年限、高血压、糖尿病、血脂异常、既往脑血管病史、冠状动脉粥样硬化性心脏病、心房颤动、吸烟、饮酒史,发病至入院的时间及静脉溶栓或血管内治疗的情况等。发病前吸烟>10支/天并持续1年以上者,认为存在吸烟史。将12.5 g酒精界定为1杯,发病前男性每周饮酒≥14杯,女性每周饮酒≥7杯,并持续1年以上者,即认为有饮酒史。
1.3 头颅磁共振检查 在脑梗死发病一周内完成头颅MRI检查,明确新发梗死病灶部位,并将其分为大脑半球、间脑、小脑和脑干等部位,由神经科专科医师根据患者临床表现确定责任病灶。
1.4 情绪及认知评价 患者进行PSG前应用焦虑自评量表(self-rating anxiety scale,SAS)、汉密尔顿焦虑量表(Hamilton anxiety scale,HAMA)、抑郁自评量表(self-rating depression scale,SDS)、汉密尔顿抑郁量表(Hamilton depression scale,HAMD)评估患者焦虑和抑郁情况,应用MMSE、MoCA评估患者认知功能。
1.5 睡眠量表、多导睡眠监测及患者分组 使用Epworth嗜睡量表(Epworth sleep scale,ESS)评价患者日间嗜睡情况,使用疲劳严重度量表(fatigue severity scale,FSS)、疲劳量表-14(fatigue scale-14,FS-14)评估患者疲劳程度,使用匹兹堡睡眠质量指数(Pittsburgh sleep quality index,PSQI)评价患者睡眠质量。应用美国伟康公司的Alice4和泰科公司Sandman Elite多导睡眠采集分析系统进行睡眠呼吸监测。监测项目包括脑电图、下颌肌电图、眼动电图、热敏及压力式口鼻气流、胸腹运动、血氧饱和度、心电图、腿动、体位。所有数据均根据2007版美国睡眠医学学会标准进行人工评判[7]。记录AHI、氧减指数、总睡眠时间、睡眠效率、NREM时间和百分数[分为NREM1、NREM2、慢波睡眠(slow wave sleep,SWS)]、REM时间和百分数、睡眠潜伏期及REM睡眠潜伏期、夜间最低血氧饱和度、血氧饱和度<90%的比例、呼吸相关微觉醒(次/小时)、最长呼吸暂停时间等情况。监测前禁烟酒≥24 h,隔夜禁食12 h,记录时间≥7 h。
根据患者总睡眠期、REM和NREM期睡眠AHI,将患者分为单纯脑梗死组(AIS,AHI<5次/小时)、脑梗死合并REM期相关OSA组(AIS+REM相关OSA,AHI≥5次/小时且REMAHI/NREM-AHI>2)和脑梗死合并NREM期相关OSA组(AIS+NREM相关OSA,AHI≥5 次/小时且REM-AHI/NREM-AHI≤2)[8]。
1.6 脑梗死分型、神经功能缺损、治疗及预后评价 根据牛津郡社区卒中计划(Oxfordshire community stroke project,OCSP)卒中分型,将脑梗死患者分为完全前循环、部分前循环、后循环和腔隙性梗死。用NIHSS评分评价脑梗死患者入院时、入院48 h及出院时神经功能缺损程度,采用mRS评估脑梗死患者出院时及出院3个月的日常生活自理能力。
1.7 统计学方法 所得数据均使用SPSS 21.0软件统计处理。符合正态分布的计量资料用表示,组间比较采用单因素方差分析,采用LSD检验进行两两比较,非正态分布的资料用中位数M(Q1~Q3)表示,均数比较采用非参数检验。分类变量资料用百分比表示,无序分类资料组间比较采用Pearson卡方检验或Fisher确切概率检验,两组间的比较采用χ2分割检验。等级资料多组间比较采用非参数检验,两组间比较采用Kruskal-Wallis H检验。采用Spearman等级相关检验与出院3个月mRS评分相关的临床指标;先进行单因素分析,因变量为预后良好(出院3个月mRS评分<3分)与预后不良(出院3个月mRS评分≥3分),自变量为患者的临床资料,筛选出有统计学意义的变量,再进行多因素Logistic回归分析。所有检验均采用双侧检验,P<0.05表示差异有统计学意义。
2 结果
2.1 一般资料及脑梗死危险因素的比较 根据入选标准及排除标准,研究期间共有119例脑梗死患者完成PSG,其中数据缺失的有9例,最终共纳入110例,其中男性92例(83.6%),女性18例(16.4%),年龄平均(59±11.9)岁,范围29~82岁,轻型卒中(入院时NIHSS评分≤4分)有98例(89.1%),非轻型卒中(入院时NIHSS评分>4分)有12例(10.9%)。AIS组30例(27.3%),AIS+REM相关OSA组15例(13.6%),AIS+NREM相关OSA组65例(59.1%)。3组之间在性别、年龄、受教育时间、高血压、糖尿病、既往脑血管病史、冠状动脉粥样硬化性心脏病、心房颤动、血脂异常、吸烟、饮酒、脑梗死发病至入院时间、入院NIHSS评分、溶栓或血管内治疗、OCSP分型方面差异均无统计学意义,脑梗死合并NREM期相关OSA组BMI显著高于单纯脑梗死组(P=0.011),AIS组病灶部位多位于大脑半球,AIS+REM相关OSA组病灶依次位于脑干、大脑半球、间脑,差异具有统计学意义(P<0.001)(表1)。
2.2 睡眠质量、睡眠结构及情绪、认知的比较 在睡眠质量及情绪、认知方面,3组在PSQI、ESS、FSS、FS-14(包括躯体疲劳和脑力疲劳)、SAS、HAMA、SDS、HAMD、MMSE和MoCA分值上均无统计学差异(表2)。
在睡眠结构方面,3组的NREM1期时间及比例、SWS比例、AHI、呼吸暂停最长持续时间、氧减指数、血氧低于90%的比例、最低血氧饱和度、微觉醒指数、呼吸相关微觉醒指数、REM呼吸相关微觉醒指数、NREM呼吸相关微觉醒指数、自发相关微觉醒指数、NREM自发相关微觉醒指数整体差异均有统计学意义。
与AIS组相比,AIS+REM相关OSA组AHI(P<0.001)、氧减指数(P=0.007)、血氧低于90%的比例(P=0.001)、呼吸相关微觉醒指数(P=0.038)尤其是REM呼吸相关微觉醒指数(P=0.002)更高,呼吸暂停最长持续时间更长(P<0.001),最低血氧饱和度更低(P=0.001),差异均具有统计学意义(表3)。
与AIS组相比,AIS+NREM相关OSA组NREM1期睡眠时间(P=0.003)及比例(P=0.005)、AHI(P<0.001)、氧减指数(P<0.001)、血氧低于90%的比例(P<0.001)、微觉醒指数(P<0.001)、呼吸相关微觉醒指数(P<0.001)包括REM微觉醒指数(P<0.001)和NREM微觉醒指数(P<0.001)更高,呼吸暂停最长持续时间更长(P<0.001),SWS时间(P=0.027)及比例(P=0.008)、最低血氧饱和度(P<0.001)更低,差异均有统计学意义(表3)。

表1 3组基线资料比较

表2 3组睡眠质量、情绪及认知比较
与AIS+REM相关OSA组相比,AIS+ NREM相关OSA组微觉醒指数(P<0.001)、呼吸相关微觉醒指数(P=0.003)尤其是NREM呼吸相关微觉醒指数(P<0.001)、自发相关微觉醒指数(P=0.030)尤其是NREM自发相关微觉醒指数(P=0.014)更高,差异均具有统计学意义(表3)。
3组在总睡眠时间、睡眠潜伏期、REM潜伏期、睡眠效率、NREM2期睡眠时间及比率、REM期睡眠时间及比率、平均血氧饱和度、觉醒次数、REM自发相关微觉醒指数、腿动相关微觉醒指数和周期性腿动相关微觉醒指数方面差异均无统计学意义(表3)。
2.3 急性脑梗死预后情况 3组在入院后48 h NIHSS评分、出院NIHSS评分、出院mRS评分方面均无统计学意义。随访3个月预后,3组在出院3个月mRS评分差异无统计学意义(表4)。
2.4 脑梗死预后与各项临床指标之间的相关性分析 Spearman等级相关分析提示出院3个月mRS评分与入院时溶栓或血管内治疗(r=0.189,P=0.047)、入院时NIHSS评分(r=0.326,P=0.001)、AHI(r=0.324,P=0.001)、REM-AHI(r=0.262,P=0.006)、NREM-AHI(r=0.299,P=0.002)、氧减指数(r=0.237,P=0.013)、呼吸相关微觉醒指数(r=0.195,P=0.041)尤其是NREM呼吸相关微觉醒指数(r=0.196,P=0.040)、MoCA中命名分值(r=0.399,P=0.019)呈正相关。与年龄、性别、BMI、受教育时间、高血压、糖尿病、既往脑血管病史、冠状动脉粥样硬化性心脏病、心房颤动、吸烟、饮酒、血脂异常、PSQI、ESS、FSS、FS-14、SAS、HAMA、SDS、HAMD、MMSE、总睡眠时间、睡眠效率、睡眠潜伏期、REM潜伏期、各期睡眠时间及比率、平均血氧饱和度、最低血氧饱和度、血氧低于90%的比例、呼吸暂停最长持续时间、觉醒次数、自发相关微觉醒、腿动相关微觉醒、周期性腿动相关微觉醒、脑梗死发病至入院时间、OCSP分型、病灶部位无显著相关性。

表3 3组睡眠结构比较
2.5 脑梗死预后与各项临床指标之间的Logistic回归分析结果 先进行单因素分析,结果显示3个月预后良好101例(91.8%),预后不良9例(8.2%),3个月预后良好患者受教育时间[10.00(6.00~12.00)年 vs 4.50(2.25~7.50)年,P=0.017]、入院时NIHSS评分[2.00(1.00~3.00)vs 5.00(3.00~10.50),P=0.001]、BMI[25.60(23.50~27.85)kg/m2vs 28.60(26.75~30.90)kg/m2,P=0.006]、REM-AHI[10.80(0.80~34.40)vs 26.60(15.50~50.40),P=0.046]、睡眠潜伏期[10.50(4.00~30.75)min vs 1.00(0~27.25)min,P=0.023]的影响。将上述单因素分析有相关性的临床指标纳入Logistic回归分析,结果显示入院时NIHSS评分(OR 1.655,95%CI 1.114~2.459,P=0.013)、受教育时间(OR 0.564,95%CI 0.357~0.892,P=0.014)和BMI(OR 1.586,95%CI 1.058~2.376,P=0.025)是脑梗死患者不良预后的独立危险因素。
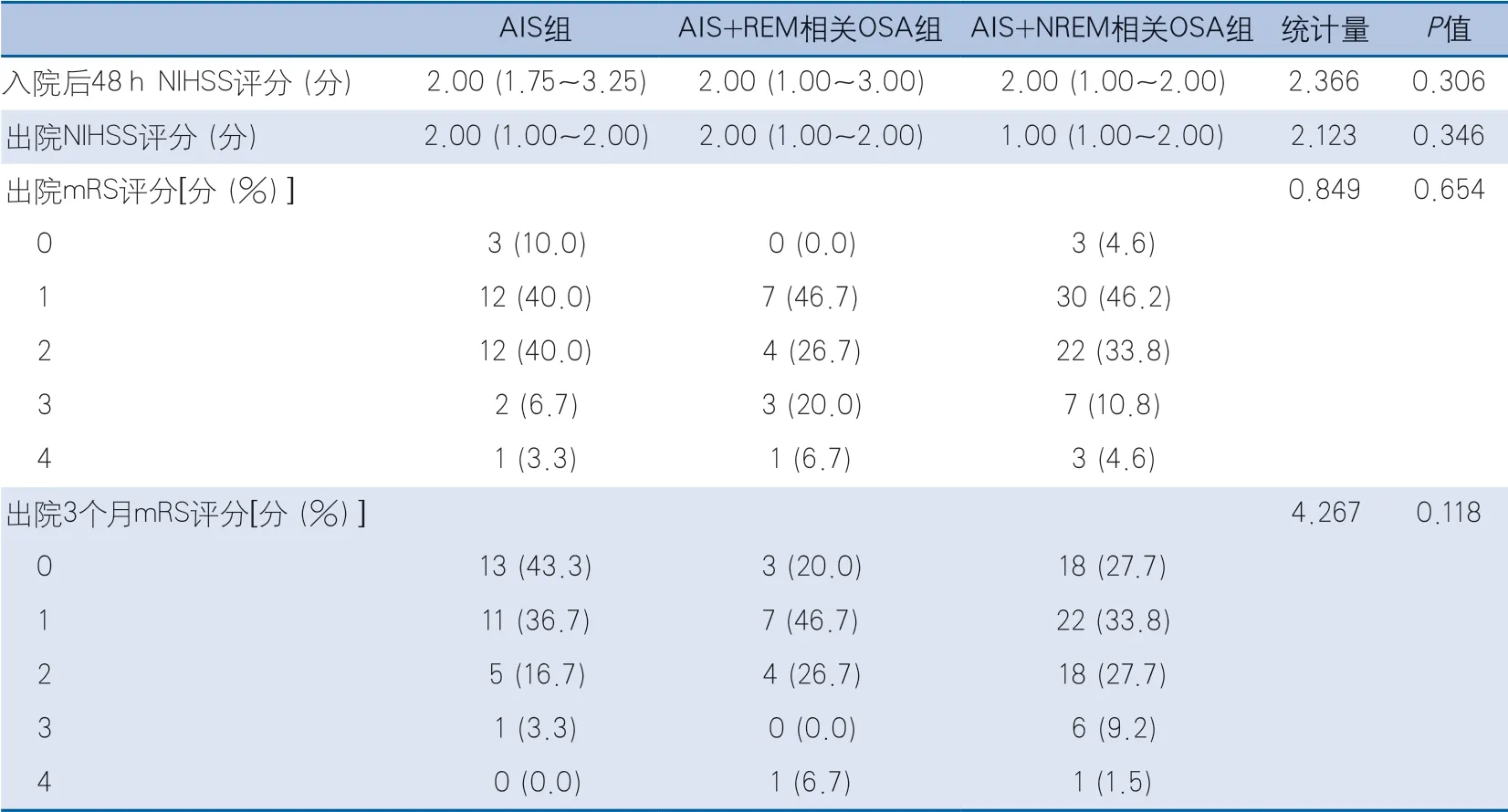
表4 3组脑梗死发病及预后情况比较
3 讨论
本研究110例脑梗死患者OSA发生率为72.7%,与既往研究相符[1]。但并非所有合并OSA的脑梗死患者都有特征性的OSA临床表现,如肥胖、日间嗜睡等,这可能导致OSA的临床检出率和治疗率偏低[9]。
多项研究发现,脑梗死患者易出现睡眠结构紊乱、昼夜节律障碍等一系列睡眠问题。目前针对脑梗死患者睡眠结构的研究发现,额叶梗死引起深睡眠缩短,颞叶病灶主要影响NREM2期和REM期睡眠,脑桥病灶影响REM期睡眠,丘脑病灶可引起患者NREM1期延长、SWS缩短[10-12]。并有研究发现REM潜伏期与脑梗死患者预后相关[13]。合并OSA的脑梗死患者睡眠结构亦不同于单纯脑梗死患者,其浅睡眠l期延长、深睡眠缩短,但较少有对合并REM期和NREM期相关OSA的脑梗死患者睡眠结构的研究[5]。本研究发现,合并REM期相关OSA的脑梗死患者与单纯脑梗死患者相比,睡眠结构无明显变化,但合并NREM期相关OSA的脑梗死患者具有更高的BMI指数,浅睡眠1期延长,深睡眠缩短,与合并OSA的脑梗死患者睡眠特点相同,提示OSA引起的脑梗死患者睡眠结构变化可能主要是由NREM期引起,而非既往研究重点关注的REM期。REM期只占总睡眠时间的一小部分,而且NREM期丘脑与皮质传入减少可能引起觉醒阈值升高,导致患者OSA症状更为严重[14]。NREM期不仅存在呼吸暂停和低通气,还存在长时间的呼吸道部分阻塞,虽然呼吸道部分阻塞不足以造成呼吸暂停或低通气,但其对脑梗死患者睡眠结构和预后的影响目前还缺乏相关研究[15]。
脑梗死患者睡眠的另一特点是睡眠碎片化,PSG表现为觉醒指数增高,睡眠碎片化又与老年人动脉粥样硬化和皮质下梗死密切相关[16-17]。本研究发现合并NREM期相关OSA的脑梗死患者睡眠碎片化比合并REM期相关OSA的脑梗死患者更严重,前者梗死部位集中于大脑半球,但本研究未将梗死病灶分为皮质或皮质下病灶,有待今后进一步研究。此外,在脑梗死预后的相关性分析中,呼吸相关微觉醒指数,尤其是NREM呼吸相关微觉醒指数与脑梗死患者出院3个月mRS评分正相关,这更说明了OSA对脑梗死患者预后的影响可能更多是由于NREM期所致。在大鼠的研究显示睡眠剥夺会增加脑梗死鼠的梗死面积并加重脑梗死鼠的预后[18-19]。而脑梗死前睡眠剥夺对脑梗死是一种保护性因素,猜测可能是因为梗死前睡眠剥夺在停止后睡眠时间延长,尤其是SWS延长,有助于脑梗死的恢复所致,机制可能包括睡眠剥夺减轻炎症反应及缺血性细胞凋亡、并促使神经胶质细胞分泌炎症因子减少等有关[20-23]。故NREM期脑梗死患者微觉醒增多导致睡眠碎片化不利于脑梗死患者恢复,从而导致患者预后较差。
既往研究显示脑梗死的病灶部位和OSA之间并无明显相关性[24]。但本研究发现合并REM期相关OSA的脑梗死患者梗死病灶多位于脑干。脑干是REM期睡眠的发生部位,其中延髓腹侧γ-氨基丁酸能神经元在REM期睡眠的起始和维持起重要作用,兴奋性谷氨酸能神经元能抑制REM期睡眠,促进NREM期睡眠[25-26]。OSA是由气道解剖性因素和上气道神经肌张力异常共同造成,脑干舌下神经周围的中间神经元可以通过调节时相依赖性去甲肾上腺素和5-羟色胺而控制舌下运动神经元的兴奋性,脑干病变时可能导致REM期上气道神经肌张力下降而促进了OSA发生,舌下神经中间神经元群体可能成为未来睡眠呼吸疾病治疗的新靶点[27-29]。
本研究未观察到REM期与NREM期相关OSA与脑梗死患者预后的差异,这可能与本研究需完成相关量表测评及PSG检查,需要患者较高的配合度,故入组的脑梗死患者以轻型卒中(89.1%)为主有关,患者发病时NIHSS评分及mRS评分均偏低,3个月后临床症状改善可能不足以引起评分改变。且本研究随访时间较短,仍需更长时间的随访以明确患者神经功能的恢复情况及有无心脑血管事件再发。此外,流行病学研究发现NREM期相关OSA患者男性占比高,本研究纳入的男性患者占83.6%,REM期相关OSA患者占所有OSA患者的18.8%,低于在非脑梗死人群中报道的32.9%~36.7%[8,30-31]。但本研究未发现男性和女性在REM期相关OSA发病率的差异,与既往研究相符,也未发现性别与脑梗死预后的相关性[8]。
在Logistic回归分析中,入院时NIHSS评分、受教育时间和BMI是影响脑梗死患者预后的独立危险因素。入院时NIHSS评分较高的患者入院时神经功能缺损症状更严重,预后较差。既往有研究发现受教育程度低的患者脑梗死发病率高,但与其3个月后的生活质量无明显相关性[32-33]。本研究发现,受教育程度高的脑梗死患者预后较好,可能是因为高学历患者依从性更好,能配合进行规范卒中二级预防和康复训练,而受教育程度较低的患者可能同时会存在理解和执行功能障碍,对其二级预防的依从性及康复训练造成一定的影响,从而影响脑梗死患者功能预后。目前关于脑梗死与BMI的研究存在不一致的结论,BMI升高会增加脑梗死的发病率,加重缺血损伤[34-35]。但也有研究指出,脑梗死患者日常生活的独立性与其基线活动习惯相关而并非BMI,高BMI甚至可能是脑梗死患者全因死亡和卒中再发的一项保护性因素,此种现象被称为“肥胖悖论”,其机制目前未被完全阐明,可能的机制是肥胖患者对慢性炎性反应产生耐受,在脑梗死发生时所产生的炎性损伤较正常体重患者小[36-38]。
本研究仍有一些不足之处,除上述入组患者多是轻型卒中、性别比例不平衡和随访时间偏短外,样本量也有待扩充。本研究为回顾性研究,患者进行PSG检测时间跨度过长,混杂因素难以控制。关于合并不同睡眠时相OSA的脑梗死患者短期预后情况及预后是否获益于睡眠干预仍需进一步研究加以明确。
【点睛】本研究对合并REM期及NREM期脑梗死患者的睡眠结构及预后进行了分析,结果显示NREM期相关OSA会改变脑梗死患者的睡眠结构,使其浅睡眠1期延长,深睡眠缩短,睡眠片段化,此种改变可能会导致脑梗死患者预后更差。
