单极纺锤体蛋白激酶1对骨肉瘤细胞植入裸鼠肿瘤生长的影响▲
2019-06-19卓航宇贺玉棚陈金忠谢克恭唐毓金
卓航宇 贺玉棚 陆 潞 杨 埜 陈金忠 谢克恭 刘 佳 黄 可 唐毓金
(1 右江民族医学院研究生学院,广西百色市 533000,电子邮箱:lcyxdc@163.com;2 右江民族医学院附属医院脊柱骨病外科,广西百色市 533000)
骨肉瘤在各年龄段均可发病,但原发性高度恶性骨肉瘤主要见于10~20岁的人群。高度恶性骨肉瘤发生于髓腔,可以穿破骨皮质并形成软组织肿块,恶性程度高,易复发及转移[1],给患者的生理、心理造成严重打击,并给家庭带来了巨大的经济负担。大剂量非靶向的化疗药物具有较大的毒副作用,以及原发性、继发性的耐药性,而新辅助化疗手段具有一定的局限性,因此这些抗肿瘤手段的治疗效果不理想[2-3]。随着分子生物学的发展,有学者发现基因的突变性介导骨肉瘤的发生、发展及转移过程[4]。
细胞周期中,细胞有丝分裂的过程可分为前期、前中期、中期、后期和末期。细胞有丝分裂的前中期有纺锤体组装检查点(spindle assembly checkpoint,SAC),其对细胞的有丝分裂起重要的调控作用,当纺锤体未能正确捕捉染色体并将其排列到有丝分裂中期板上时,被激活的SAC将会阻滞有丝分裂中期到后期的启动过程,从而防止细胞错误的分裂及非整倍体的产生[5]。非整倍体对肿瘤细胞的产生具有促进作用,因此SAC可维持细胞遗传信息的稳定性[6]。
单极纺锤体蛋白激酶1(monopolar spindle kinase 1,Mps1)是一个具有双重特异性的蛋白质激酶,可以磷酸化酪氨酸或者丝氨酸/苏氨酸残基[7]。Mps1的主要功能是激活有丝分裂期的SAC和完成中心体的复制,从而有效地阻止有丝分裂期间染色体的错误分离和非整倍性的错误附着[8]。有学者发现,Mps1的功能异常可导致正常的细胞周期失去控制,从而导致各种疾病的发生,而在人类的某些肿瘤疾病中,Mps1的过表达与疾病的不良预后相关[9],通过抑制Mps1的活性,使未附着的染色体在早期退出有丝分裂,致使细胞的染色体错误分离为非整倍体,诱导肿瘤细胞死亡,减少肿瘤的发生[10-11],可能是治疗肿瘤的一个新方向。本研究探讨干预Mps1蛋白的表达对裸鼠骨肉瘤发生发展的影响,现报告如下。
1 材料与方法
1.1 实验细胞、动物及主要试剂
1.1.1 细胞株:人骨肉瘤细胞株143B,购自美国ScienCell研究实验室。
1.1.2 实验动物:无特定病原体级健康Balb/c雌性裸鼠20只,鼠龄4~6周,体质量15~18 g,购自湖南长沙天勤生物技术有限公司,许可证号:SCXK(湘)2014-0011,喂养于严格消毒的无菌层流动物房内,环境温度25℃,空气湿度为60%~70%,饲料和水经严格消毒后自由进食。实验过程中对动物的处置符合2009年《动物实验伦理问题》相关动物伦理学标准的条例并经右江民族医学院动物伦理委员会论证。
1.1.3 主要试剂和仪器:Mps1过表达慢病毒载体pLenti-MPS1-IRES-EGFP及阴性对照病毒液pLenti6.3-NC-EGFP购自Invitrogen公司(批号:RS20141225);杜氏改良伊格尔培养基(Dulbecco′s modified Eagle medium,DMEM)购自Gibco公司(批号:10099-141),胎牛血清购自Gibco公司(批号:1966173C),胰蛋白酶-乙二胺四乙酸(0.25%)含酚红消化液购自Solarbio公司(批号:T1320),磷酸缓冲盐溶液(phosphate-buffered saline,PBS)购自Solarbio公司(批号:P1020-500);兔抗鼠一抗(抗Mps1)购自Abcam公司(批号:ab197382);羊抗兔二抗购自北京中杉金桥生物科技有限公司(批号:ZB-2305);Mps1抑制剂Mps1-IN-3购自MCE公司(批号:HY-12401)。超净工作台、恒温CO2培养箱购自美国Thermo Scientific公司;5424R型低温高速离心机、微量移液枪购自德国Eppendorf公司;IX73倒置荧光显微镜购自日本Olympus公司。
1.2 方法
1.2.1 慢病毒转染143B骨肉瘤细胞及筛选稳定转染细胞株:用含10%胎牛血清的DMEM培养液培养143B骨肉瘤细胞,置于37℃、5% CO2的饱和湿度细胞培养箱。取生长状态良好的对数生长期143B细胞,以3×103个细胞/100 μL接种于96孔板中,于37℃、5% CO2培养箱中培养过夜,待细胞长满至40%~60%时,加入6 mL pLenti-MPS1-IRES-EGFP病毒液转染143B细胞(Mps1过表达组),同时用阴性对照病毒液pLenti6.3-NC-EGFP转染143B细胞作为空病毒载体组,未转染的细胞作为空白对照组。转染72 h后,在白光视野及荧光显微镜下观察各组细胞绿色荧光蛋白的表达情况。取转染后的143B细胞以3×103个细胞/100 μL接种于96孔板中,细胞铺板24 h后,根据前期实验,加入最佳筛选浓度(0.5 μg/mL)的杀稻瘟菌素,每3 d更换新的含杀稻瘟菌素的完全培养液,连续培养14 d,收集抗性细胞,即为稳定转染Mps1过表达的细胞株。
1.2.2 细胞收集:收集3组稳定转染的对数生长期143B细胞,经胰蛋白酶消化及PBS洗涤后,置于离心机4℃、800 r/min离心3 min,离心2次,弃上清,进行活细胞计数后用无血清的DMEM培养液重悬,制成1×107个/L的细胞悬液,分别装在EP管中,4℃低温保存备用。
1.2.3 裸鼠分组及建立骨肉瘤模型:采用随机数字表法将20只裸鼠分为Mps1过表达组、空病毒载体组、对照组、Mps1抑制组,每组5只。Mps1过表达组注射Mps1过表达143B细胞;空病毒载体组注射空病毒载体转染的143B细胞;对照组和Mps1抑制组注射正常的143B细胞。注射方法:碘酊消毒裸鼠右侧前肢背部皮肤,再用75%乙醇拭去碘酊,用DMEM培养液重悬步骤1.2.2中获得的细胞悬液,用1 mL注射器吸取0.2 mL细胞悬液(约含1×107个细胞),注射于裸鼠右前肢背部,以穿透裸鼠整个皮层但不进入肌层为宜,完成注射后用无菌镊子轻夹1 min,防止细胞悬液从针口处流出。注射7 d后,Mps1抑制组裸鼠腹腔注射2 mg/kg的Mps1抑制剂(由Mps1-IN-3溶于生理盐水制成),0.4 mL/次,Mps1过表达组、空病毒载体组、对照组注射等量的生理盐水,均为2次/周,连续注射5周。
1.3 观察指标 (1)裸鼠体重、肿瘤体积及重量:待裸鼠成瘤后每周用游标卡尺测量肿瘤的长径(a) 、短径(b), 按Carlsson公式[12]计算肿瘤的体积,体积=1/2a×b2。每周记录裸鼠体重。给予Mps1抑制剂5周后,处死各组裸鼠,称量肿瘤的重量。(2)Mps1表达水平:处死裸鼠后,将瘤体组织取出,固定、石蜡包埋后切片,厚度为5 μm,置于附有多聚赖氨酸的载玻片上。常规脱蜡水化后,对组织抗原进行修复。PBS洗涤3次,5次/min,5%牛血清蛋白室温封闭1 h,加入一抗,4 ℃孵育过夜。PBS洗涤3次,5次/min,滴加相应二抗,室温孵育1 h,PBS洗涤3次,5次/min,经PBS洗涤后用辣根过氧化物酶显色、复染、脱水、封固。光学显微镜下观察并拍照,在各组切片的监测区域随机选择3个视野,对Mps1蛋白表达阳性的细胞进行计数,然后计算阳性细胞占视野范围内细胞总数的百分比。(3)苏木精-伊红染色:将各组裸鼠瘤体固定后,石蜡包埋,切片,切片厚度为5 μm,烤片脱蜡后,行苏木精-伊红染色,脱水透明后予以封固。光学显微镜下观察并拍照。
1.4 统计学分析 采用SPSS 19.0软件进行统计学分析。计量资料以(x±s)表示,多组间比较采用单因素方差分析。以P<0.05为差异具有统计学意义。
2 结 果
2.1 Mps1慢病毒转染143B细胞的效果 Mps1过表达组和空病毒载体组表达绿色荧光蛋白的细胞数多于空白对照组,且Mps1过表达组和空病毒载体组转染效率达90%,说明转染成功,可用于裸鼠成瘤实验。见图1。
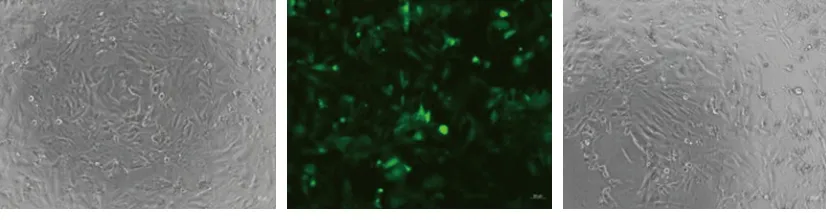
Mps1过表达组(白光) Mps1过表达组(荧光) 空病毒载体组(白光)

空病毒载体组(荧光) 空白对照组(白光) 空白对照组(荧光)
图1 Mps1慢病毒转染143B细胞的效果(×10)
2.2 植入143B细胞后裸鼠生长情况 植入143B细胞系后2~4 d,各组裸鼠接种部位的液包消失,1周左右裸鼠右前肢背部可见皮下小包块,质硬,活动度一般,见图2。随着时间推移各组裸鼠的体重存在差异,见图3。在实验的后期,Mps1过表达组、空病毒载体组和对照组的裸鼠均出现不同程度的恶病质状态,Mps1过表达组最为严重,瘤体可见坏死结痂。
2.3 4组裸鼠肿瘤情况比较 给药第5周时,Mps1过表达组肿瘤体积、重量均大于其他各组,Mps1抑制组肿瘤体积最小,重量最轻(均P<0.05),见表1。给药期早期,Mps1过表达组裸鼠肿瘤体积增长较快,给药后期,其肿瘤体积增长较缓慢;给药期间Mps1抑制组裸鼠肿瘤体积增长缓慢,见图4。解剖瘤体可见瘤体呈灰白鱼肉样,Mps1过表达组的瘤体个体较大,可见部分液化坏死,见图5。

A:植入143B细胞1周后的裸鼠 B:植入143B细胞5周后的裸鼠
图2 对照组植入143B细胞后裸鼠形态
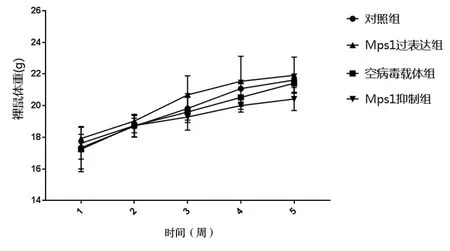
图3 各组裸鼠体重变化曲线

组别n肿瘤体积(mm3)肿瘤重量(g)对照组51678.0±104.1∗#2.1±0.3∗#Mps1过表达组52366.0±299.23.2±0.2空病毒载体组51558.0±146.9∗#2.4±0.3∗#Mps1抑制组5350.8±63.6∗1.0±0.3∗ F值111.41534.456P值<0.001<0.001
注:与Mps1过表达组比较,*P<0.05;与Mps1抑制组比较,#P<0.05。

图4 4组裸鼠肿瘤体积变化曲线

图5 第5周时 4组裸鼠瘤体外观
2.4 4组裸鼠肿瘤组织Mps1表达水平比较 Mps1过表达组瘤体组织的Mps1蛋白表达水平高于其他3组,Mps1抑制组瘤体组织的Mps1蛋白表达水平低于其他3组(均P<0.05),对照组与空病毒载体组Mps1蛋白表达水平差异无统计学意义(P>0.05)。见图6~7。

对照组 Mps1过表达组 空病毒载体组 Mps1抑制组
图6 4组裸鼠瘤体组织Mps1蛋白表达情况(×40)

图7 4组裸鼠瘤体组织Mps1蛋白表达水平比较
2.5 4组裸鼠肿瘤组织苏木精-伊红染色结果 苏木精-伊红染色结果显示,4组裸鼠骨肉瘤组织细胞核大,深染,其中143B细胞形态未见明显差异。见图8。

对照组 Mps1过表达组 空病毒载体组 Mps1抑制组
图8 4组裸鼠肿瘤组织苏木精-伊红染色结果(×40)
3 讨 论
虽然医疗水平不断进步,但近40年来,骨肉瘤患者的长期生存率一直维持在60%~75%[13]。寻找安全有效的靶向性药物对于延长骨肉瘤患者长期生存率具有重要意义。研究表明,Mps1是SAC的必需基因,位于SAC调控通路的上游,对SAC功能的激活和维持有重要作用,是细胞有丝分裂中后期染色体正确排列与分离的关键因子[14-15]。
有研究显示,在乳腺癌、肺癌、胃癌、结肠癌等多种肿瘤组织中Mps1处于高表达水平,Mps1的过表达促进了非整倍体肿瘤的发生发展,且对非整倍体肿瘤细胞具有保护作用[16]。有学者发现,在结肠癌细胞系中,Mps1的过表达可减弱SAC功能,从而促使结肠癌细胞的增殖,而抑制结肠癌细胞系Mps1的表达则可抑制肿瘤细胞的生长[17]。本研究结果显示,Mps1过表达组的裸鼠肿瘤体积以及重量均高于其他3组,而Mps1抑制组裸鼠肿瘤体积及重量均低于其他3组(均P<0.05),这与上述研究结果相似。本研究结果显示,Mps1过表达组裸鼠肿瘤的生长快于其他3组,但在后期,Mps1过表达组裸鼠肿瘤生长速度减缓,且裸鼠出现恶病质状态,剥离解剖瘤体后发现,瘤体的中间部分液化坏死,考虑可能是裸鼠出现恶病质,进而导致自身营养生存状态无法满足瘤体的生长需求,因此瘤体的生长速度减缓且部分坏死。对照组和空载体组肿瘤体积也呈增长趋势,可能与骨肉瘤细胞143B中Mps1表达水平比较高,已经达到适合肿瘤发生发展的水平有关。
近年来,Mps1-IN-1、 Mps1-IN-2等一系列抑制Mps1激酶活性的小分子化合物的研制,为靶向抗肿瘤治疗提供了新思路[18-19]。有学者发现,小型分子Mps1抑制剂能有效抑制乳腺癌细胞系的增殖以及乳腺癌模型裸鼠肿瘤的生长[20]。本研究中,Mps1过表达组瘤体组织Mps1蛋白表达水平升高,而Mps1抑制组采用Mps1-IN-3抑制Mps1的表达后,瘤体组织Mps1蛋白表达水平降低(均P<0.05),骨肉瘤瘤体的生长受到抑制,但是瘤体仍然有微弱的生长趋势,提示瘤体的生长未能被完全抑制,考虑与本研究的给药途径有关。此外,Mps1抑制剂的药物吸收率是否达到完全抑制骨肉瘤生长的要求还不能完全确定;单用Mps1抑制剂对抑制肿瘤生长的效果可能还不理想,如若联合紫杉醇、顺铂等其他抗肿瘤药物是否会获得更好效果,仍需进一步研究。
综上所述,上调Mps1蛋白的表达水平可促进骨肉瘤的发展,而抑制Mps1激酶的活性可抑制骨肉瘤的生长。Mps1或可成为抗肿瘤治疗的新靶点,但Mps1对SAC信号通路的调控作用机制仍需进一步研究。
