一种简易的体外分析肿瘤细胞三维迁移行为的医学研究微装置
2019-06-19伍伦刚彭现其
张 伟,何 婧,伍伦刚,彭现其,李 远
重庆医科大学附属永川医院中心实验室,重庆 402160
肿瘤细胞远端转移是恶性肿瘤患者死亡的首要因素,其转移过程涉及多个环节,包括肿瘤细胞从原位灶剥离、向基底膜内浸润、基底膜内迁移、向毛细血管中内渗、进入系统性循环系统和浸润远端组织[1- 2]。其中,肿瘤细胞浸润并跨过基底膜内的过程称为肿瘤细胞侵袭,是研究肿瘤细胞转移的基础和关键环节。目前,肿瘤细胞侵袭能力体外分析应用最为广泛的是迁移/侵袭小室[3- 4]。分析时,将肿瘤细胞接种在铺有基质胶滤膜的侵袭上室,在下室中加入趋化因子,具有侵袭能力的肿瘤细胞将穿过铺有基质胶的滤膜,通过检测穿过滤膜并黏附在滤膜下表面的细胞数量来量化肿瘤细胞侵袭能力。然而,基于迁移/侵袭小室分析方法为半定量和终点式测量,检测数据的信息含量较少,不能对肿瘤细胞侵袭过程进行动态可视化观测[5]。另一方面,基于微加工技术设计的微流控芯片装置为深入研究肿瘤侵袭行为提供了新的解决方案[6- 8]。例如,宋振等[8]利用微流控芯片技术模拟乳腺癌细胞MDA-MB- 231的3D微环境,并全程监测在肿瘤坏死因子-α浓度梯度诱导下MDA-MB- 231细胞侵袭的全过程;Blaha等[6]通过在微流控细胞迁移模型中加入基质胶原蛋白构建出一个3D薄屏障,动态观察分析乳腺癌细胞MDA-MB- 231浸润过程中肿瘤细胞-内皮细胞间及细胞-ECM蛋白间的相互作用。尽管基于微流控芯片技术的肿瘤细胞体外侵袭模型已取得重要进展,但仍存在一些缺陷。首先是报道采用的微流控芯片加工和微流体操作较为复杂,一定程度上限制其推广应用;其次是当前研究构建的3D屏障较“薄”,研究结果呈现的是肿瘤细胞侵袭的最终结果,而未详细阐述肿瘤细胞在3D基质胶内的迁移行为。本研究报道一种简易的医学研究分析微装置以期更深入地阐明肿瘤细胞在基质胶内的3D迁移行为。利用本装置,本文首次对低侵袭性乳腺癌细胞株MCF- 7的3D迁移过程和行为进行动态追踪和分析,并进一步量化不同化学抑制剂药物对MCF- 7细胞迁移行为的影响。
材料和方法
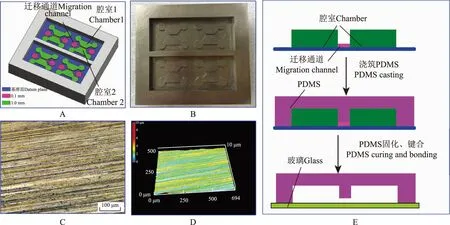
微装置设计和制作肿瘤细胞3D迁移分析微装置基本单元由一个迁移通道和通道两侧腔室组成。其中,迁移通道高0.1 mm,宽1.0 mm;腔室对称分布在迁移通道两侧,高度为1.0 mm,体积约为100 μl。分析装置模具由Solidworks 2016三维建模软件(Dassault Systemes S.A)绘制,由精密模具生产企业外协加工而成。模具三维示意图和实物图如图1A和1B所示。每一个模具含4个结构单元,因此一次制备可获得4个独立的分析微装置。模具表面质量将直接影响分析微装置性能,因此需对其进行质量控制。模具结构单元表面通过激光三维形状显微成像系统(日本基恩士,VK-X150K)进行质量控制,其表面显微形状和3D轮廓图分别如图1C和1D所示,表面粗糙度Ra=(0.47±0.05)μm,符合设计预期要求。分析微装置制作采用微流控芯片软光刻工艺相类似的流程[9],加工流程示意图如图1E所示。如下:首先将聚二甲基硅氧烷(polydimethylsiloxane,PDMS)基质和固化剂按重量10∶1混合而成的预聚物浇铸在不锈钢模具上,抽真空除气泡,60 ℃下固化3 h。将固化后的PDMS基片从模具上剥离,利用平头打孔器(直径5 mm)在迁移通道和腔室两侧打孔形成样品出入口,氧等离子清洗机处理(功率为30 W)1 min后与清洗干净的载玻片进行不可逆键合、封装,形成PDMS-玻璃材质的分析微装置。
细胞培养低侵袭性乳腺癌细胞株MCF- 7由重庆医科大学附属永川医院中心实验室常规保存。常规条件下,MCF- 7用含10%胎牛血清(fetal bovine serum,FBS)、100 U/ml青霉素和100 μg/ml链霉素的RPMI- 1640培养液在37 ℃、5% CO2条件下培养。根据实验设置,在细胞培养过程中分别加入终浓度为5 μmol/L 的基质金属蛋白酶(matrix metalloproteinase,MMP)抑制剂(巴马司他)(碧云天,中国)和20 μmol/L ATP酶抑制剂(Blebbistation)(碧云天,中国)处理12 h作为药物处理组(注:预实验结果显示使用上述两种浓度抑制剂作用MCF- 7细胞12 h不会降低细胞活性,结果未给出)。待细胞生长至对数生长期,用1% 胰酶消化,1500 r/min(转子半径10.4 cm)离心5 min,RPMI- 1640培养液重悬细胞,浓度调整为1×106细胞/ml,待用。
PDMS:聚二甲基硅氧烷
PDMS:polydimethylsiloxane
A.模具三维结构示意图;B.模具照片;C.表面形貌;D.表面三维形貌;E.加工流程示意图
A.3D schematic diagram of the mold structure;B.picture of the mold;C.surface topography;D.three-dimensional surface topography;E.schematic diagram of the processing process
图1肿瘤细胞3D迁移分析微装置的设计和制作
Fig1Design and fabrication of the microdevice for 3D migration analysis of tumor cells
趋化因子浓度梯度表征将预冷的基质胶(BD公司)和RPMI- 1640培养液按1∶1(v/v)冰上混匀后加入微装置迁移通道中。在表面张力作用下,基质胶液体将限制在迁移通道内;将微装置放入37 ℃细胞培养箱中静止1 h待基质胶聚合;将含10 μg/ml异硫氰酸荧光素标记葡聚糖(阿拉丁)(平均相对分子质量 150 000)的PBS溶液或含食用色素的PBS溶液加入一侧腔室中,另一侧加入空白PBS,再次放入37 ℃培养箱中,12 h后取出检测迁移通道和两侧腔室溶液中异硫氰酸荧光素标记葡聚糖和食用色素浓度分布。
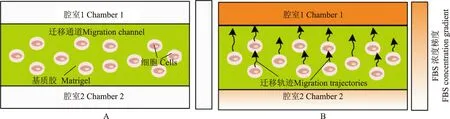
肿瘤细胞3D迁移行为动态监测和量化将预冷基质胶和MCF- 7细胞悬液按1∶1(v/v)冰上混匀后注入迁移通道内,37 ℃培养箱中静止1 h使MCF- 7细胞包埋进聚合的基质胶内;在一侧腔室中加入含化学诱导剂(20% FBS)的RPMI- 1640培养液,另一侧加入空白的RPMI- 1640培养液,诱导MCF- 7细胞发生迁移行为;将上述分析微装置放入37 ℃、5% CO2的细胞培养盒(重庆初生犊科技有限公司,中国),通过活细胞动态成像仪(NanoEnTek,韩国)以30 min/帧速度定时拍摄,记录MCF- 7细胞的迁移过程,实验重复3次。细胞3D迁移行为的动态监测实验示意图如图2所示。
细胞迁移行为通过ImageJ图像处理软件(NIH,美国)对3次重复实验拍摄的序列图像进行量化。迁移速度计算方法如下:首先将图像像素校准为距离,随后将定时拍摄的图像序列以堆栈形式打开,采用ImageJ软件中的“Manual Tracking”插件对单细胞进行跟踪,并将跟踪数据导入Chemotaxis And Migration Tool软件(Ibidi公司,美国)计算单个细胞迁移速度;细胞迁移率(%)为图像视野中的迁移细胞数目/细胞总数×100(注:将迁移速度大于等于3倍无化学诱导剂浓度梯度条件下细胞平均迁移速度的细胞定义为迁移细胞)。
FBS:胎牛血清
FBS:fetal bovine serum
A.细胞加载进迁移微通道;B.加载趋化因子浓度梯度和监测细胞迁移过程
A.loading of cells into the migration microchannel;B.loading of chemokine concentration gradient and monitoring of cell migration process
图2利用微装置进行细胞3D迁移行为分析实验示意图
Fig2Schematic diagram of 3D migration behavior analysis using the microdevice
侵袭小室细胞侵袭实验将200 μl MCF- 7细胞接种在预先涂覆了基质胶的小室内,下室中加入600 μl含20% FBS的RPMI- 1640培养基。37 ℃下培养24 h后擦除上室上面未侵袭细胞和基质胶,将小室底部浸没在0.1%结晶紫细胞染色液30 min,PBS冲洗、晾干,计算6个视野下细胞数量。实验重复3次。
统计学处理采用SPSS 13.0统计学软件,计量资料以均数±标准差表示。多组间均数比较采用单因素方差分析(One-way ANOVA),其中两组之间的比较采用SNK(或q-检验)。P<0.05为差异有统计学意义。
结 果
趋化因子浓度梯度表征待基质胶在分析微装置细胞迁移通道聚合后,即在腔室1中加入含色素或荧光物质的PBS溶液,结果显示色素或荧光物质分布在腔室1内、腔室2内无色素或荧光物质分布,说明迁移通道中基质胶完全聚合,可对两侧腔室内物质进行空间隔离(图3A、3C、3E);加入色素或荧光物质12 h的图像、荧光图像和荧光强度分布曲线结果显示,腔室1内部分色素或荧光物质通过基质胶扩散至腔室2,但两侧腔室内物质浓度仍存在差异,提示该装置能维持物质浓度梯度超过12 h(图3B、3D、3F)。因此,后续细胞3D迁移实验选择12 h作为记录时间。
MCF- 7细胞在基质胶的迁移行为不同诱导剂浓度梯度分布条件下MCF- 7单细胞在基质胶内典型的迁移图像和轨迹显示,MCF- 7细胞沿FBS高浓度方向做定向迁移,且沿FBS高浓度方向的细胞迁移率超过90%(图4A);无FBS浓度梯度存在情况下,MCF- 7细胞无明显迁移行为(图4B);在MCF- 7细胞沿FBS浓度梯度迁移12 h后改变FBS浓度梯度方向,细胞迁移方向也随之改变(图4C)。此外,MCF- 7细胞在整个迁移过程中呈类球形,维持细胞的非极化状态(图4A、4C)。迁移过程中,MCF- 7细胞形态和轮廓呈收缩、伸展交替改变(图4D)。
MCF- 7细胞在基质胶的迁移行为量化分析结果正常情况下,MCF- 7在基质胶内细胞迁移率为(65.5±8.0)%;MMP抑制剂处理后,MCF- 7在基质胶内细胞迁移率为(57.9±14.5)%,差异无统计学意义(t=0.79,P=0.47);ATP酶抑制剂处理显著降低MCF- 7细胞迁移率(t=5.99,P=0.004),为(22.1±9.7)%。无诱导剂浓度梯度条件下,MCF- 7在基质胶内平均迁移速度为0.42 μm/h;存在诱导剂浓度梯度条件下,MCF- 7在基质胶内的迁移平均速度:正常对照组为(8.39±1.27)μm/h;MMP抑制剂处理后MCF- 7 细胞迁移平均速度降低为(7.65±1.53)μm/h,差异有统计学意义(t=3.84,P=0.032);ATP酶抑制剂处理后MCF- 7细胞迁移平均速度进一步降低为(1.76±0.63)μm/h,相比正常对照组和MMP抑制剂处理均显著降低(t=26.12,P<0.01;t=32.81,P<0.01)。
侵袭小室细胞侵袭能力MCF- 7细胞侵袭能力通过传统的侵袭小室进行分析,结果显示正常对照组浸润的MCF- 7数量为24.9±3.44(n=18),MMP抑制剂和ATP酶抑制剂处理均显著降低浸润MCF- 7数量,细胞数量分别为8.8±2.43(n=18)和2.8±1.7(n=18),差异有统计学意义(t=16.2,P<0.01;t=24.5,P<0.01)。此外,ATP酶抑制剂处理后浸润MCF- 7数量显著低于MMP抑制剂处理组(t=8.7,P<0.01)(图5)。
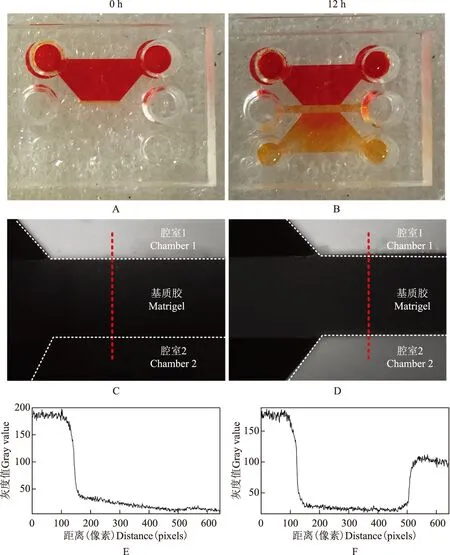
A.0 h图像;B.12 h图像;C.0 h荧光图像;D.12 h荧光图像;E.0 h荧光强度分布曲线;F.12 h荧光强度分布曲线
A.image at 0 hour;B.image at 12 hours;C.fluorescence image at 0 hours;D.fluorescence image at 12 hours;E.fluorescence intensity distribution curve at 0 hour;F.fluorescence intensity distribution curve at 12 hours
图3食用色素和荧光物质在分析微装置内的分布情况
Fig3Distribution of food pigment and fluorescent substance in the microdevice
讨 论
体内肿瘤转移是一个复杂、动态调节的生理病理过程,涉及多环节和多种转移机制,深入研究肿瘤转移过程中不同的环节和机制将有利于发展潜在的肿瘤治疗靶标和手段[10]。其中,肿瘤细胞在3D ECM中的迁移是肿瘤侵袭和转移必经环节[11]。然而,现有的细胞划痕实验和侵袭小室细胞侵袭实验均不能很好地展示肿瘤细胞的3D迁移行为。基于此背景,本研究旨在发展并验证了一种简易的可用于研究肿瘤细胞3D迁移行为的医学研究微装置。该装置能够与活细胞动态观察装置相兼容,实现对肿瘤细胞迁移行为的可视化监测。乳腺癌是女性肿瘤死亡的首要疾病,MCF- 7细胞株具有分化乳腺上皮细胞特征,侵袭能力弱,广泛用于抗乳腺癌药物的作用机制研究[12],而用于研究乳腺癌侵袭转移较少。基质胶来源于移植性小鼠软骨肉瘤ECM,体外细胞培养中广泛用于模拟基底膜微环境。因此,本研究利用发展的微装置首次分析MCF- 7细胞在基质胶内的3D迁移行为,同时对微装置分析性能进行验证。
分析微装置基本单元由一迁移通道和对称分布在通道两侧的腔室组成,便于产生诱导细胞迁移的趋化因子浓度梯度,同时易于对细胞迁移行为进行动态观察。与文献[6- 7]报道的微流控芯片细胞侵袭模型采用的“薄”3D基质胶屏障(宽度:20~100 μm)不同,本装置迁移通道宽1 mm,因此能长时间动态观察肿瘤细胞在3D基底膜中的迁移。同时,两侧对称分布的腔室能够维持趋化因子浓度梯度长达12 h,避免维持趋化因子浓度梯度而进行的频繁换液或连续灌注,简化实验操作。此外,通过精密机械加工而成的微装置模具能长时间使用,不易变形,可保证每次制备的微装置结构一致性。

A.FBS浓度梯度下MCF- 7细胞典型的迁移图像和轨迹;B.无FBS浓度梯度下MCF- 7细胞典型的迁移图像和轨迹;C.改变FBS浓度梯度方向MCF- 7细胞典型的迁移图像和轨迹;D.MCF- 7细胞迁移过程中典型的单细胞形态和轮廓变化
A.typical migration images and trajectories of MCF- 7 cells under FBS concentration gradient;B.typical migration images and trajectories of MCF- 7 cells without FBS concentration gradient;C.typical migration image and trajectory of MCF- 7 cells after changing the FBS concentration gradient direction;D.typical morphological and outline changes of MCF- 7 cells during migration
图4MCF- 7单细胞在基质胶内迁移受FBS浓度梯度分布方向控制
Fig4Migration of MCF- 7 single cells in matrigel was controlled by the direction of FBS concentration gradient distribution

A.正常对照组侵袭细胞染色图像;B.MMP抑制剂处理组侵袭细胞染色图像;C.ATPase抑制剂处理组侵袭细胞染色图像
A.staining image of invaded cells in the normal control group;B.staining image of invaded cells treated with MMP inhibitor;C.staining image of invaded cells treated with ATPase inhibitor
图5侵袭小室分析MCF- 7细胞侵袭能力
Fig5Invasiveness of MCF- 7 cells analyzed by transwell assay
研究显示肿瘤细胞在3D ECM中迁移至少呈现两种不同迁移模式,分别为间质细胞样迁移模式和变形虫样迁移模式[13]。当细胞以间质细胞样模式迁移时,细胞呈拉伸状极化形态,具有片状伪足样突出物。该模式下细胞迁移运动基于路径“产生”机制,即依赖于细胞迁移前沿分泌的细胞外蛋白酶(如MMP)对ECM蛋白水解形成迁移路径[14];相反,当细胞以变形虫样模式迁移时,细胞呈圆形非极化状态,依赖路径“找寻”机制进行移动。该模式下细胞迁移不依赖于细胞分泌的蛋白酶,而是通过细胞表面的疱疹样细胞膜突出物和肌动球蛋白产生收缩挤压力在ECM中移动[14]。利用构建的分析微装置对MCF- 7细胞在基质胶内迁移行为进行分析,结果显示MCF- 7细胞在迁移过程中细胞呈非极化圆形状态,且迁移过程中MCF- 7细胞形态和轮廓呈收缩拉伸交替改变,说明MCF- 7细胞在基质胶内迁移为变形虫样迁移模式,该结果与传统2D环境下通过划痕实验观察到的MCF- 7细胞呈间质细胞样迁移模式存在明显差异,其原因推测与MCF- 7细胞和基质胶间的相互作用力所致。此外,MCF- 7细胞的迁移方向严格受趋化因子(FBS)浓度梯度方向控制,即超过90%的迁移细胞朝向高浓度FBS方向定向迁移。该结果与实验预期相符,说明本研究装置在控制、分析肿瘤细胞3D迁移行为的有效性。
MCF- 7细胞在基质胶内迁移行为进一步通过细胞迁移率和迁移速度进行量化,结果显示正常情况下超过60%的MCF- 7细胞进行了迁移,而部分细胞未呈现明显的迁移运动,说明MCF- 7细胞群体的迁移能力存在异质性。具有迁移能力的MCF- 7细胞的迁移平均速度为(8.39±1.27)μm/h,高于文献[7]报道高侵袭性乳腺癌细胞株MDA-MB- 231在基质胶胶内迁移平均速度7 μm/h。事实上,MDA-MB- 231在基质胶内迁移模式符合间质细胞样迁移模式[7]。因此,MCF- 7细胞迁移平均速度高于MDA-MB- 231迁移平均速度的原因推测有两点:首先,MDA-MB- 231迁移依赖蛋白酶对基质胶水解过程,慢于MCF- 7细胞通过收缩挤压力通过基质胶;其次,迁移过程中MCF- 7细胞的球形形态相比MDA-MB- 231的拉伸形态能最大限度地减少迁移过程中基质胶物理阻力;相比正常对照组,MMP抑制剂处理未能明显降低MCF- 7细胞迁移率和迁移速度,说明MCF- 7细胞的迁移模式为不依赖于MMP的变形虫样迁移模式,同时也部分解释单纯MMP抑制剂药物在抑制肿瘤细胞转移行为的有限治疗效果。ATP酶抑制剂(Blebbistation)是一种细胞通透性非肌肉肌球蛋白Ⅱ型ATP酶抑制剂,研究报道其能抑制肌动蛋白激活的Mg-ATP酶收缩活性和肌球蛋白收缩动力[15]。本研究结果显示ATP酶抑制剂处理显著降低MCF- 7细胞迁移率和迁移平均速度,说明MCF- 7细胞的迁移依赖细胞肌动球蛋白产生收缩挤压力,而ATP酶抑制剂通过抑制肌球蛋白收缩动力从而抑制MCF- 7细胞的变形虫样迁移模式;此外,ATP酶抑制剂处理后MCF- 7细胞迁移率和迁移平均速度显著低于MMP抑制剂处理组,说明针对MCF- 7的迁移模式,ATP酶抑制剂在抑制其迁移行为更为有效,再一次说明研究肿瘤细胞3D迁移行为对于发展肿瘤转移抑制精准治疗的意义。
分析微装置研究结果通过传统的侵袭小室实验进行验证,与分析微装置研究结果不同的是,侵袭小室实验结果显示MMP抑制剂能显著降低抑制MCF- 7细胞的侵袭能力。其原因推测与侵袭小室分析包含了肿瘤细胞向基质胶中浸润、3D迁移和从基质胶中渗出3个步骤,MMP抑制剂可能抑制MCF- 7细胞向基质胶中浸润和从基质胶渗出环节。同时,相比本研究的分析微装置,传统的侵袭小室分析方法仅能量化最终的浸润细胞数量,所获得的数据信息有限,不能深入地研究和阐释肿瘤侵袭各步骤的行为和机制。
本研究仍存在一些不足和需要改进的地方:首先,本研究仅分析了一种乳腺癌细胞株MCF- 7,其他类型乳腺癌细胞的3D迁移行为正在研究中;其次,仅考虑肿瘤细胞在一个平面的迁移,沿深度/高度方向的迁移行为暂未做考虑;第三,仅考虑了基质胶,肿瘤细胞在其他类型的ECM(如胶原蛋白)中迁移行为将在后续实验中进行;第四,本研究仅探讨了肿瘤细胞迁移环节,利用本装置全过程研究肿瘤细胞的侵袭行为(侵袭、迁移和渗出)正在进行。
综上,本研究发展并验证了一种简易的用于体外分析肿瘤细胞在ECM中3D迁移行为的医学研究微装置。结果显示MCF- 7细胞在基质胶中呈变形虫样迁移模式,且MMP抑制剂和ATP酶抑制剂对MCF- 7细胞迁移行为具有不同的抑制能力。本装置操作简单,可精确控制细胞的生化、物理学微环境,未来可用于开展肿瘤细胞3D培养、靶向药物筛选、肿瘤转移机制及转移过程的体外模拟等研究。
