周期性“饥饿-再投喂”对大口黑鲈幼鱼补偿生长的影响
2019-06-19周凡线婷贝亦江阮贇杰柯庆青陈刘浦马文君丁雪燕
周凡,线婷,贝亦江,阮贇杰,柯庆青,陈刘浦,马文君,丁雪燕
(1.浙江省水产技术推广总站,浙江 杭州 310023;2.浙江大学新农村发展研究院,浙江 杭州 310058)
在自然界,鱼类常因食物分布不均、季节变化或环境改变等原因忍受饥饿;不同生长周期的鱼对饥饿的适应和耐受能力不尽相同[1]。饥饿对鱼类补偿生长的影响一直是水产养殖和营养生理研究的热点[2,3]。在渔业生产中,确定合理的投喂策略,利用鱼类饥饿后的补偿生长规律提高饲料利用率,有效降低饲料系数,改善养殖水体水质,获得更佳的养殖效益,是构建鱼类生态高效养殖技术体系的重要内容之一。
大口黑鲈Micropterus salmoides俗称加州鲈,隶属鲈形目Perciformes、太阳鱼科Cehtrachidae、黑鲈属Micropterus,原产于北美洲,于20世纪80年代被引入我国养殖。大口黑鲈营养丰富、肉质鲜美、价格稳定,适宜集约化养殖。2017年全国大口黑鲈养殖产量45.69万t,排名前三的广东、浙江和江苏等三省总产量占全国产量的80%[4]。大口黑鲈为浙江省“十三五”渔业主推鱼类之一,养殖规模迅速扩大,据不完全统计,2018年全省养殖面积已突破3.33×103ha,产量约6万t,是目前最具养殖前景、深受市场欢迎的淡水经济鱼类之一。大口黑鲈养殖的饲料成本占总成本的60%以上,开展科学养殖,尤其是合理投喂,对大口黑鲈产业的提质增效具有重要意义。本试验通过研究大口黑鲈循环饥饿后的补偿生长及生理生化指标,以期为建立一种能够减轻劳动力强度、降低养殖成本、提高饲料效率的大口黑鲈科学投喂策略提供参考。
1 材料与方法
1.1 材料
试验原料由浙江万成生物科技有限公司(浙江·杭州)提供,膨化饲料由浙江联盛饲料科技有限公司(浙江·德清)协助生产。试验饲料以进口白鱼粉、大豆类蛋白(去皮豆粕、大豆浓缩蛋白、发酵豆粕)等为主要蛋白源,以鱼油、豆油等为主要脂肪源,配制成粗蛋白质含量为45.3%、粗脂肪为9.3%、蛋白能量比39.2mg/KJ、粗灰分为12.6%、钙为2.1%、磷为1.9%,赖氨酸为3.4%的膨化颗粒饲料。
试验用大口黑鲈约为7周龄、1 000尾从浙江省水产技术推广总站萧山基地引入。养殖用水为经过沉淀、沙滤处理后的淡水。
1.2 方法
养殖试验在浙江省水产技术推广总站西坝试验基地采光大棚内的30m2水泥池中进行。水泥池水深1m,24h连续充气。养殖期间水温(26.5±1.2)℃,pH(6.8±0.1),溶氧≥5 mg/L。
试验鱼暂养2周后,选择规格一致、健康无病、初始体质量(45.70±0.56)g的幼鱼480尾,分成4组,每组3个重复,每池放40尾鱼。采用单因素实验设计。D0组每天上午8时和下午16时饱食饲喂2次;D1组每周投喂6d后停喂1d;D2组每周投喂5d后停喂2d;D3组每周投喂4d后停喂3d。每周视情况换水30~50cm,清刷池壁与池底。每天记录投喂量与存活率。循环“饥饿-再投喂”试验养殖8周。
1.3 采样与分析
试验开始前从暂养鱼中随机取3组鱼(每组5尾),保存在-20℃冰箱中用于测定初始体组成。试验结束时停喂24h后,将每个水泥池内的鱼全部捕出成群称量。再从每个水池中随机取5尾鱼,测量体质量、体长和肝质量,-20℃保存。根据AOAC方法[5]分析试验饲料及各组鱼的水分、粗蛋白、粗脂肪和灰分含量。
从各池随机采9尾鱼,用80mg/L三氯叔丁醇麻醉后,尾静脉取血,用氟化钠-草酸钾(2%氟化钠+4%草酸钾)抗凝。血液样本以6 000r/min离心10min后收集血清;每3尾鱼的血清合并为一个样本保存于-80℃冰箱中,用南京建成生物工程研究所试剂盒测定血清的总蛋白(A045-2考马斯亮蓝法)、甘油三酯(A110-2 GPO-PAP法)、总胆固醇(A111-2 GPO-PAP法)和葡萄糖含量(F006)、谷草转氨酶(C010-2)和谷丙转氨酶(C009-2)活性,以及生长激素(H091)和类胰岛素生长因子-I(IGF-I ELISAKit)的水平。
每池再随机取5尾鱼,置冰盘毁髓处死,解剖分离胃和肠道,剔除消化道内容物及肠系膜,用去离子水冲洗干净,剪成小块。按样品质量的9倍加入预冷去离子水配制成的缓冲液,在高速组织匀浆机中冰浴匀浆。10 000 r/min离心30min后,取上清液置于4℃冰箱中保存。用南京建成生物工程研究所试剂盒检测胃和前肠的蛋白酶(A080-1、A080-2)、脂肪酶(A054-1)和淀粉酶(C016-2)活性。24h内检测完毕。
1.4 数据处理与统计
试验数据以平均值±标准误(Mean±SE)表示,用SPSS 16.0软件进行单因素方差分析(One-way ANOVA),用Turkey's多重比较法检验组间差异的显著性,P<0.05为差异显著。
2 结果与分析
8周的饲养结果表明,四组大口黑鲈存活率为94.17%~98.33%,无显著差异(P>0.05)(表 1)。D0 组的大口黑鲈肥满度显著高于除D1组以外的其他两组(P<0.05),其他三个组肥满度略有下降,但无显著差异(P>0.05)。D2和D3组大口黑鲈肝体比小于D0组,D3组肝体比显著小于 D1组(P<0.05),其他各组差异不显著(P>0.05)。从表1可知,随着饥饿天数的增加,大口黑鲈的末体质量、增重率和特定生长率呈不同程度的下降,D3组的生长指标均显著低于其他各组(P<0.05);D2组的生长指标显著低于D0组(P<0.05),但和 D1组无显著差异(P>0.05);D1组的生长与D0组显著不差异(P>0.05)。根据各组的实际投喂天数(分别为56d、49d、42d和35d)计算,特定生长率随着饥饿时间的增加而显著增加(P>0.05)。
各组大口黑鲈的日摄食量随每周饥饿时间的增加而显著提高(P<0.05),但各组间的总摄食量无显著差异(P>0.05);饲料系数(FCR)也随之显著增加,D3组的 FCR 显著高于 D0和 D1组(P<0.05),D1组显著低于D2和D3组(P<0.05),但与D1组无显著差异(P>0.05);D0和D3组的蛋白质效率最高和最低(P<0.05),D1组显著高于 D3组(P<0.05),但与 D0和 D2组差异不显著(P>0.05)(表 1)。
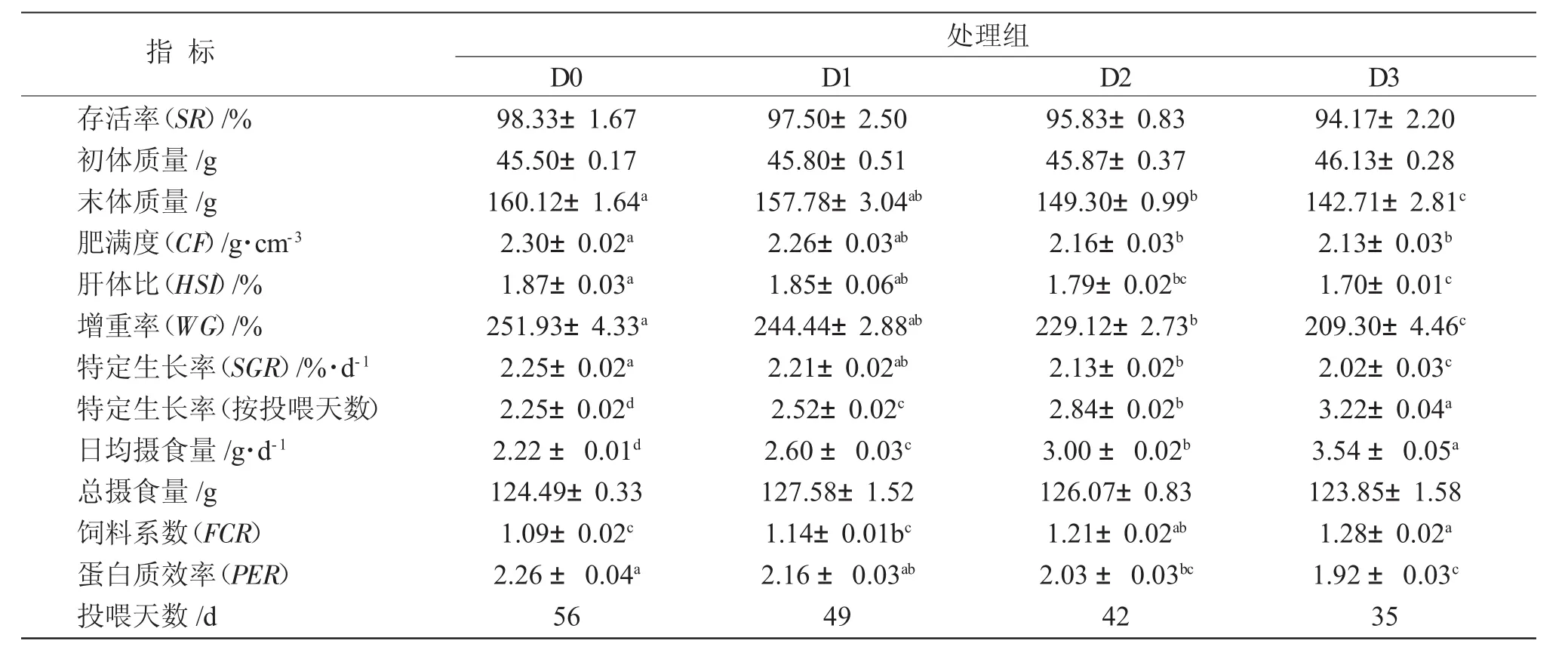
表1 不同“饥饿-再投喂”循环对大口黑鲈生长性能和饲料利用的影响Tab.1 The effects of different cyclic starvation-refeeding on growth performance and feed efficiency of largemouth bass Micropterus salmoides
由表2可知,不同饥饿-投喂循环处理下大口黑鲈全鱼体水分含量上升,但无统计学差异(P>0.05)。D0、D1和D2组的全鱼体粗蛋白含量差异不显著(P>0.05),但D0和D1组显著高于D3组及初始试验鱼(P<0.05)。D0组鱼体粗脂肪显著高于D3组和初始鱼(P<0.05),其余各组间无显著差异(P>0.05)。D3组鱼体粗灰分含量最高,显著高于D0组(P<0.05),D0、D1和D2组的鱼体粗灰分含量无显著差异(P>0.05)(表 2)。
由表3可知,不同投喂策略显著影响大口黑鲈胃和肠道消化酶的活性。D3组试验鱼的胃蛋白酶活性显著低于其他各组(P<0.05),其余各组之间无显著差异(P>0.05)。D1组和D3组胃脂肪酶活性最高和最低(P<0.05)。D1组和D2淀粉酶活性显著高于 D0和 D3组(P<0.05),而 D1与 D2组,以及 D0与D3组间淀粉酶活性无显著差异(P>0.05)。肠道蛋白酶活性随着饥饿时间的延长而下降,D0组酶活性显著高于D2和D3组(P<0.05);D1组则显著高于D3组,但与D0和D2组之间无统计学差异(P>0.05)。D1组鱼肠道脂肪酶活性最高,显著高于除D0组以外的另外两组(P<0.05)。D0和D3组肠道淀粉酶活性最低和最高(P<0.05),D1和D2组间无显著差异(P>0.05)(表 3)。
不同的饥饿-投喂循环处理对大口黑鲈血液生化指标影响有所不同(表4)。其中,血清总蛋白、葡萄糖含量等指标较为稳定,未受投喂循环的影响(P<0.05)。D0组和D1组鱼血清甘油三酯含量较高,显著高于D2和D3组(P<0.05);D1组总胆固醇含量显著高于其他三组(P<0.05),其他各组间差异不显著(P>0.05)。试验鱼血清谷草转氨酶和谷丙转氨酶活性随饥饿时间的延长而上升,D3组最高,显著高于D0组(P<0.05)。从表4可知,D3组的血清生长激素水平显著高于其他各组(P<0.05),D0组显著低于D2组(P<0.05)。D0组和D3组鱼血清类胰岛素生长因子-I水平最高和最低(P<0.05),D3组显著低于D1组(P<0.05),D2组与其他三组差异不显著(P>0.05)。
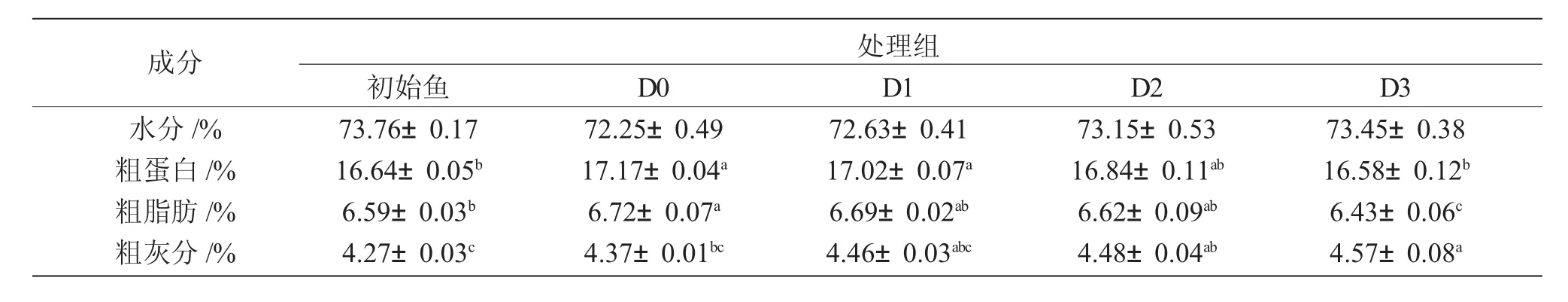
表2 不同的“饥饿-再投喂”循环对大口黑鲈全鱼体组成的影响Tab.2 The effects of different cyclic starvation-refeeding on whole body composition of largemouth bass M.salmoides
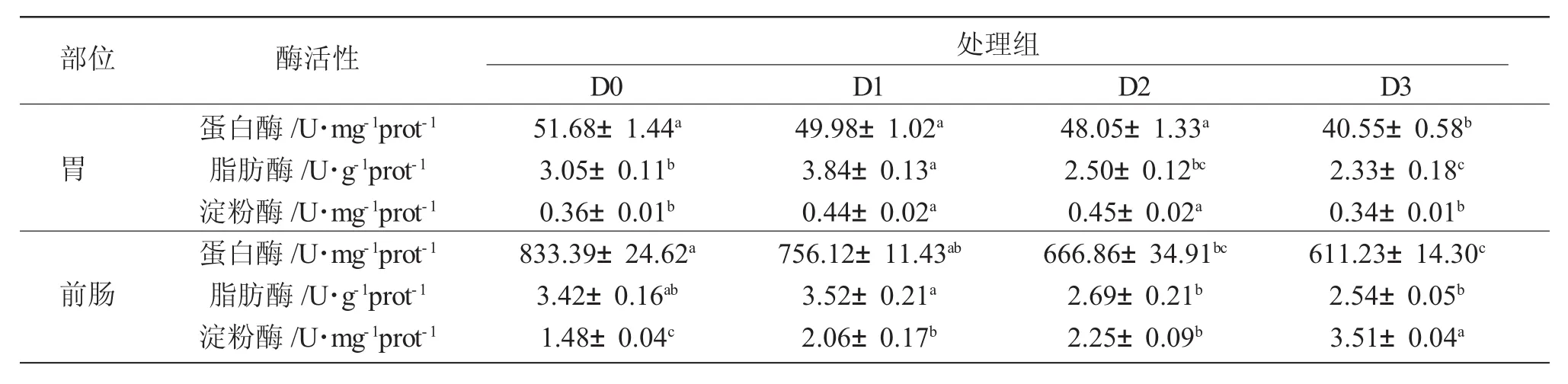
表3 不同的“饥饿-再投喂”循环对大口黑鲈胃和前肠消化酶活性的影响Tab.3 The effects of different cyclic starvation-refeeding on digestive enzyme activities in stomach and foregut of largemouth bass M.salmoides
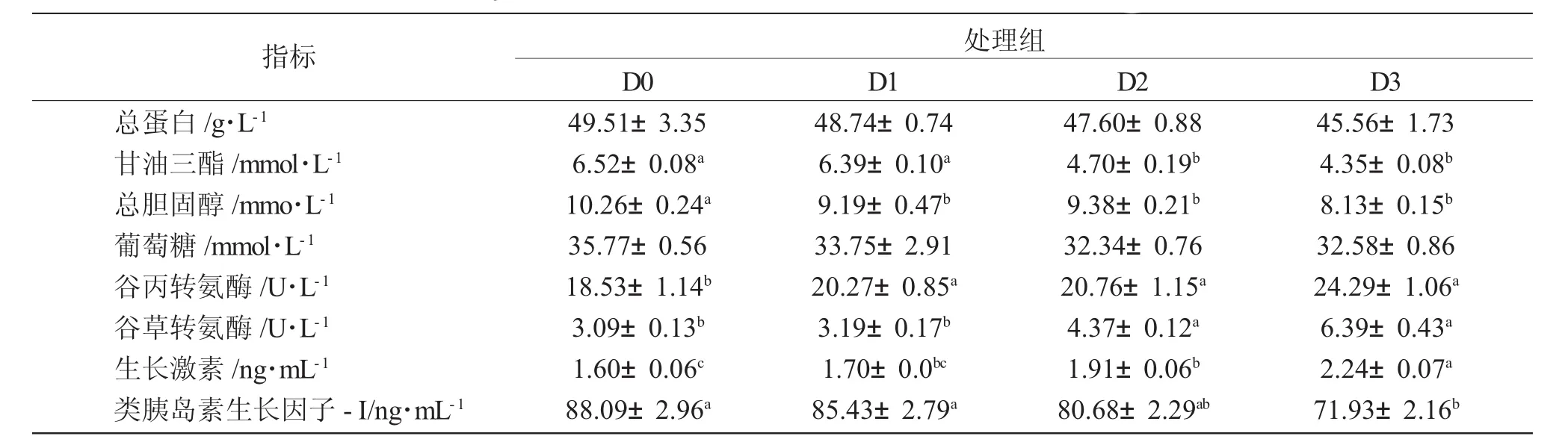
表4 不同的“饥饿-再投喂”循环对大口黑鲈血液生化指标的影响Tab.4 The effects of different cyclic starvation-refeeding on serum parameters of largemouth bass M.salmoides
3 讨论
研究表明,鱼类在恢复投喂期间的补偿生长可分为四种:超补偿生长、完全补偿生长、部分补偿生长和不能补偿生长[3,6]。超补偿生长指饥饿后恢复投喂鱼体质量明显高于正常投喂鱼;完全补偿生长指末体质量与正常投喂鱼无显著差异;部分补偿生长指鱼体继饥饿恢复投喂期间生长率与正常投喂鱼差异不明显,但末体质量仍显著下降;不能补偿生长指饥饿处理显著降低了鱼的生长性能,并一定程度损害鱼的生理机能。本试验中,每周饥饿1d的大口黑鲈终末体质量、生长速率与全程投喂的对照组没有显著差异,呈完全补偿生长。每周饥饿2d或3d的大口黑鲈,虽然在饥饿恢复投喂期内的特定生长率高于对照组,但终末体质量以及增重率依然显著低于对照组,表现出部分补偿生长。本试验发现,各饥饿处理组的日均摄食率显著高于对照组,但各组间总摄食量并无显著差异,D2和D3组的饲料转化率和蛋白质效率显著低于对照组,而D1组的饲料系数和对照组没有显著差异。由此推测,饥饿时间和饲料转化率是大口黑鲈饥饿后再投喂过程中补偿生长效应的关键因素;这与对花鲈Lateolabrax japonicus[7]、尼罗罗非鱼 Oreochromis niloticus[8]、豹纹鳃棘鲈Plectropomus leopardus[9]等鱼类的研究结果相似。
鱼类面对饥饿或食物不足等营养限制时,需利用体内贮存的碳水化合物、脂肪和蛋白质来提供能量[10,11];通常鱼类先消耗脂肪和糖原,最终再利用蛋白质作为能量来弥补生长发育之需[12]。本试验结束时观察到,D2和D3组的大口黑鲈全鱼粗蛋白质和粗脂肪含量均显著低于对照组,全鱼粗灰分含量有所增加,表明每周饥饿时间的增加使大口黑鲈消耗体脂肪和蛋白;饥饿期间体蛋白分解代谢强于合成代谢也可能是原因之一[13,14]。类似的结果在舌齿鲈Dicentrarchus labrax[15]、吉富罗非鱼Oreochromis niloticus[16]、鲟 Acipenser persicus[17]、半滑舌鳎Cynoglossus semilaevis[18]的研究中也有报道。鱼的肥满度、肝体指数的变化在一定程度上可以反映鱼体在饥饿与恢复投喂状态下自身营养物质的消耗与积累。对瓦氏黄颡鱼Pelteobagrus vachelli[19]、金头鲷Sparus aurata[20]、许氏平Sebastes schlegelis[1]等鱼类的研究发现,在饥饿期间试验鱼的肥满度和肝体指数显著降低,恢复投喂后能快速恢复到对照组水平;但尼罗罗非鱼[21]、黑鲷Acanthopagrus schlegelii[22]等恢复投喂后形体学指标依然显著下降。这表明不同鱼类对饥饿的适应能力和耐受水平不尽相同,推测大口黑鲈在恢复投喂期间,优先利用肝胰脏中贮存的脂肪和糖原作为能源,随着饥饿时间的延长,体储存蛋白也被动用。
消化酶活力的变化是鱼的营养状态和代谢水平变化的重要指标[23]。经过饥饿的花鲈蛋白酶活力明显下降[7];史氏鲟Acipenser schrenckii的蛋白酶、淀粉酶和脂肪酶活力也都明显下降[24]。鱼类受到饥饿胁迫时,利用体内贮藏的营养物质的优先顺序不同,不同的酶在受到不同程度的饥饿处理时活性也不同。本研究中,大口黑鲈的胃和肠道的蛋白酶、脂肪酶的活性随着禁食时间的延长而下降,但淀粉酶活性则有所上升。其原因可能是鱼类在饥饿前期所表现的应激反应,短暂的饥饿促使鱼体自身淀粉酶分泌量增加,吸收和利用消化道内残余的食物,以维持正常的生命活动。在窄糠虾Leptomysis lingvura[25]和杂交鲟(Huso dauricus♀×Acipenser schrenckii♂)[26]的饥饿胁迫试验中,同样观察到淀粉酶大幅度上升然后再下降的过程。
胆固醇为调节糖类、脂肪和蛋白质代谢重要激素的前体物质,其含量升高具有促进代谢、加快生长的积极作用;胆固醇也参与新细胞合成,甘油三酯则可被机体运送到组织中合成脂类存储。饥饿处理后花鲈[27]、乌鳢 Ophiocephalus argus Cantor[28]、菊黄东方鲀Takifugu flavidus[29]血清中胆固醇和甘油三酯含量下降,这与本研究的结果相似。血清中甘油三酯和胆固醇含量下降的原因可能是饥饿时机体内营养物质得不到及时补充,无法有效合成或合成的数量减少;也可能是因为饥饿时机体无法从外界获取能量,只能消耗自身储存的能量维持基础代谢。在正常情况下,转氨酶主要存在于肝脏中,但在肝细胞受损时,转氨酶会释放到血液中,血清转氨酶活性升高可反映鱼体肝脏健康状态[30,31]。本试验中,饥饿的大口黑鲈血清谷丙转氨酶和谷草转氨酶活性明显增加,每周饥饿2d或3d,两项指标均显著高于对照组,这可能与饥饿期间大口黑鲈体内能量代谢的转变有关。金一春等[32]研究发现,白斑狗鱼Esox lucius的肝糖元含量随饥饿程度的延长而下降,分解作用增强使肝糖元降低的同时也一定程度损伤肝脏功能。
鱼类在遭受营养不足或饥饿胁迫时,体内生长激素(GH)/生长激素受体(GHR)/类胰岛素生长因子-(IIGF-I)轴快速进行反馈调节[33]。研究发现,饥饿过程中鱼类血液GH水平升高、IGF-I水平下降是一种较为普遍的现象。如大鳞大麻哈鱼Oncorhynchus tshawytscha[34]、斑点叉尾Ictalurus punctatus[35]、异育银鲫 Carassius auratus gibelio[36]、尼罗罗非鱼[21]以及本试验的大口黑鲈中,均观察到相似的变化趋势。Ayson等[37]指出,鱼血液中GH水平升高抑制了肝脏GHR基因表达,导致GHR与GH结合能力下降,造成肝脏IGF-I合成能力下降,释放到血清中的IGF-I水平也随之下降。生长相关基因在转录水平的变化可能是决定血清中激素含量的重要因素[17]。大口黑鲈GH/GHR/IGF-I轴在饥饿期间的变化也反馈在其表观生长性能的相关指标上,具体调控机制还有待进一步研究。
综上所述,本研究表明大口黑鲈在周期性“饥饿-饱食”的循环喂养模式下,每周饥饿1d可以实现补偿生长。在大口黑鲈养殖中可根据鱼的生长率和饲料转化率的变化规律制定投喂策略,实现节约饲料和劳动力成本,优化投入产出比,取得最佳的养殖效益。
