乳腺癌合并甲状腺癌的调查分析(附80例报告)
2019-06-18吕加令李涛
吕加令 李涛
(曲靖市第一人民医院肿瘤科,云南 曲靖 655000)
有报道[1]指出,乳腺与甲状腺多原发癌患病率呈逐年递增趋势,多原发癌即同一个器官或不同器官先后或同时出现两种或以上原发性恶性肿瘤。因乳腺癌与甲状腺癌发病机制较复杂,且以女性为主,二者同时作为激素反应性器官,受到下丘脑-垂体-腺体轴调节,故内分泌的变化及其他因素的影响均可导致二者同时或先后发病[2-3]。本文主要分析乳腺癌合并甲状腺癌患者临床资料,旨在探讨乳腺癌合并甲状腺癌的临床特点,以期为多原发癌的防治提供理论依据。
1 资料与方法
1.1 一般资料 采用回顾性分析的方法,收集XX地区2012年3月至2018年3月确诊的80例乳腺癌合并甲状腺癌患者作为研究对象,分为B1T组(乳腺癌后甲状腺癌,n=28)、T1B组(甲状腺癌后乳腺癌,n=36)及BT组(同时检出乳腺癌与甲状腺癌,n=16)。收集同期确诊的50例单纯乳腺癌患者作为oB组,单纯甲状腺癌患者50例作为oT组。纳入标准:(1)B1T组及T1B组:经病理诊断证实为乳腺癌或甲状腺癌,后经穿刺病理诊断、术中冰冻病理诊断或术后石蜡病理检查确诊为甲状腺癌或乳腺癌,两种癌症发病时间>6个月;(2)BT组:接受穿刺病理诊断、术中冰冻病理检查或术后石蜡病理检查确诊为甲状腺癌与乳腺癌,二者发病间隔时间≤6个月;(3)oB组:病理诊断证实为乳腺癌,同期经相关辅助检查未发现甲状腺癌;(5)oT组:经病理诊断证实为甲状腺癌,同期经相关辅助检查未发现乳腺癌。已排除合并其他恶性肿瘤疾病、肿瘤属于继发转移、临床资料不完整、疾病属于复发癌、远处转移至甲状腺或乳腺的恶性肿瘤患者。
1.2 方法 记录患者一般资料,包括确诊年龄、肿块直径(参照术前彩超、乳腺钼靶、核磁共振等测量结果,取最大值,根据乳腺癌第七版分期中肿块大小分类手段分类:乳腺癌分为:≤2 cm、>2~5 cm、>5 cm;甲状腺癌分为:≤2 cm,>2~4 cm,>4 cm)、绝经情况、病理学组织类型(参照世界卫生组织制定的甲状腺肿瘤与乳腺肿瘤分类标准进行[4])、甲状腺功能指标、免疫组化(免疫组化结果报告中若提到ER、PR为+、++、+++或≥1%则视为阳性,反之则为阴性)、乳腺癌分子分型[参照2013年ST Gallen共识将其分为4种分型:①LuminalA:ER为阳性+PR为阳性(≥20%)、Ki-67<14%,且HER-2为阴性;②LuminalB:a:(HER-2阴性):ER为阳性+HER-2为阴性+Ki-67高表达(≥14%)或PR低表达或阴性(<20%);b:LuminalB(HER-2阳性):HER-2扩增+ER阳性+任意PR或任意Ki-67;③HER-2过表达:ER或PR阴性,HER-2扩增;④三阴型:PR与ER均为阴性,或伴HER-2阴性]、乳腺癌术后放化疗辅助治疗情况、有无远处转移、有无区域淋巴结转移等。

2 结 果
2.1 人口学特征 28例T1B患者中年龄≥40岁发病率最高,且以40~50岁占比最高;50例oB患者发病主要年龄段为30~70岁,且以40~50岁年龄段发病率最高;16例BT患者40~50岁年龄段发病率最高;36例T1B患者50~60岁年龄段发病率最高;50例oT患者30~40岁年龄段患者发病率最高。见表1。
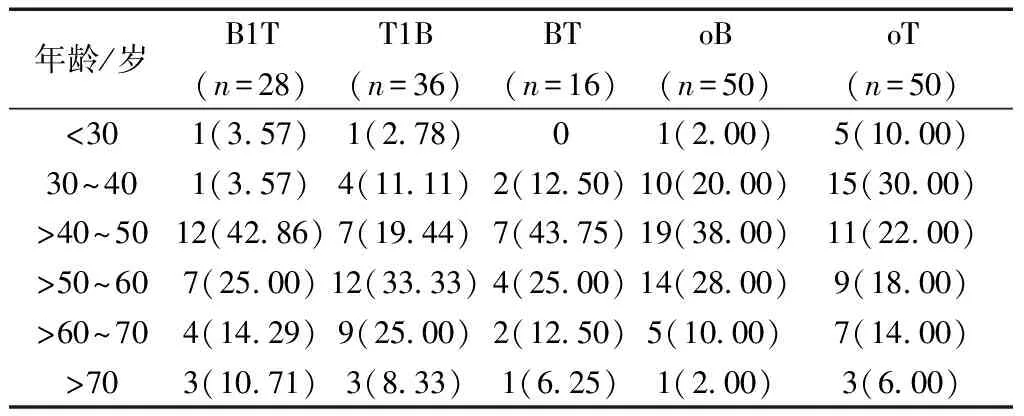
表1 各组患者发病年龄分布与构成比[n(%)]
2.2 临床病理特征 T1B组与oB组间年龄、乳腺癌确诊时绝经情况、病理类型、家族史、肿瘤直径、组织学分级、远处转移、淋巴结转移、乳腺癌术后放疗情况、分子类型等比较,差异均无统计学意义(P>0.05);两组乳腺癌病理类型均主要为浸润性导管癌,分子类型均以LuminalB为主,组间比较差异物统计学意义(P>0.05);T1B组ER、PR表达高于oB组,Ki67值高于oB组,差异有统计学意义(P<0.05)。T1B与oT患者平均发病年龄、病理类型、家族史、肿瘤直径、远处转移、淋巴结转移、多病灶、FT3、FT4等比较,差异无统计学意义(P>0.05);两组甲状腺癌病理类型占比最多均为乳头状癌(PTC)。与oT组比较,T1B组的TPOAb及TGAB值较高,差异有统计学意义(P<0.05)。BT组第一原发癌诊断年龄小于T1B组与T1B组,T1B组第二原发癌间隔时间短于T1B组,差异均有统计学意义(P<0.05);三组间PR+、ER+、HER2+构成比比较,差异无统计学意义(P>0.05);三组间甲状腺功能、Ki-67值比较,差异均无统计学意义(P>0.05)。见表2~4。
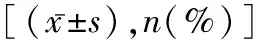
表2 T1B组与oB组临床病理特征比较
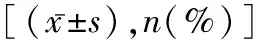
表3 T1B组与oT组病理特征比较
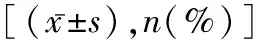
表4 B1T组、T1B组与BT组病理特征比较
3 讨 论
临床发现,既往有甲状腺癌确诊史的患者,再发乳腺癌的风险较其他人群更高,而有乳腺癌病史的患者再发甲状腺癌的风险也较其他患者高[5-6]。乳腺与甲状腺均是激素依赖性器官,机体内分泌一旦发生变化则腺体疾病患病率随之增加,现有的研究普遍认为激素是乳腺癌与甲状腺癌发生发展的主要因素,同时疾病还受到自身免疫、遗传易感性、辐射暴露等因素的影响,而对于部分乳腺癌患者而言,术后放疗过程可能是增加患者患甲状腺癌的危险因素[6]。
本文结果显示,B1T组、oB组、BT组发病年龄段主要集中在40~50岁,T1B组主要发病年龄段为50~60岁,oT组主要发病年龄段为30~40岁。该结果提示初诊为乳腺癌的40~50岁患者罹患甲状腺癌风险较其他年龄段高;而初诊为甲状腺癌的50~60岁患者罹患乳腺癌风险较其他年龄段高。本结果也从侧面反映了在不同人群中甲状腺癌的生物学特征存在差异,乳腺癌与甲状腺癌之间可能并不存在直接因果关系,乳腺癌患者甲状腺癌发病率增加可能是因为患者患病后增加了各项医疗监测手段产生的结果。本文结果显示,BT组第一原发癌诊断年龄小于B1T组与T1B组,B1T组第二原发癌间隔时间短于T1B组,提示乳腺癌或甲状腺癌确诊后再发甲状腺癌或乳腺癌风险增加可能与患者患癌后频繁的检查有关,尤其是在病后5年内表现较突出,故针对初诊为乳腺癌的患者在诊断后的3~4年内应密切监测患者甲状腺病变情况,而针对初诊为甲状腺癌的患者应在诊断后的4~5年内密切监测其乳腺病变情况。
本文结果还显示,BT、oB两组乳腺癌患者均以浸润性导管癌占比最高,其次为导管内癌,且疾病分子类型主要为LuminalB型;而T1B组与oB组甲状腺癌患者则以乳头状癌为主要发病类型,其次为滤泡状癌。此外,对比了B1T与oB组的PR与ER表达发现,B1T组明显高于oB组,原因可能是PR与ER信号在甲状腺癌与乳腺癌的发生发展中可能起到相似的推动作用[7],且与雌激素对甲状腺细胞的细胞周期相关基因及原癌基因的上调作用有关[8]。此外,本文结果还显示,B1T组患者的Ki-67均值高于oB组,二者倍数相差约为2倍,Ki-67是一种能够反映细胞繁殖能力的增值抗原,该抗原的表达与乳腺癌疾病的发生与发展息息相关,是临床上常用的乳腺癌不良预后评估指标,该指标检测数值越高提示患者预后情况越差,故乳腺癌Ki-67高表达可能提示着乳腺癌患者初诊后再患甲状腺癌风险高[9-10]。本文结果显示,B1T、T1B、BT组各甲状腺功能指标水平比较无差异,但T1B组TGAb与TPOAb水平较oT组更高,提示甲状腺癌患者TGAB与TPOAb水平增加可能预示着患者再患乳腺癌风险高,但因本研究纳入样本量较少,故该结果还应在未来大样本长时间的研究中加以证实。
