增温对南亚热带季风常绿阔叶林土壤微生物群落的影响
2019-06-18赵建琪吴建平张慧玲熊鑫赵梦頔褚国伟孟泽周国逸张德强
赵建琪 ,吴建平 ,张慧玲 ,熊鑫 ,赵梦頔 ,褚国伟,孟泽,周国逸,张德强*
1. 中国科学院华南植物园,广东 广州 510650;2. 中国科学院大学,北京 100049
以全球变暖为主的气候变化问题一直备受关注。据IPCC 2018年特别报告指出,与工业化前相比,人类活动导致全球升温1 ℃左右,若继续以当前速度增加,预计在 2030-2052年间全球气温将升高 1.5 ℃(IPCC,2018)。全球变暖对生态系统带来的影响是复杂且深远的。气候变暖使海洋和陆地生物物种群落结构、生活习性、以及分布范围都发生了改变,预计在未来几十年内升温将引发更多的生态及社会经济问题(Walther et al.,2002)。气候变暖对森林生态系统群落结构及物种多样性存在直接或间接的影响,进而影响其生态系统服务功能。森林生态系统是陆地生态系统的重要组成部分,森林土壤碳含量占整个陆地生态系统土壤碳含量的70%以上(Sedjo,1993)。因此,在气候变暖的背景下,森林生态系统的改变必将影响整个陆地生态系统的碳物质循环和能量流动。
森林生态系统中,土壤理化性质等对气候变暖的响应存在滞后性,相比之下,土壤微生物群落对温度变化的响应较为灵敏(卫云燕等,2009)。微生物的底物利用、生长代谢和呼吸过程等都受到温度的强烈影响(Conant et al.,2011)。微生物作为碳氮循环的重要驱动者,扮演着调节土壤生态系统功能如养分循环、土壤结构维持、气体交换等重要角色(沈菊培等,2011)。关于气温上升对土壤微生物影响的研究已有大量报道,但研究的结果并不一致。有研究发现,增温提高了土壤微生物群落结构中真菌的贡献比(Zhang et al.,2005)。但也有研究指出,增温所导致的干旱降低了微生物群落中真菌的比例(Yu et al.,2018)。Schindlbacher et al.(2011)研究则发现增温既没有改变土壤微生物生物量,也没有改变微生物群落结构组成。综合当前各项研究结果来看,土壤微生物群落如何响应气候变暖还有待进一步的研究论证。
目前增温对土壤微生物影响的研究多集中在温带和高山生态系统中,有关南亚热带森林土壤微生物的研究较少(Fang et al.,2016),因此本研究在位于鼎湖山的模拟增温控制实验平台展开研究,以探究气候变暖背景下,南亚热带森林土壤微生物生物量及其群落结构对气温上升的响应。本研究可为今后深入研究土壤微生物对气候变化的响应及陆地生态系统元素循环尤其是碳氮循环过程机理的揭示提供参考。
1 材料与方法
1.1 研究区概况
样地设立在鼎湖山自然保护区。鼎湖山位于广东省肇庆市内(112°30′39″-112°33′41″E,23°09′21″-23°11′30″N),该地区干湿季节交替明显,雨热同期,年均气温为21 ℃,年均相对湿度达82%,年降水量为1927.3 mm,属典型的南亚热带季风气候。保护区山体构造呈东北-西南走向,最高峰鸡笼山海拔可达1000.3 m。海拔不同带来的小气候的变化使得不同海拔梯度上呈现不同森林类型,自下而上依次为季风常绿阔叶林(以下简称季风林)、针阔叶混交林和山地常绿阔叶林。季风林是该地区代表性森林类型之一,土壤类型主要为赤红壤,森林结构较为复杂,主要优势树种为锥(Castanopsis chinensis)、荷木(Schima superba)和黄果厚壳桂(Cryptocarya concinna),林龄 400 多年(Zhou et al.,2007)。
1.2 研究方法
1.2.1 样地设置
在海拔30 m的季风林苗圃地选择空旷地带设置样方,共设置两组开顶箱(Open Top Chamber,OTC),一组作为对照,另一组做红外增温处理,每组分别设立了3个重复,共6个OTC。每个OTC内径深0.8 m、长3 m、宽3 m,坑底部先用碎石填埋,再铺上水泥,最后将底部及四周都贴上瓷砖。OTC修建完成后进行填土。取自季风林的赤红壤,按照0-20、20-40、40-70 cm土层顺序进行采集,再分别一一对应,由深到浅装填进 OTC中。之后,选取年龄、基茎和树高一致的6种季风林优势种树苗,在林内统一位置进行驯化后,移植至各个OTC内,确保每个OTC内6个树种的生理生长状况相近,从而控制地上部分的统一性。
用于增温的 OTC由透明玻璃围起(铝合金框架),高3.5 m,顶部全开。每个OTC的增温设施处理由4根各为200 cm长、功率为1000 W的红外加热管,2台混气风扇和控制器组成,采用每隔10 min加热10 min的不间断定时增温模式:即通电加热10 min断电停止10 min分钟再启动,如此循环往复。每次通电启动加热的同时启动安装于 OTC对角的两台混气风扇,停止加热时同步断开电风扇的动力。加热管安装于OTC四边,下倾45°向内加热,安装高度为 OTC内植物平均树高三分之二高处,混气风扇安装在低于加热管50-80 cm处,均匀 OTC内空气和温度。样地同时设置了微气象和水文观测系统,对每个 OTC的土壤温度、湿度和地面气象因子以及降水量与蒸发量进行实时连续观测(刘菊秀等,2013)。增温处理起始时间为2015年6月20日。
1.2.2 样本采集
土壤样品采集于2017年12月。在上述增温平台中,采用5点混合取样法,在每个OTC各随机选取5个点,去除覆盖在表层土的枯枝落叶,用内径2.5 cm的土钻按0-10 cm和10-20 cm分层取样,同一层土样放入同一个袋子中,6个OTC共采集 12个样本。将采集到的样品于当天带回实验室进行预处理,用镊子挑拣出大颗粒的碎石以及肉眼可见的植物根系和动物残体等杂质后过2 mm筛。随后将各样品均分为两份:一份置于4 ℃冰箱中用于土壤微生物指标测定,并在一周内完成;另一份自然风干,用于土壤理化性质测定。
1.2.3 土壤基本理化性质测定
采用电极电位法测定土壤 pH值,水土比为2.5∶1;油浴加热-重铬酸钾氧化容量法测定土壤有机碳;凯氏蒸馏法测定土壤全氮;氢氧化钠熔融钼锑抗比色法测定土壤全磷;靛酚蓝比色法测定土壤铵态氮;紫外分光光度法测定土壤硝态氮。上述理化性质测定方法参照刘光崧(1996)和鲍士旦(2010)所述方法。土壤温湿度数据来自于样地监测设备中的温度湿度传感器。
1.2.4 土壤微生物生物量碳和氮含量测定
土壤微生物生物量碳(MBC)和氮(MBN)的测定采用氯仿熏蒸-硫酸钾浸提法(Vance et al.,1987)。分别称取10 g预处理后的鲜土2份,一份在 25 ℃室温、黑暗密闭的环境下用不含酒精的氯仿熏蒸24 h,熏蒸结束后用0.5 mol·L-1硫酸钾溶液按水土比5∶1振荡浸提;另一份直接浸提作为对照。使用有机碳自动分析仪(Shimadzu,Kyoto,Japan)测定 MBC和 MBN含量。MBC转化系数为 0.45(Vance et al.,1987),MBN 转化系数为 0.54(Brookes et al.,1985)。
1.2.5 土壤微生物群落组成测定
采用磷脂脂肪酸方法(PLFA)测定土壤微生物群落组成,操作步骤参照Bossio et al.(1998)在Bligh et al.(1959)基础上改进而来的方法。首先称取8 g经冷冻干燥处理过后的土壤样品,再经过提取液提取、分离、提纯,然后萃取分离,再用N2吹干。最后用加内标的正己烷溶解,利用气相色谱仪分析测定样品所含微生物类群。微生物生物量基于碳内标19:00的浓度来计算(Tunlid et al.,1989)。
PLFA结果分析依据标准命名法并结合(Frostegård et al.,1996;Olsson,1999;Frey et al.,2008;Schindlbacher et al.,2011)的文献(表 1)。其中,用各类群所测PLFA含量总和代表土壤微生物总PLFAs,各类群分别占总PLFAs的百分比代表各自的相对丰度。

表1 磷脂脂肪酸标记分类Table 1 Identifier of phospholipid fatty acids
1.3 数据分析
采用独立样本t检验分析土壤理化性质、微生物生物量和微生物群落对增温的响应;采用双因素方差分析比较增温处理和土层深度对土壤微生物不同类群的影响;采用主成分分析法(PCA)检验增温处理对微生物群落结构的影响;采用冗余分析法(RDA)分析土壤环境变量与微生物群落结构间的关系。运用软件Excel 2010、SPSS 21.0、PAST 3.0和Canoco for Windows 4.5进行上述数据分析处理及作图。
2 结果与分析
2.1 土壤温湿度观测结果
与对照组相比,增温组0-10 cm土层平均温度上升1.24 ℃(P<0.05)(图1A),10-20 cm层上升1.17 ℃(P<0.05)(图1B),增温效果显著。而土壤湿度在0-10 cm(图1A)和10-20 cm(图1B)分别下降0.61%和0.69%,增温处理对土壤湿度未产生显著影响(P>0.05)。
2.2 增温对土壤基本理化性质的影响
采用独立样本t检验分析土壤基本理化因子对增温的响应(表2),结果显示温度上升使土壤硝态氮(NO3--N)含量显著增加,但对土壤 pH、有机碳(SOC)、总氮(TN)、总磷(TP)和铵态氮(NH4+-N)含量作用不显著。双因素方差分析结果表明,土层深度及深度和增温的交互作用对土壤基本理化性质影响不显著。
2.3 增温对土壤微生物生物量的影响
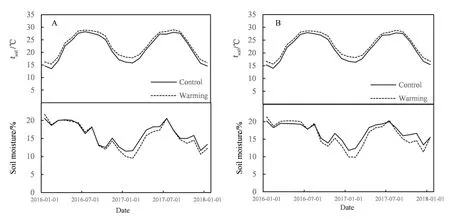
图1 增温组和对照组在0-10 cm(A)和10-20 cm(B)土壤层的月平均温度和湿度Fig. 1 Monthly average temperature and volumetric water content at 0-10 cm (A) and 10-20 cm (B) soil depth of the warm treatment and control(from January 2016 to January 2018)
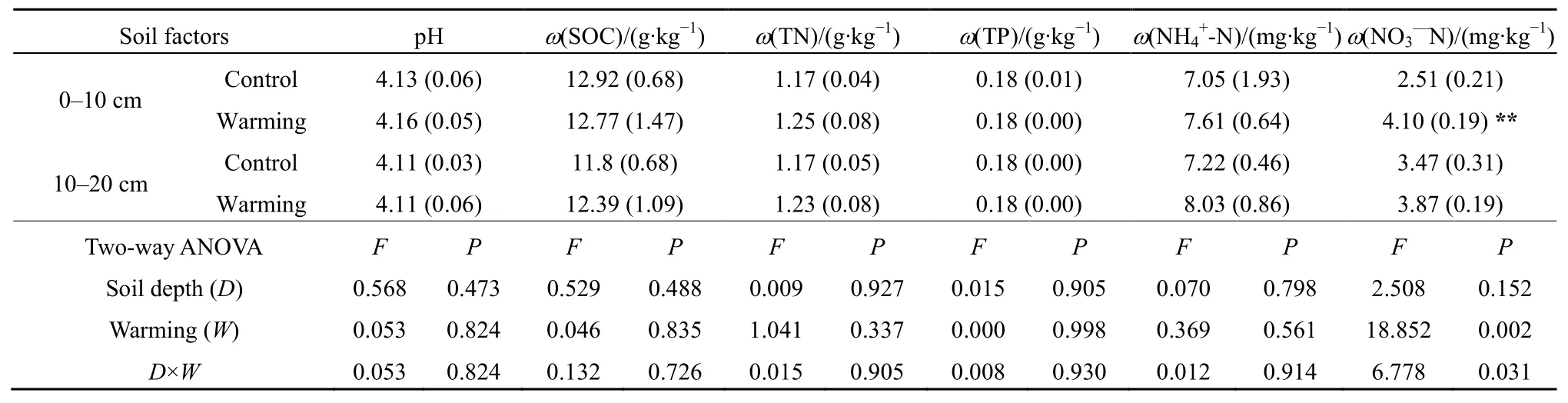
表2 增温对土壤理化性质的影响Table 2 Warming effects on soil physicochemical properties

图2 对照组和增温组在0-10 cm和10-20 cm土层中的微生物生物量Fig. 2 Soil microbial biomass in soil depths of 0-10 cm and 10-20 cm in the warm treatment and control
土壤微生物生物量分析结果显示(图2),MBC在0-10 cm和10-20 cm的土层中都表现出随温度上升而下降的趋势。MBN在0-10 cm层随增温降低,但在10-20 cm内则随增温而上升。C/N在两土层内的变化趋势也不一致。增温组 0-10 cm层C/N上升,而在10-20 cm层C/N下降。增温处理虽使0-10 cm和10-20 cm土层中MBC、MBN和 C/N发生变化,但差异均未达显著性水平(P>0.05)。0-10 cm土层内,对照组和增温组MBC分别为 233.69 mg·kg-1和 195.02 mg·kg-1,MBN 分别为 34.41 mg·kg-1和 15.00 mg·kg-1,C/N 分别为7.35和16.97。而在10-20 cm的土层内,对照组和增温组中 MBC分别为 149.87 mg·kg-1和130.87 mg·kg-1,MBN 分别 24.06 mg·kg-1和 25.83 mg·kg-1,C/N分别为6.27和5.44。

图3 增温对微生物磷脂脂肪酸含量的影响Fig. 3 Effects of warming on microbial PLFAs content
如图3所示,微生物磷脂脂肪酸含量分析结果表明,土壤总 PLFAs、细菌 PLFAs和真菌 PLFAs的含量均随温度升高而降低,且变化趋势在 0-10 cm层和10-20 cm层之间保持一致,但差异均未达显著性水平(P>0.05)。其中,土壤总PLFAs在增温处理下 0-10 cm和 10-20 cm层分别降低25.7%和 18.9%,细菌 PLFAs分别降低 23.2%和17.3%,真菌PLFAs分别降低41.4%和31.8%。
2.4 增温对土壤微生物群落结构的影响
从PCA分析结果来看(图4),在0-10 cm的土层内,主成分轴分别解释了群落结构变异的65.2%和21.3%,总解释度为86.5%(图4A),增温组和对照组差异不显著(P>0.05)。但增温处理对10-20 cm土层微生物作用显著,主成分轴分别解释了群落结构变异的63.5%和20.8%,总解释度为84.3%(图 4B),各样本微生物群落互不重叠,差异显著(P<0.01)。
双因素方差分析结果表明(表3),增温处理显著改变了土壤微生物群落内B、F和AMF的相对丰度,B/F及 G+/G-也发生了显著变化。土层深度的不同对微生物群落结构也有显著影响。从分析结果来看,土层深度的不同对 G+、F的相对丰度以及B/F、G+/G-的作用最为显著,而增温处理和土层间的交互作用对土壤微生物群落组成影响不明显。
基于磷脂脂肪酸分析法所得微生物各类群相对丰度结果如图5所示。在0-10 cm和10-20 cm的土层内,细菌PLFAs的相对丰度达80%以上,且随温度上升显著增加。真菌在土壤中含量较低,其PLFAs相对丰度仅占群落的10%左右,呈随温度增加而降低的变化趋势,在10-20 cm的土层内表现出显著差异(P<0.05)。增温处理使0-10 cm和10-20 cm土层中丛枝菌根真菌PLFAs的相对丰度随温度增加而显著降低(P<0.05)。此外,土壤微生物群落内B/F和G+/G-在10-20 cm土层中都随温度升高而显著上升(P<0.05)。

表3 基于双因素方差分析得到增温处理(W),土层深度(D)以及交互作用(W×D)对微生物群落结构的影响(F值)Table 3 Results (F values) of two-way ANOVA on the effects of warming (W), soil depth (D), and their interactions (W×D)on microbial community
2.5 土壤理化因子与土壤微生物群落结构间的关系
RDA分析结果表明(图6),轴1和轴2分别解释了土壤微生物群落结构变异的74.9%和6.9%。解释群落结构变异的 3个主要环境变量分别是NO3--N、SOC和土壤温度。其中NO3--N解释度最高,解释了群落结构变异的40.1%(P<0.05),SOC解释了20.4%(P<0.05),土壤温度解释了8.6%,但未达显著性水平(P>0.05)。其他环境因子与微生物群落组成间的相关性均不显著(P>0.05)。
3 讨论
3.1 土壤环境因子对微生物的影响和调控

图4 0-10 cm(A)和10-20 cm(B)土层土壤微生物群落结构的主成分分析Fig. 4 Principal component analysis of soil microbial community structure in soil layer of 0-10 cm (A) and 10-20 cm (B)n=3
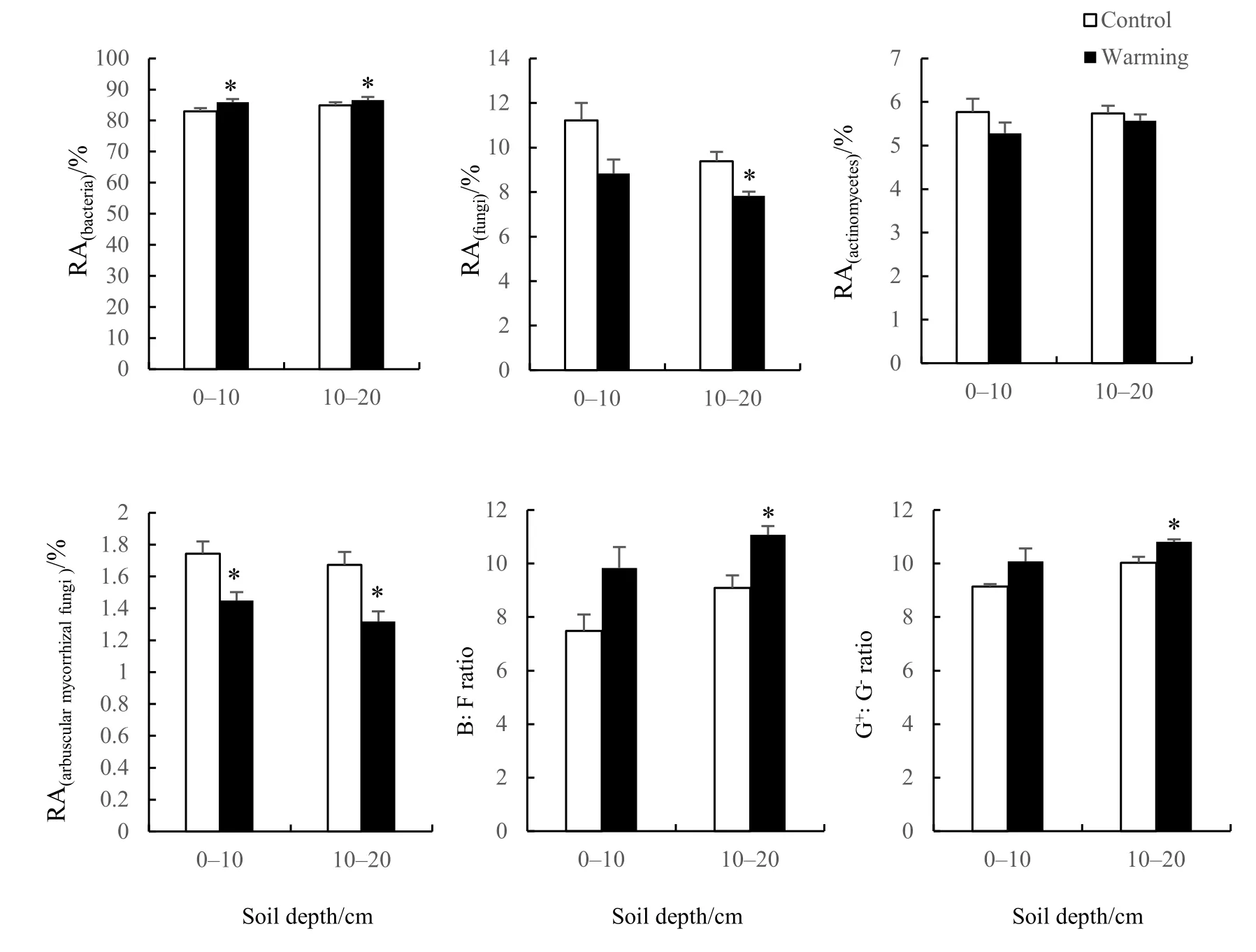
图5 微生物PLFAs在0-10 cm和10-20 cm土层中的相对丰度(RA)Fig. 5 Relative abundance (RA) of the microbial PLFAs in soil layers of 0-10 cm and 10-20 cm

图6 基于冗余分析得到的微生物群落与环境因子之间的关系Fig. 6 Redundancy analysis of relationship between soil microbial community and environmental parameters.
土壤理化性质是影响微生物生物量和微生物活性的关键因素(Billings,2012)。RDA分析结果证明,土壤NO3--N和SOC含量的变化共同解释了微生物群落结构60.5%的变异度,是本研究中影响微生物群落结构变异的关键因子,说明土壤理化特性对微生物的影响大于土壤气候因子带来的直接影响,气候变暖通过改变土壤理化环境而间接对土壤微生物造成影响。Breuer et al.(2002)在对澳大利亚热带雨林生态系统的研究中表明,土壤硝化作用与温度存在显著的正相关关系,土壤温度每升高1 ℃,硝化速率平均提高1.17 mg·m-2·h-1(以NH4+-N计),14-24 ℃之间的温度系数 Q10值为 3.60;Ingwersen et al.(1999)对温带针叶林生态系统的研究同样发现,在5-25 ℃之间,土壤硝化速率随温度升高而显著增加,温度敏感性指数Q10值为4.16。尽管不同区域及不同生态系统土壤硝化速率及其对温度的敏感性不同,但土壤硝化速率与土壤温度之间都一致表现出显著的正相关关系。本研究中,增温处理使土壤温度显著提高1.24 ℃(0-10 cm),结合增温与对照处理中土壤NO3--N含量的变化,可知增温对土壤的硝化作用产生了显著影响。Breuer et al.(2002)研究表明,土壤水分含量的增加显著降低了土壤的硝化速率。本研究增温处理虽然对土壤含水量没有显著影响,但土壤含水量还是略有下降,尤其是在0-10 cm土层中。土壤含水量的降低,意味着硝化细菌对 O2的可获得性变得更充分,有助于提升土壤的硝化速率,这也可能是本研究中增温组表层土壤NO3--N含量显著高于对照组的原因。本试验结果表明,增温通过促进土壤硝化细菌的活性提高了土壤硝化速率,进而提高土壤NO3--N的可获得性,促进植物对氮素的利用。
此外,本研究中土壤SOC也是影响微生物群落组成的重要因子。增温处理下,土壤SOC含量与对照组相比差异不显著,但在0-10 cm层呈现出随增温降低和在 10-20 cm层随增温升高的变化趋势。陆地是生物圈中最大的有机碳库(Schlesinger,1977),土壤有机碳含量很大程度上决定了土壤微生物群落的动态变化(Zhang et al.,2012;李倩等,2018),而微生物群落的改变又将对土壤有机质的分解产生影响。本试验0-10 cm和 10-20 cm土层中微生物生物量和微生物群落组成不同,增温组土壤MBC和总PLFAs与对照组差异不显著,但呈随增温下降的变化趋势。采样期间土壤含水量的差异会影响好氧微生物的活性,表层土(0-10 cm)和次表层土(10-20 cm)微生物总量的差异可能是导致土壤SOC含量在土层间对增温的响应存在差异的重要原因。不同的微生物类群偏好利用的碳源不同,碳利用能力也各不一致,真菌偏向于利用结构复杂的难降解有机碳,而细菌则偏向于利用结构简单的易降解有机碳(Rinnan et al.,2009)。丛枝菌根真菌及其分泌蛋白会促进土壤团聚体的形成,通过将易分解的土壤有机碳包裹聚集,进而延缓土壤有机碳的分解(Rillig et al.,2006)。本研究中,增温使真菌和丛枝菌根真菌相对丰度降低,细菌相对丰度增加,通过对土壤微生物群落动态变化的研究,将帮助我们进一步理解土壤碳氮过程对增温的生物响应机制。土壤微生物群落中不同类群相对丰度的变化对土壤有机碳分解速率的具体贡献,是我们后续研究中的重点。
3.2 土壤微生物对增温的响应
本研究中,增温处理未显著改变土壤微生物生物量和总磷脂脂肪酸含量,但它们都呈现出随温度增加而降低的变化趋势。张明乾等(2012)研究表明,夜间增温处理显著降低了冬小麦土壤微生物生物量碳、氮含量和微生物活性,并通过改变土壤理化特性而影响土壤的碳、氮循环,呈现出与白天不对称的增温效果。与利用开顶箱(OTC)形成温室效应增温的研究不同的是,本试验采用全天候24 h不间断增温处理模式,夜间仍然保持增温。夜间增温产生的效应可能会抵消白天的增温效应,甚至比白天更强,呈现不对称的增温效果,最终导致增温处理下土壤微生物量和总磷脂脂肪酸含量有所下降。
本研究中,增温显著改变了土壤微生物群落结构。随着温度升高,细菌的相对丰度在 0-10 cm和10-20 cm土层间均显著增加,真菌相对丰度在10-20 cm土层中显著降低,细菌真菌比在10-20 cm土壤中表现出随温度增加显著变大的趋势。而磷脂脂肪酸含量结果显示,细菌 PLFAs和真菌PLFAs都呈随温度升高而下降的趋势,说明本研究增温对细菌和真菌都存在抑制作用,且增温对真菌的抑制作用大于细菌,使得群落内细菌真菌之比显著变大。Fu et al.(2019)在增温和CO2浓度增加对土壤微生物影响的整合分析中指出,红外增温加热会引起土壤氮素利用率的增加而提高土壤细菌真菌之比。本研究中 RDA分析结果也证明了这一结论。土壤微生物群落中细菌真菌比例的改变可能会使土壤微生物对碳氮的利用格局也发生变化。细菌相对丰度的显著增加,有利于易分解有机碳的降解,被降解的有机碳通过排放和淋溶流失,不利于土壤有机碳的积累。李义勇(2016)在对南亚热带针阔叶混交林植物生理生态过程对增温响应的研究中也得到相同的结果。此外,增温也显著改变了细菌类群中革兰氏阳性菌和革兰氏阴性菌的比例。在10-20 cm土层中,G+/G-随增温而升高,说明增温不利于G-在群落中的分布,这一结果与Ziegler et al.(2013)的研究一致。由于G+有比G-更强的利用难分解底物的能力,因此在养分匮乏和水热不利的条件下,能更好地适应环境而存活(Wilkinson et al.,2002)。
4 结论
本研究依托鼎湖山野外增温实验平台,通过对南亚热带季风常绿阔叶林土壤微生物对增温响应的研究,得出以下结论:增温处理显著增加了土壤温度和土壤硝氮含量,对其他理化因子作用不明显;增温未显著改变土壤微生物生物量,但对微生物群落结构作用显著,增温提高了群落中细菌的相对丰度、细菌真菌之比以及革兰氏阳性菌革兰氏阴性菌之比,降低了真菌和丛枝菌根真菌的相对丰度;土壤硝态氮和土壤有机碳含量是影响微生物群落结构变化的关键因子。气候变暖对南亚热带季风常绿阔叶林土壤微生物的影响,也将改变这些微生物驱动的土壤碳氮过程。
