紫杉醇微球-原位凝胶的制备及其局部注射的抗肿瘤药效
2019-06-18杜祎甜仰浈臻张春丽齐宪荣
詹 颖,杜祎甜,仰浈臻,张春丽,齐宪荣△
(1. 北京大学药学院药剂学系,北京大学药学院分子药剂学与新释药系统北京市重点实验室, 北京 100191; 2. 北京大学第一医院核医学科, 北京 100034)
肿瘤是影响人类健康的重大疾病,如脑胶质瘤是极具侵袭性的脑部肿瘤,患者死亡率高、生存期短[1];乳腺癌是女性常见的恶性肿瘤之一,发病率高,侵袭性强,极易复发和转移[2]。对肿瘤的治疗通常包括手术切除、放疗、化疗、光热治疗和免疫治疗等,其各有利弊,外科切除的缺点在于难以根治、容易复发,化疗、放疗对患者产生的毒副作用较大。紫杉醇(paclitaxel,PTX)是经典的抗肿瘤药物,目前已有紫杉醇注射液(商品名:泰素®,Taxol)、紫杉醇白蛋白纳米粒、紫杉醇脂质体等多种剂型应用到临床中,但也面临着给药次数多、存在安全隐患、患者依从性差等问题[3]。微球是一种良好的缓释剂型[4],可以定向植入,减少全身毒副作用,目前已经上市的微球产品有注射用醋酸亮丙瑞林微球等,用于绝经前乳腺癌或前列腺癌的治疗。随着材料学的发展,有更多生物相容性优良的材料应用到微球制剂当中,其中聚乳酸羟基乙酸共聚物[poly(lactic-co-glycolic acid), PLGA]具有生物可降解性,它作为一种安全的药用辅料被《美国药典》收录,采用PLGA制备的紫杉醇微球(paclitaxel microspheres,PTX/M)在肿瘤治疗中具有良好的前景。
原位凝胶是一种安全方便的新剂型,它以液体的形式给药,进入体内后迅速发生相转变,在给药部位形成半固体储库[5]。微球和凝胶的结合,一方面弥补了微球突释的缺陷,另一方面延长了微球在病灶部位的停留,提高了药物在局部的有效浓度从而获得更好的抗肿瘤效果。Elkharraz等[6]制备了PTX/M和脂质的复合物,通过局部注射的方式治疗脑瘤,可以延长药物在脑部的作用时间。本研究首先选用聚氧乙烯和聚氧丙烯组成的嵌段共聚物泊洛沙姆(Poloxamer)作为温敏凝胶材料,它作为一种无毒、无刺激性药用辅料被《美国药典》收录,并且广泛应用在口服、注射和局部用药物制剂中[7],Shelke等[8]使用Poloxamer 407作为基质制备了盐酸那拉曲坦的鼻腔给药凝胶,延长了药物在体内的停留时间,避免了反复给药。Pluta等[9]使用Poloxamer 407制备了甲氨蝶呤的温敏凝胶系统,用于实体瘤的治疗。本研究选用PLGA作为微球材料,制备了PTX/M,进一步制备得到载紫杉醇微球的原位凝胶,通过局部注射的方式给药,减少了给药次数,降低了毒副反应,达到了较好的抗肿瘤效果。
1 材料与方法
1.1 材料与仪器
1.1.1药品和试剂 紫杉醇,北京诺瑞医药技术有限公司;泰素®(Taxol),美国百时美施贵宝公司;PLGA(75/25,Inherent Viscosity 0.65 dL/g),LACTEL®Absorbable Polymers;Poloxamer 407和Poloxamer 188,北京风礼精求商贸有限责任公司;高效液相色谱(high performance liquid chromatography,HPLC)所用试剂为色谱纯,其他试剂均为分析纯。
1.1.2仪器 BP211D电子分析天平,德国Sarto-rius 公司;LC-20A高效液相色谱仪系统,日本Shimadzu公司;3K-15低温高速离心机,德国Sigma公司;CO2细胞培养箱,美国Thermo公司;BT-9300H型激光粒度分布仪,丹东市百特仪器有限公司;Rheometer RS300流变仪,德国Thermo Haake公司。
1.1.3动物 BALB/c裸鼠,雄,6~8周,体重 18~20 g;BALB/c小鼠,雌,6~8周,体重18~20 g,均由北京维通利华实验动物技术有限公司提供,北京大学医学部实验动物部清洁级动物房饲养。
1.2 实验方法
1.2.1PTX/M的制备 通过乳化溶剂挥发法[6,10]制备不同粒径大小的PTX/M。称取适量PLGA溶于5 mL二氯甲烷,400 r/min磁力搅拌使其充分溶解,而后加入40 mg PTX分散在其中;在转速分别为1 600、1 000和600 r/min的条件下,将得到的有机相缓慢滴加至50 mL含20 g/L聚乙烯醇[poly (vinyl alcohol),PVA]的水相溶液中进行乳化,继续搅拌半小时后将转速降为400 r/min,搅拌过夜使二氯甲烷挥发完全;最后用去离子水将微球洗涤、冻干。
1.2.2微球粒径和形态的测定 使用激光粒度分布仪测定微球的粒径大小和分布。将适量微球加入含0.02%(体积分数)吐温80的溶液中并稀释至适宜浓度,涡旋,使其分散均匀待测。通过扫描电镜(scanning electron microscope,SEM)观察微球的形态,将双面胶带粘附于铜锭上,取适量冻干后的微球样品置于其上,涂布均匀,喷金后选取适当倍数进行观察。
1.2.3包封率和载药量的测定 采用HPLC测定微球中PTX的含量。取新鲜制备的PTX/M混悬液适量,离心后用0.5%(体积分数)甲醇溶液洗涤微球两次,乙腈破乳,此时测得的PTX浓度记作Cencap,洗涤之前测得的PTX浓度记作Ctotal,计算PTX/M中PTX的包封率(encapsulation efficiency,EE)和载药量(drug loading,DL):EE =Cencap/Ctotal×100%,DL =Wencap/ (WPTX+WPLGA) ×100%,式中Wencap、WPTX、WPLGA分别代表包封的PTX质量、初始PTX和PLGA的质量。
1.2.4PTX/M的体外释放 将适量PTX/M分散于磷酸盐缓冲溶液(phosphate buffer solution,PBS)中,在100 r/min、37 ℃的恒温摇床中连续释放1个月,分别在第2、5、10、20、30天取1 mL释放液,1 000 r/min离心4 min后取上清,HPLC检测PTX浓度。测得释放第i天的PTX浓度记作Ci,释放前的PTX浓度记作C0,计算累积释放百分率:Accumulated release percent=∑Wi/W0×100%,式中Wi为测得的释放液中PTX的质量(i=2,5,10,20,30),W0为释放前微球中PTX的质量。另外,收集释放结束时的微球样品进行SEM拍照,观察此时微球的形态。
1.2.5原位凝胶的制备 通过冷置溶解法制备原位凝胶。称取适量Poloxamer 407和Poloxamer 188于烧杯中,加入一定量的生理盐水,4 ℃静置过夜,即得空白凝胶(blank gel)。PTX/M gel的制备方法与其类似,将PTX/M分散在生理盐水中,按相同的方法制备即可。
1.2.6相转变温度的测定 采用试管翻转法测定原位凝胶的相转变温度。将制得的空白凝胶或PTX/M gel溶液从4 ℃取出,置于透明玻璃试管中,使用水浴从4 ℃开始升温,2 min升高1 ℃,并在每摄氏度平衡3 min,仔细观察并记录试管中溶液失去流动性时的温度,作为相转变温度(T)。每个样品平行测定3次。
1.2.7凝胶的流变学性质 使用流变仪对凝胶的模量进行测定。先选择Oscillation(f)模式,即振荡(频率)模式,频率用f表示,再选择应力传感模式,恒定τ=1.00 Pa,频率取点范围0.01~10 Hz,对数取点。取3 mL样品于样品台上,降低旋转头至Gap=1.00 mm,恒温后自动开始测试。
1.2.8凝胶的溶蚀与释放 取空白凝胶、PTX/M gel溶液各1 mL置于已知重量的玻璃小瓶中,PTX/M gel中PTX/M的浓度为4 g/L,37 ℃恒温使其充分成胶。加入1 mL PBS(37 ℃预热)作为释放介质,在37 ℃、100 r/min恒温摇床中震荡,每隔30 min取出全部释放介质,对剩余凝胶迅速称重,然后补充新鲜介质1 mL。相邻时间点样品的重量反映了凝胶的溶蚀情况,计算凝胶的累积溶蚀百分率:Accumulated dissolution percent = (m0-mt)/m0×100%,式中m0指凝胶初始重量,mt指t时刻剩余凝胶的重量。另外,用HPLC测定释放介质中PTX/M的浓度,绘制凝胶释放曲线和溶蚀曲线,并考察它们的相关性。
1.2.9凝胶的通针性与体内滞留时间 使用1 mL注射器将台盼蓝标记的生理盐水与凝胶溶液同时注射到37 ℃水浴中,拍照观察。另外使用BALB/c小鼠,在其背部注射100 μL台盼蓝标记的凝胶溶液,在第2、4、6、12、24和48 h分别处死小鼠,观察凝胶的滞留情况。对照组小鼠注射等量台盼蓝标记的生理盐水。
1.2.10体内抗U87 MG肿瘤药效的研究 建立人源U87 MG的皮下肿瘤模型,待裸鼠的肿瘤体积长至100 mm3左右时将其随机分成3组,每组6只,按以下方案给药:(1)对照组,生理盐水;(2)PTX/M gel组,PTX给药剂量20 mg/kg;(3)Taxol组,PTX给药剂量5 mg/kg。给药当天记作第1天,Taxol组的荷瘤裸鼠从第1天起每周尾静脉给药100 μL,其余各组均为第1天瘤旁单次给药100 μL。实验期间每两天记录肿瘤的生长情况和裸鼠体重,计算肿瘤体积:Tumor volume (mm3)= 0.5×a×b2,a和b分别代表肿瘤的长径和短径。另外,处死裸鼠后解剖取其心、肝、脾、肺、肾,用于HE染色,并计算脏器指数:Organ coefficient = organ weight (g) / net body weight (g)×100%。
1.2.11体内抗4T1肿瘤药效的研究 建立鼠源4T1的皮下肿瘤模型,待小鼠的肿瘤体积长至100~200 mm3时将其随机分成3组,每组10只,按以下方案给药:(1)对照组,生理盐水;(2)PTX/M gel组,PTX给药剂量20 mg/kg;(3)Taxol组,PTX给药剂量5 mg/kg。给药当天记作第1天,Taxol组的荷瘤小鼠从第1天起每周尾静脉给药100 μL,其余各组均为第1天瘤旁单次给药100 μL。实验期间每两天记录肿瘤的生长情况和小鼠体重,计算肿瘤体积。另外,小鼠死亡后取其肺组织置于Bouin’s固定液中固定24 h,观察肺转移情况。
1.2.12预防4T1肿瘤术后复发的研究 建立鼠源4T1的皮下肿瘤模型,待小鼠的肿瘤体积长至100~200 mm3时进行手术切除肿瘤,切除的肿瘤体积占肿瘤总体积的90%左右,同时按以下方案给药:(1)对照组,生理盐水;(2)PTX/M gel组,PTX给药剂量20 mg/kg;(3)Taxol组,PTX给药剂量5 mg/kg。手术及给药当天记作第1天,Taxol组小鼠从第1天起每周尾静脉给药100 μL,其余各组均为第1天瘤腔内单次给药100 μL。实验期间观察肿瘤复发情况,记录复发后肿瘤大小和小鼠生存期。
1.3 统计分析
利用SPSS 20.0软件对数据进行统计分析,所有数据用均数±标准差表示。对多组数据采用单因素方差分析(one-way ANOVA),两两比较采用LSD法,P<0.05时为差异有统计学意义。
2 结果
2.1 微球的性质与表征
通过乳化溶剂挥发法得到3种不同粒径的PTX/M,记作PTX/M 16、PTX/M 10和PTX/M 06,分别代表搅拌速度为1 600、1 000和600 r/min时制得。图1为不同微球的粒径分布图,表1是对不同微球的粒径、比表面积(specific surface area,SSA)、包封率和载药量的比较。由此可知,搅拌速度是影响微球大小的主要因素,随着转速的降低,微球的粒径呈现增大的趋势,同时伴随着微球比表面积的减小以及PTX/M包封率和载药量的增大。
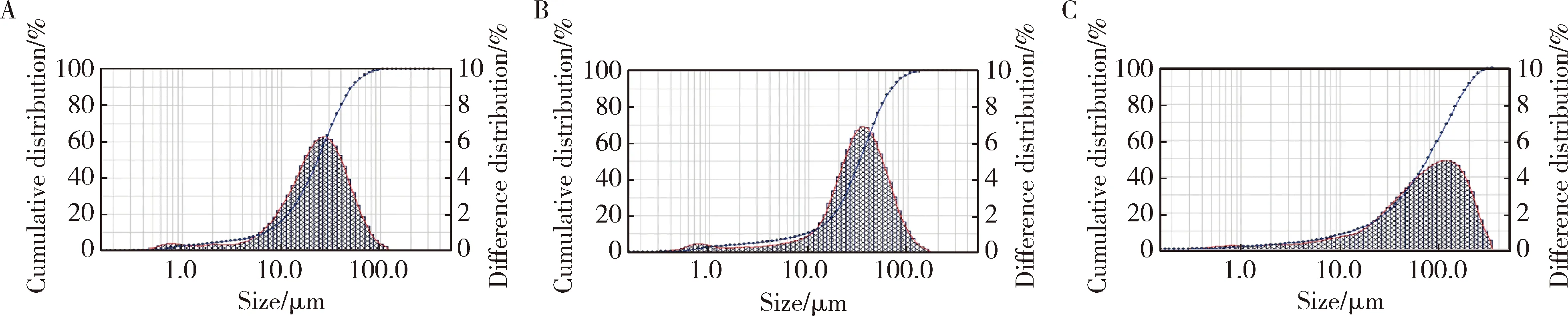
Blue line represents cumulative distribution and red line reresents difference distribution.图1 PTX/M 16(A)、PTX/M 10(B)和PTX/M 06(C)的粒径分布Figure 1 The particle diameter distribution of PTX/M 16 (A), PTX/M 10 (B), PTX/M 06 (C)
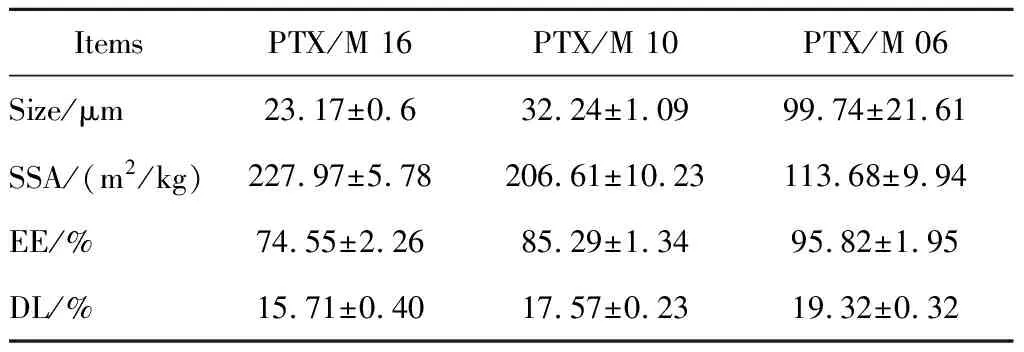
表1 PTX/M 16、PTX/M 10和PTX/M 06粒径、比表面积、包封率和载药量的比较Table 1 Comparison of particle diameter, SSA, EE, DL among PTX/M 16, PTX/M 10 and PTX/M 06
2.2 紫杉醇微球的体外释药行为
PTX从微球中的累积释放百分率如图2所示,释放初始阶段(0~2 d)药物存在轻微的突释现象,这是由于吸附在微球表面的游离药快速释放导致,之后很长一段时间内PTX的释放表现平稳、缓慢。在第30天时,PTX/M 16、PTX/M 10、PTX/M 06的累积释放百分率分别为43.34%±12.45%,33.56%±3.33%,19.89%±2.23%,对于三批不同的PTX/M,粒径越大,微球中的PTX释放越慢,这与其具有较小的比表面积有关。综合考虑PTX/M的包封率和释放特性,本研究选用PTX/M 10进行后续实验。
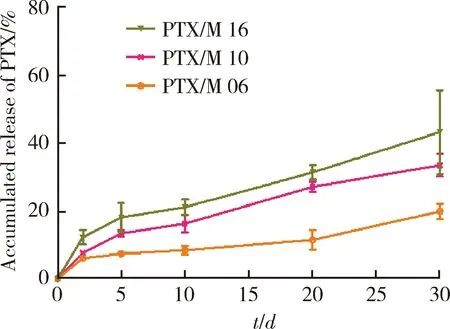
PTX, paclitaxel; PTX/M, paclitaxel microspheres. Data are presented as the (n=3).图2 PTX/M 16、PTX/M 10和PTX/M 06中PTX的体外累积释放曲线Figure 2 Percentage of accumulated release of PTX from PTX/M 16, PTX/M 10 and PTX/M 06, respectively
2.3 微球的扫描电镜照片
图3A、B是新鲜制备的PTX/M分别放大500倍和2 000倍的SEM照片,由图可见微球呈规则的圆球形,分散性良好,少粘连。图3C、D是释放30 d时微球分别放大500倍和2 000倍的SEM照片,此时由于PLGA发生降解[11],微球失去了完整的面貌,彼此粘连,内部结构暴露。
图3 新鲜制备的PTX/M(A、B)和降解30 d后的PTX/M(C、D)扫描电镜照片Figure 3 SEM micrographs of PTX/M (A, B) and degraded PTX/M after 30 days (C, D)
2.4 相转变温度
当Poloxamer 407浓度为17.5%(质量分数)时,不同浓度的Poloxamer 188对凝胶相转变温度的影响如表2所示,可见当Poloxamer 407浓度一定时,相转变温度会随着Poloxamer 188浓度的增加呈现升高的趋势;与同浓度的空白凝胶相比,PTX/M gel相转变温度较低,这可能与微球在凝胶中与Poloxamer彼此接触有利于其交联有关;当Poloxa-mer 188浓度为2.6%(质量分数)时,基本能满足体外注射的需求。

表2 Poloxamer 188浓度的改变对凝胶相转变温度的影响Table 2 Phase transition temperature of gel when the concentration of Poloxamer 188 was changed
PTX/M, paclitaxel microspheres.
2.5 凝胶的流变学性质
流变仪对凝胶的测试结果如图4所示,G′代表弹性模量,G′′代表损耗模量,当二者的lgG不再变化时,此时的G′为样品的弹性模量值。空白凝胶在25 ℃和37 ℃时的lgG′分别为3.83和4.31,弹性模量分别为6.7×103Pa和20×103Pa,PTX/M gel在25 ℃和37 ℃时的lgG′分别为3.63和4.25,弹性模量分别为4.2×103Pa和18×103Pa。由此可见,当温度升高时,不论是空白凝胶还是PTX/M gel都发生了相转变,从“柔软”的流动态凝胶溶液变成了“坚固”的半固体凝胶,弹性模量因此增大;与同一温度下的空白凝胶相比,PTX/M gel的弹性模量略低,这可能与PTX/M在凝胶中占据了一定的位置空间,对整体的凝胶系统起到了一定稀释作用有关。
2.6 溶蚀与释放
凝胶的溶蚀行为如图5所示,在相同的时间内,PTX/M gel比空白凝胶的累积溶蚀百分率大,这一方面与载药会降低凝胶的相转变温度有关,因为凝胶化过程是一个可逆的过程,越容易发生凝胶化的样品溶液也就越容易发生逆凝胶化;另一方面与凝胶的弹性模量有关,从流变实验数据可知,与空白凝胶相比,微球的加入会降低凝胶的弹性模量,因此,在37 ℃和100 r/min的恒温摇床条件下,弹性模量较低的凝胶,更容易受外界作用力的影响,使其内部的网格结构遭到破坏,从而发生溶蚀现象。
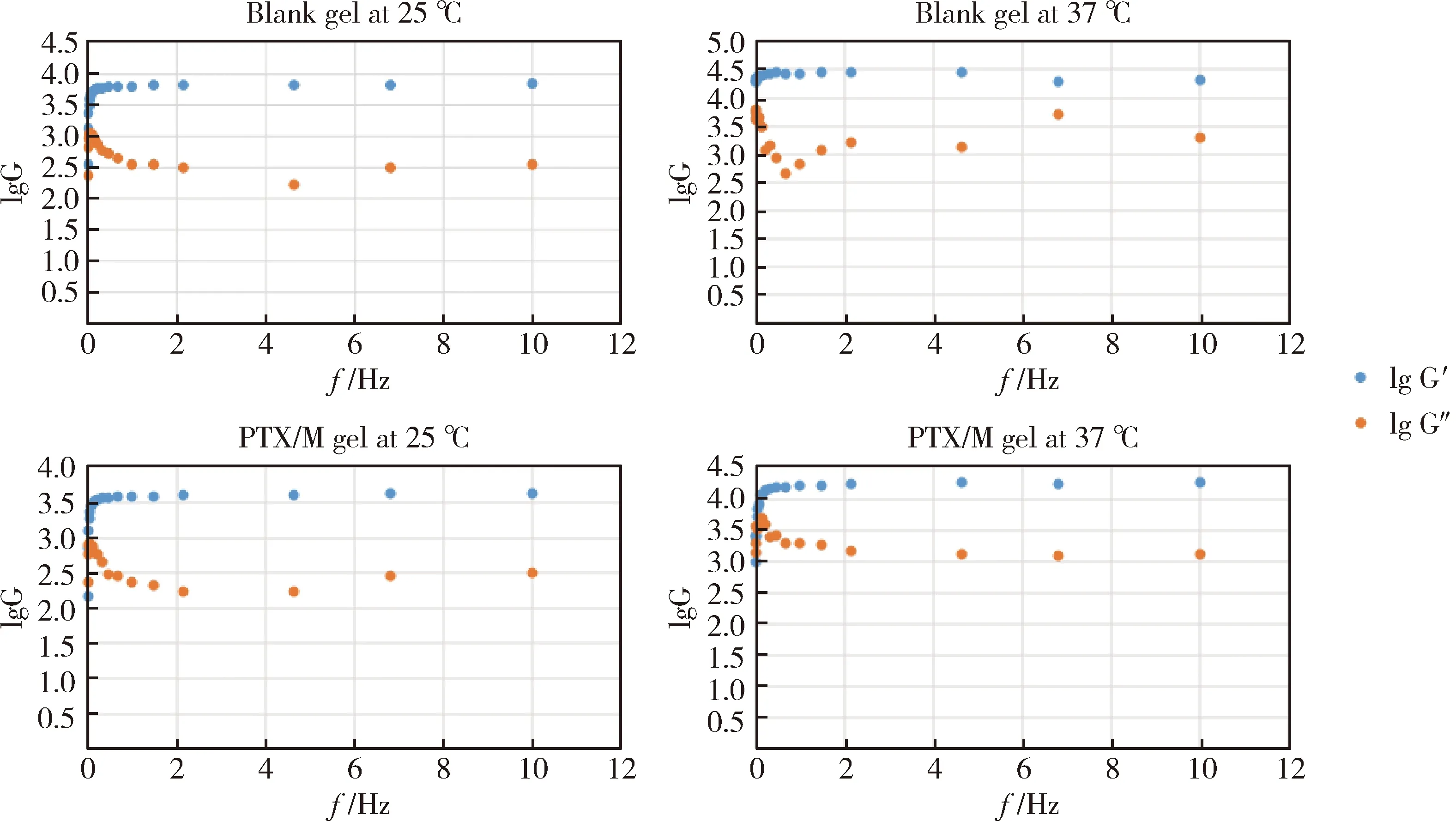
图4 空白凝胶和PTX/M gel在25 ℃、37 ℃时的模量变化Figure 4 Modulus of blank gel and PTX/M gel at 25 ℃, 37 ℃
PTX/M gel的释放曲线以及“释放-溶蚀”相关性考察如图6所示,PTX/M gel中PTX/M因为自身的重量在溶液形成半固体凝胶之前有一定的沉降,所以在凝胶中不能完全分布均匀,凝胶底部中分散的微球比凝胶顶部多,因此,可以看到随着凝胶的溶蚀,PTX/M的释放速率后期高于前期,如果不考虑微球沉降带来的影响,PTX/M gel的累积释放百分比和累积溶蚀百分比基本上呈线性相关,说明凝胶中PTX/M的释放主要是通过凝胶溶蚀来实现。
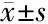
PTX/M, paclitaxel microspheres. Data are presented as the (n=3).图5 Blank gel和PTX/M gel的体外累积溶蚀百分率Figure 5 Accumulated erosion of blank gel and PTX/M gel
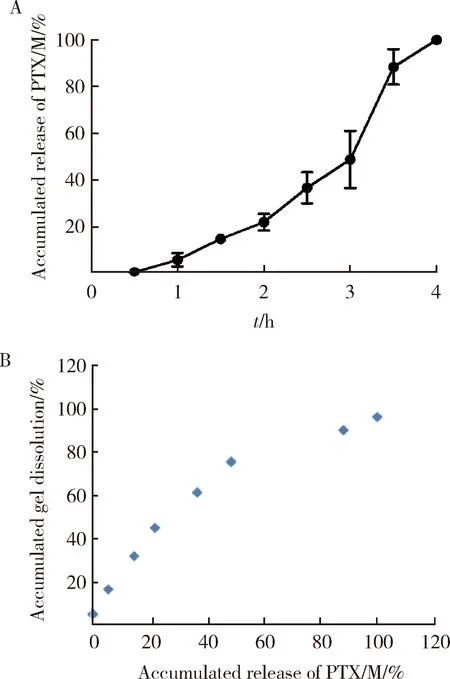
PTX/M, paclitaxel microspheres. Data are presented as the (n=3).图6 PTX/M从PTX/M gel中的累积释放百分率(A)和溶蚀-释放相关曲线(B)Figure 6 Percentage of cumulative release of PTX/M from PTX/M gel (A) and correlation between PTX/M gel release and dissolution (B)
2.7 通针性与体内滞留时间
对凝胶的通针性考察结果如图7所示,台盼蓝标记的生理盐水在注射后立即扩散,而凝胶溶液在注射后立即形成了半固体状凝胶,随后沉积在玻璃小瓶的底部。对凝胶体内滞留时间的考察结果如图7C所示,与注射等量台盼蓝标记的生理盐水组相比,凝胶在注射部位缓慢消除,存留时间可达48 h,生理盐水在注射后的2 h基本消除完全。
2.8 抑制U87 MG肿瘤生长效应和安全性评价
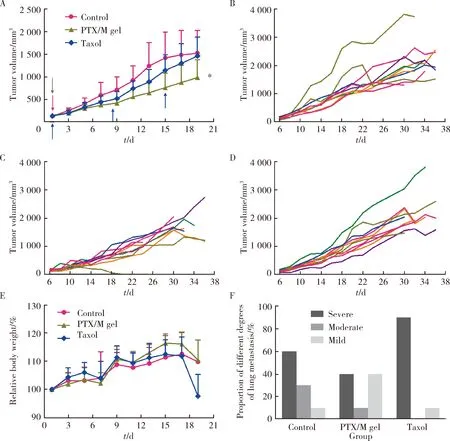
各组荷瘤裸鼠的肿瘤生长情况如图8A所示,对照组裸鼠肿瘤体积生长迅猛,治疗初期PTX/M gel组的疗效与Taxol组相当,治疗后期Taxol组在给药后的2~3 d裸鼠肿瘤体积出现回弹;从总体的趋势来看,PTX/M gel组一次给药对肿瘤生长的延缓效果与Taxol组多次给药的效果相当,甚至更优。图8B~D分别为各组裸鼠的相对体重变化、主要脏器的脏器系数和HE染色,可以看出,Taxol组裸鼠在治疗期间体重下降较多,说明Taxol造成了一定的毒副作用。通常脏器系数增大表示脏器充血、水肿或增生肥大等,脏器系数减小表示脏器萎缩及其他退行性改变,三组裸鼠的脏器系数无显著性差异,主要脏器的HE染色未发现肿瘤转移。
2.9 抑制4T1肿瘤生长效应和安全性评价
各组荷4T1瘤小鼠的肿瘤生长情况如图9A所示,对照组小鼠肿瘤体积增长最快,其次是Taxol组,PTX/M gel组在给药前期对4T1肿瘤生长的延缓作用与Taxol组相差不大,后期PTX/M gel组药效明显优于其他组。由此可见,PTX/M gel具有较好的缓释作用,能够实现在肿瘤部位持续缓慢释放PTX,并且PTX/M gel局部一次给药的疗效优于 Taxol 静脉多次给药。图9B~D分别为对照组、PTX/M gel组、Taxol组内各只小鼠的肿瘤生长曲线。
图9E是各组小鼠的相对体重变化,Taxol组小鼠在第3次给药后体重出现了明显的下降,这是由注射Taxol引起的毒副作用,其他组安全性相对良好。
图9F是对各组小鼠不同程度肺转移的统计,将肺部长出肉眼可见瘤的小鼠记作重度转移,将肺转移结节数≥15的小鼠记作中度转移,将肺转移结节数<15的小鼠记作轻度转移。由图可知,重度转移:Taxol组> 对照组> PTX/M gel组;中度转移:对照组> PTX/M gel组> Taxol组;轻度转移:PTX/M gel组>对照组和Taxol组。
2.10 防肿瘤术后复发的药效评价
用无瘤率(tumor free)来评价小鼠的术后复发情况,肿瘤切除后的当日,各组的无瘤率均为100%,当肿瘤再次长出并且体积超过50 mm3时,视作该小鼠出现了复发,对各组的无瘤率进行统计,结果如图10A所示,PTX/M gel组小鼠发生肿瘤复发的时间明显晚于对照组和Taxol组。图10B~D分别为对照组、PTX/M gel组和Taxol组小鼠术后肿瘤的生长情况,可以看出PTX/M gel组小鼠的肿瘤复发时间晚、肿瘤生长缓慢,说明即使复发后PTX/M gel组小鼠的肿瘤相比于其他组也得到了更好的控制。图10E是术后小鼠的生存曲线,总的来看PTX/M gel组小鼠的存活期比其他组更长。图10F是肺转移情况,重度转移:Taxol组>对照组>PTX/M gel组;中度转移:对照组和PTX/M gel组>Taxol组;轻度转移:PTX/M gel组>对照组>Taxol组。

图7 台盼蓝标记的生理盐水(A)和凝胶溶液(B)注射到37 ℃水浴中的变化;台盼蓝标记的原位凝胶不同时间点时在小鼠皮下的停留情况(C)Figure 7 Changes of saline (A) and gel (B) labeled with trypan blue were injected into water at 37 ℃; Photographs of gel injected into the back of the mouse for 2 h, 4 h, 6 h, 12 h, 24 h, 48 h and control for 2 h (C)
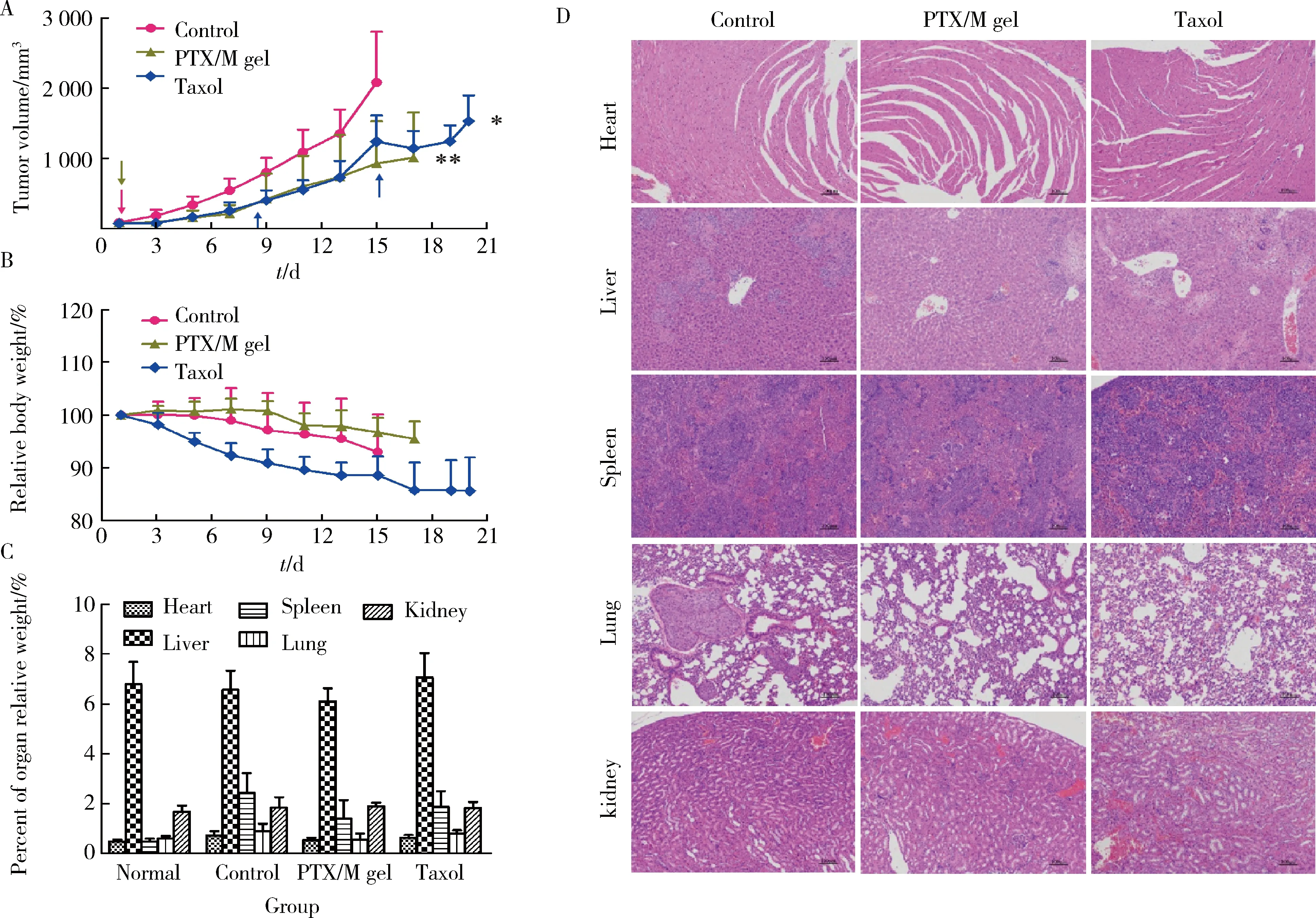
Data are presented as the (n=6).图8 A,荷U87 MG肿瘤裸鼠的肿瘤生长曲线(*P=0.02,**P=0.002,与对照组比较);B,裸鼠的相对体重变化;C,主要脏器的脏器指数(Normal组为没有荷瘤的裸鼠的脏器系数[12]);D,主要脏器的HE染色(100×)Figure 8 A, tumor growth curve of U87MG-bearing mice (*P=0.02, **P=0.002, vs. Control); B, relative body weight curve; C, percent of organ relative weight (Normal represents the organ index of normal nude mice[12]); D, HE staining of major organ tissues (100×)
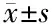
Data are presented as the (n=10).图9 A,荷4T1肿瘤小鼠的肿瘤生长曲线(*P=0.003,与对照组比较);B~D,对照组、PTX/M gel组和Taxol组内各只小鼠的肿瘤生长曲线;E,小鼠的相对体重变化;F,小鼠肺转移的统计Figure 9 A, tumor growth curve of 4T1-bearing mice (*P=0.003, vs. Control); B-D, tumor growth curve of each mouse in Control, PTX/M gel, Taxol groups; E, relative body weight-time curve of mice; F, proportion of different degrees of lung metastasis in mice
3 讨论
本研究制备了3种不同粒径大小的PTX/M,体外释放曲线显示粒径越小的微球释放得越快,这与其具有较大的比表面积有关,但同时粒径越小,微球对药物的包封率和载药量越低,因此,本研究选取中位粒径为(32.24±1.09) μm的PTX/M 10进行后续实验。本研究制备了PTX/M gel,当Poloxamer 407、Poloxamer 188的浓度分别为17.5%、 2.6%时,其相转变温度为33 ℃,基本能满足体外注射的需要。通过标记台盼蓝,可以发现凝胶在小鼠体内的滞留时间达48 h,而体外释放特性显示PTX/M在释放开始的0~2 d有轻微的突释现象,因此,凝胶能较好地弥补微球突释的缺陷,使药物的释放趋于平稳、缓慢。
PTX/M gel在U87 MG肿瘤和4T1肿瘤的治疗中均显示了较好的药效。由于微球和凝胶的缓释作用,使得PTX/M gel只需要给药一次就能达到Taxol给药三次的效果,甚至优于Taxol,并且降低了毒副作用。在防4T1肿瘤术后复发的研究中,因为PTX/M gel在瘤腔部位形成了储库,缓慢释放的PTX能够杀伤术后残留的肿瘤细胞,所以该组小鼠出现复发的时间比对照组和Taxol组都晚,即使在复发后肿瘤体积也得到了更好的控制。4T1是极易发生转移的肿瘤[13],通过对小鼠的肺转移情况进行统计,发现无论是否经历手术,小鼠均发生了不同程度的转移,PTX/M gel组小鼠发生轻度肺转移的比例较多,而Taxol组发生重度转移的比例最多,这可能因为Taxol组给药次数多、毒副作用大,使得小鼠状态差、免疫功能下降,所以当Taxol在体内完全消除以后,机体难以抑制肿瘤细胞的生长和扩散,而PTX/M gel组因为PTX的长期释放,对肿瘤细胞的转移起到了一定程度上的阻碍作用。
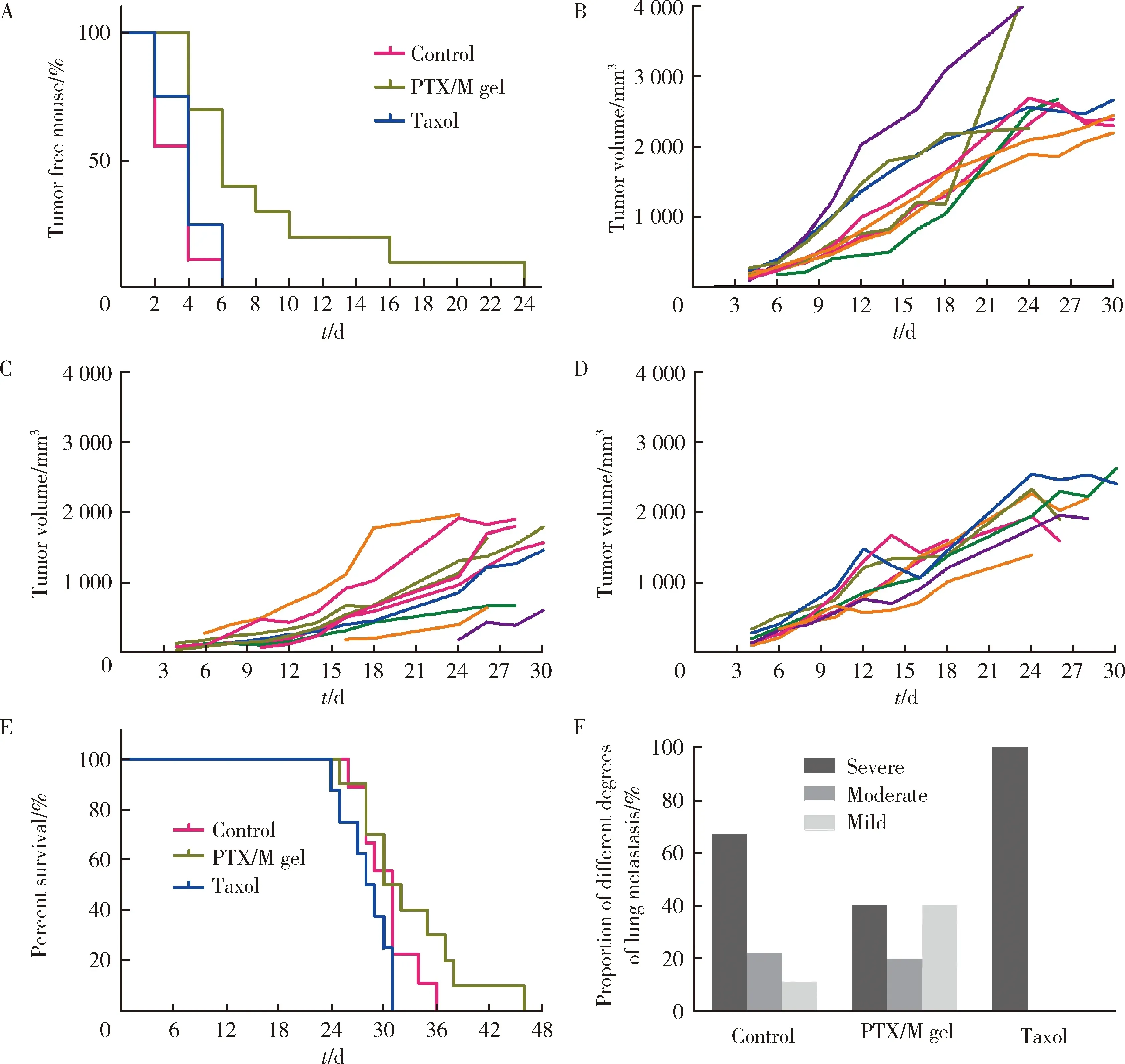
图10 A,小鼠术后的无瘤率;B~D,对照组、PX/M gel组和Taxol组的小鼠术后肿瘤生长曲线;E,小鼠术后的生存曲线;F,小鼠不同程度肺转移的统计Figure 10 A, tumor free rate after surgery in different drug-administered groups; B-D, tumor growth curve of each mouse after surgery in control, PTX/M gel, Taxol groups; E, survival curve of mice with surgery; F, proportion of different degrees of lung metastasis in mice
