荧光物质 (MFA、MFB) 的分离、结构鉴定及金华地区高产菌株的筛选
2019-06-16秦朝阳蒋湘艳李梦瑶朱梦圆金海如
秦朝阳, 蒋湘艳, 李梦瑶, 朱梦圆, 金海如
(浙江师范大学 化学与生命科学学院,浙江 金华 321000)
随着对红曲菌活性代谢产物的深入研究,越来越多的红曲菌产品开发为药物或者医疗保健品。目前陆续有多种洛伐他汀类药物上市,这种药物具有降血脂功效,主要是抑制HMG-COA限速酶的活性,该还原酶活性如果被抑制,胆固醇合成所需要的前体物质就会阻断,从而影响胆固醇的合成[1]。1987年,美国FDA(Food and Drug Administration)允许Lovastatina和Mecatoe药品上市之后,Sinmvastatin、Pravastatin、血脂康等药品相继上市[2]。红曲菌还有其他方面的作用,红曲中含有的麦角固醇,在紫外线照射下发生光化学反应产生维生素D2,可作为防治幼儿佝偻病药物的材料[3]。此外,随着对GABA生物活性的研究,GABA的降血压抗疲劳作用逐渐被发现,使开发研究新的降血压药物成为可能[4]。虽然红曲中已有较多的活性代谢产物被分离和鉴定,如淀粉酶、红曲色素、洛伐他汀、γ-氨基丁酸、桔霉素等,但关于红曲中的荧光代谢物的报道较少[5-8]。目前红曲米中被发现的荧光物质主要是monasfluore A (MFA)、monasfluore B (MFB),其作用是能够抑制细胞凋亡,并且抑制肝癌细胞和肺癌细胞生长,可作为抗癌光敏剂,还具有降脂和抗氧化功能。郑允权等研究表明MFA、MFB能够预防和治疗阿尔茨海默氏症,能够良好地抑制细胞凋亡,包括Aβ1-42细胞、神经细胞、正常人体的低毒细胞。MFA、MFB可用于抗癌光敏剂,对人体正常细胞毒性低副作用小[9-11]。研究表明MFA、MFB对肝癌细胞、肺癌细胞抑制作用较强,对二倍体细胞抑制作用较弱。MFA、MFB对肝癌细胞半抑制量分别是12.4 μg/mL和7.1 μg/mL;对肺癌细胞半抑制量分别为16.3 μg/mL和10.6 μg/mL[12]。MFB对细胞抑制效果明显高于MFA,这可能与它们的侧链结构不同有关,Yeh等[13]在小鼠体内分别测试了红曲米和MFA、MFB的降脂和抗氧化功能,结果表明检测指标都有所降低,但是MFA、MFB比红曲米更有效;Paul等[14]发现MFA对于Hela和PC3细胞具有抗癌效果,MFA对于PC3细胞有更强的细胞毒性,对于Hela细胞毒性较弱,这些研究均表明MFA、MFB有较好的应用前景。金华地区红曲资源丰富,而且很早便开始使用红曲菌酿造黄酒,但是缺少对该地区红曲菌产荧光物质的分离和鉴定的研究[20]。本研究对开发及利用红曲菌具有重要研究意义。
1 材料与方法
1.1 材料
1.1.1 实验菌种 采自金华及其周边地区的10种红曲米。
1.1.2 培养基(g/L) PDA培养基:马铃薯200,蔗糖20,琼脂粉20,pH自然;种子培养基:马铃薯200,蔗糖20,pH自然;斜面培养基:蛋白胨15,麦芽糖50,琼脂粉30,pH自然;发酵培养基:大米40。
1.1.3 试剂 MFA、MFB标准品 (自制);乙腈 (色谱纯)、甲醇 (分析纯)、蔗糖 (分析纯)、琼脂粉(分析纯)、蛋白胨(分析纯)、麦芽糖 (分析纯)、乙腈 (色谱纯)、石油醚 (60~90 ℃,分析纯),均购自金华医药;薄层层析板采用G-254硅胶板,购自青岛海洋化工厂分厂;柱层析硅胶 (化学纯), 购自青岛谱科分离材料有限公司。
1.1.4 仪器与设备 EYELAN-1100旋转蒸发仪,购自上海爱朗仪器有限公司;CCA-1111冷却水循环装置,购自上海爱朗仪器有限公司;SB25-12YDTD超声波清洗器,购自宁波新芝生物科技股份有限公司;冷冻高速离心机,购自费默飞世尔科技 (中国) 有限公司;紫外可见分光光度计,购自上海美谱达仪器有限公司;LC 218制备型液相色谱仪、Agilent 1260型高效液相色谱仪、G 6230 AA高分辨飞行时间质谱仪,均购自美国Agilent公司;Triple TOF 4600超高效液相高分辨质谱联用仪,购自日本岛津-美国ABSciex。
1.2 方法
1.2.1 红曲米样品的提取 用搅拌机将红曲米研碎,称取0.25 kg研碎后的红曲米放入1.0 L烧杯,加入0.5 L 95%乙醇,超声提取30 min,过滤得滤液,残渣用200 mL 95%乙醇提取2次,合并滤液,将滤液放在烧瓶中60 ℃旋转蒸发浓缩至无水残留后,再加入V(石油醚)∶V(乙酸乙酯)∶V(丙酮) = 8∶1∶1的混合液复溶,过滤,得到初提物,硅胶柱层析分离备用,通过薄层层析检测提取效果[14]。
1.2.2 硅胶薄层层析分析 薄层层析板采用硅胶GF 254,切成5 cm×10 cm规格,用毛细管吸取红曲米提取液在距离板下1 cm处点样,分别采用V(石油醚)∶V(乙酸乙酯)∶V(丙酮)=15∶1∶1、10∶1∶1、8∶1∶1的展开剂展开20 min,层析结束后,取出薄板自然晾干,紫外灯 (λ=365 nm) 观察,确定荧光物质所在部位,计算Rf值。
1.2.3 硅胶柱层析分离 称取15~20 g硅胶,用V(石油醚)∶V(乙酸乙酯)∶V(丙酮)=15∶1∶1 浸泡,拌匀湿法装柱,静止压实3 h后上样,加入无水硫酸钠防止样品被展开剂冲破,而且吸收洗脱剂中少量的水分,依次用V(石油醚)∶V(乙酸乙酯)∶V(丙酮)=15∶1∶1、10∶1∶1、8∶1∶1洗脱。随时用紫外灯监控蓝色荧光物质洗脱位置,待其洗脱至柱底后,分别接收洗脱液,40 ℃旋转蒸发浓缩得到浓缩物,并用薄层层析检测浓缩物[15]。
1.2.4 用制备型液相色谱纯化MFA、MFB 由硅胶柱分离到的荧光组分经有机滤膜过滤,进一步用制备型液相色谱纯化,色谱柱:Agilent Prep-C18 (21.6 mm×250 mm;10 μm);流动相采用甲醇∶水=70∶30的固定比例;柱温控制在25 ℃;检测波长380 nm;进样量5 mL,流速为2.5 mL/min。
1.2.5 两种蓝色荧光物质的鉴定 ①HPLC (高效液相色谱)分析:用带有荧光检测器的HPLC对硅胶柱制备的两种荧光物质进行纯度检测,色谱条件:流动相A为乙腈 (色谱纯),B为纯水,流动相分别用0.45 μm有机相滤膜和水相滤膜过滤,选用Thermo C18 (4.6 mm×250 mm;50 μm) 色谱柱;A∶B = 77%∶23%,检测波长λex=396 nm,λem=460 nm;流速:1 mL/min;进样量:10 μL。②ESI-HRMS (高分辨飞行时间质谱仪)分析:将制备的两种蓝色荧光物质溶于甲醇,采用高分辨飞行时间质谱仪分析,并用分析软件检索分析其分子量,推导出化合物C、H、O和N等元素情况,质谱条件:ESI电离源,正离子模式。③ESI-MS/MS (电喷雾二级串联质谱)分析:将做完ESI-HRMS的样品再进行ESI - MS/MS检测,使用ESI正离子源电离。
1.2.6 红曲菌的分离纯化 将不同样品红曲米研碎过100目筛,准确称取2.0 g红曲米粉加入10 mL无菌水中,制成原液,将原液作10-2、10-3、10-4、10-5、10-6稀释并涂布于PDA平板,30 ℃培养1周左右[16]。根据平板上菌落长势情况,挑选不同的纯的菌落划线培养,直至出现单菌落[17],将所得菌株编号,转接在斜面培养基上4 ℃保存备用。
1.2.7 红曲米的制备 ①固态发酵生产红曲米:大米 → 浸泡过夜 → 清洗→ 灭菌 → 冷却至室温 → 接种种子液 → 固体培养 → 红曲米 → 测MFA、MFB含量。②种子液制备:在超净工作台上,用接种环挑取两环菌株,接种到装有50 mL培养基的三角瓶中,130 r/min,30 ℃摇床培养,直到培养基变红,得到种子液。③大米的处理:将大米装入1 L烧杯,自来水洗涤2~ 3次,浸泡过夜,40目筛沥干,称取40 g分装于250 mL的锥形瓶。121 ℃灭菌30 min,冷却至室温,待接种。④大米发酵[18]:在超净工作台里将灭菌的大米振荡松散,用已灭菌消毒的移液枪分别加入10% (质量分数) 的种子液,充分摇匀,30 ℃培养,发酵4 d后,每瓶补无菌水一次,振荡摇匀,共发酵12 d。
1.2.8 红曲米中两种荧光物质(MFA、MFB) 的HPLC定量测定 ①MFA、MFB标准溶液配置:用甲醇配制成10 、20、30、40 mg/L的MFA、MFB标准溶液。以峰面积 (A) 为纵坐标,质量浓度 (mg/L) 为横坐标,得到MFA标准曲线:y = 45.731x-8.445 6,R2=0.995 8;MFB标准曲线:y=41.209x-49.379,R2=0.989 5。②红曲米样品的提取:将发酵的红曲米研碎,称取0.5 g放入10 mL离心管,加入5 mL甲醇,超声波提取30 min,自然澄清,过滤得到上清液,将残渣用同样方法提取2次,合并上清液,取一定量上清液过0.45 μm滤膜,待检测。③色谱条件:色谱柱:Thermo C18 (4.6 mm×250 mm;5 μm) ;柱温25 ℃;流动相:V(乙腈)∶V(水)=77∶23;检测器:荧光检测器 (λex=396 nm,λem=460 nm) ;流速:1 mL/min;进样量:10 μL。
1.2.9 高产MFA、MFB菌株的分子生物学鉴定 将纯化的红曲菌落平板寄往上海生工生物工程股份有限公司进行测序。测序结果在GenBank中进行核酸序列比对,分析ITS序列同源性,利用MEGA 5软件构建系统发育树,鉴定目的菌株的种类以及其分类地位。
2 结果与分析
2.1 红曲米样品荧光物质的提取
将0.25 kg红曲米粉溶于95%的乙醇中提取30 min,通过薄层层析检测滤液,发现两种荧光物质被提取出来,红曲米残渣中两种荧光物质的含量还很高,继续用95%乙醇提取2~3次,大部分的荧光物质被提取,提取液进行柱层析。
2.2 荧光物质的薄层层析分离
采用极性从小到大的展开剂(V(石油醚)∶V(乙酸乙酯)∶V(丙酮)=15∶1∶1、10∶1∶1、8∶1∶1)分离荧光物质,当极性为15∶1∶1时两种荧光物质分离效果不是很好,使用较大极性的8∶1∶1的溶液作为展开剂,可以使荧光物质很好地分离,点样量会影响条带的清晰程度,当点样量过大时硅胶板上的条带变宽,两种荧光物质斑点界线不明显,点样量过小条带不清楚,当点样量为0.5 mg时,两种荧光物质分离效果明显。如图1A所示,第一个荧光物质组分的Rf=0.5,第二个荧光组分的Rf=0.28。

图1 红曲米提取液中荧光物质的薄层层析图
2.3 硅胶柱层析纯化两种荧光物质
洗脱液极性对分离效果影响较大,故没有采用单一极性的洗脱液。本研究采用不断改变极性的洗脱液V(石油醚)∶V(乙酸乙酯)∶V(丙酮)=15∶1∶1、10∶1∶1、8∶1∶1洗脱荧光物质,洗脱顺序依次为黄色素、第一种荧光物质、黄色素、第二种荧光物质,顺序与硅胶板的条带一致。当用小极性洗脱液洗脱时各种成分分离较慢,各种成分已经分开但不明显,为此采用极性大的洗脱液,使各种成分彻底分开。收集两组荧光组分,通过薄层层析对两组荧光物质进行纯度分析,如图1B所示,结果表明两种荧光物质没能彻底分开,故还须分离纯化。
2.4 制备型色谱仪分离纯化荧光物质
用制备型液相色谱仪进一步分离纯化两种荧光物质,收集12.1 min和24.6 min的洗脱峰位置。两组荧光组分在365 nm紫外灯照射下能够产生蓝色荧光 (图2) 。然后在旋转蒸发仪上蒸发掉多余的液体,得到纯化的两种荧光物质,为黄色油状物。将所得两种荧光物质经HPLC纯度分析,用于结构鉴定。
图2 不同光照下荧光物质
2.5 HPLC分析荧光物质
用带有荧光检测器的HPLC检测所制得的两种荧光物质,结果如图3所示。制备的两种荧光物质在保留时间2 min左右都含有少量杂质峰,但是不影响检测结果。第一种荧光物质出峰时间为6.72 min,峰形好,检测信号强,杂质少。第二种荧光物质的出峰时间为11.02 min,检测效果好,两种荧光物质纯度均较高。
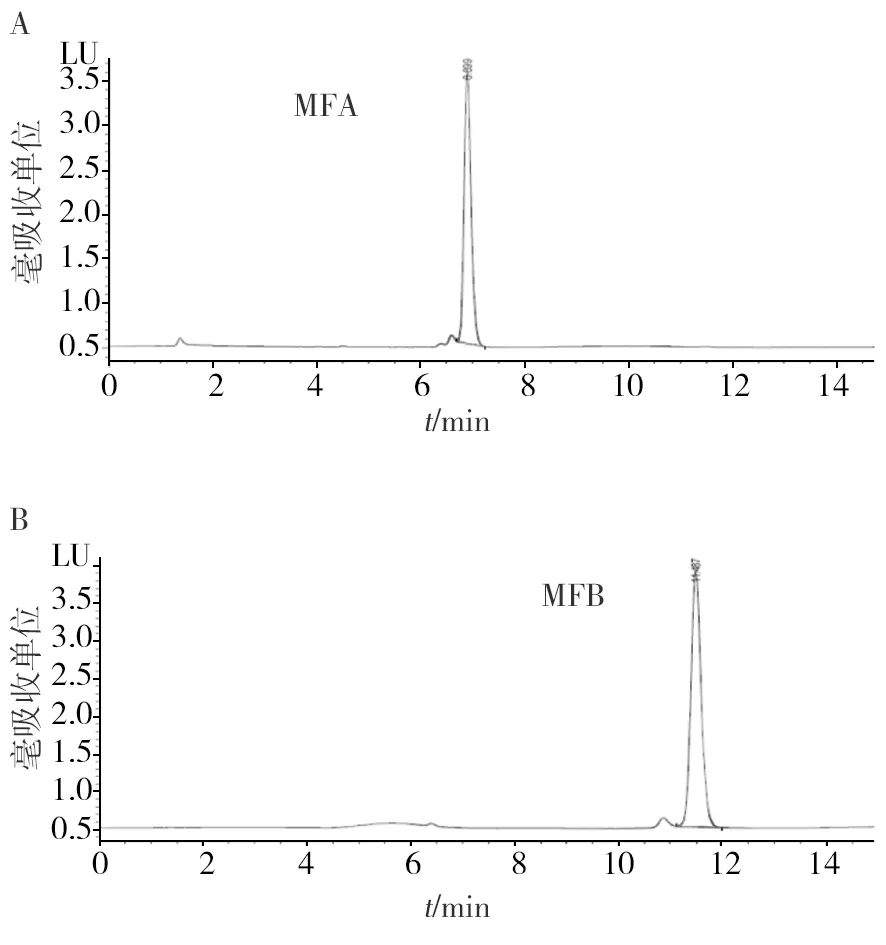
图3 MFA、MFB标准品色谱图
2.6 ESI-HRMS 分析荧光物质
ESI是一种使用较为普遍的电离方式,即便是相对分子质量大,稳定性差的化合物,也不会在电离过程中发生分解,其最大特点是能够形成多电荷离子,为研究天然化合物提供一种简单快捷灵敏的检测方法。高分辨率质谱是一种有高分辨能力的新型质谱仪,不仅可以对已知物质进行鉴定,还能对未知物精确测定其由C、H、O、N、S组成比例。如图4A所示,m/z = 357.172 1为化合物的[M+H]+离子峰,m/z = 379.153 9为化合物[M+Na]+准离子峰。从图4B可知,m/z = 385.203 9为另一种化合物的[M+H]+准分子离子峰,m/z = 407.185 9为化合物[M+Na]+准离子峰。由表1可以看出,两种荧光物质的分子量分别为356、384,计算出分子式为C21H24O5、C23H28O5。两者分子量相差28,后者可能比前者碳链长度多了一个[-CH2CH2-]基团。
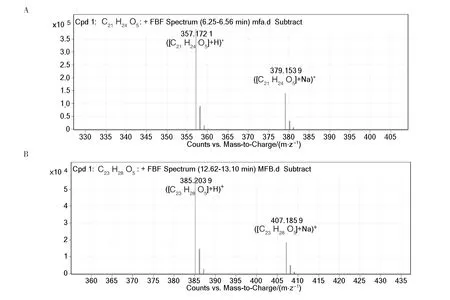
图4 两种荧光物质的高分辨率质谱图
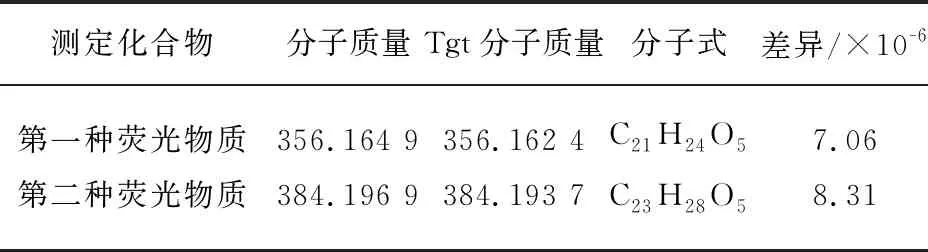
表1 两种荧光物质的HRMS分析
2.7 ESI-MS/MS分析荧光物质
采用ESI-MS/MS分析两种荧光物质样品,结果如图5所示,第一种基峰357.169 6为[M+H]+,第二种基峰385.201 5为[M+H]+,与高分辨飞行时间质谱仪分析结果一致,通过对两种物质基峰的二级质谱分析,第一种荧光物质出现了285.183 3、241.087 8、185.095 8、172.087 5等碎片离子峰,第二种荧光物质出现了313.216 4、259.097 0、241.086 8、185.097 2、172.089 1等离子峰。这与文献[19]报道一致,将化合物1鉴定为monasfluore A (MFA),将化合物2鉴定为monasfluore B (MFB) 。结构式如图6所示。
2.8 不同红曲菌发酵红曲米的MFA、MFB含量
由图3可知,MFA、MFB标准品的保留时间分别为6.769 min、11.024 min,杂峰较少,杂峰面积小,不影响检测结果,标准品峰形好,说明此方法可以较好地检测出红曲米中MFA、MFB的含量。检测结果如表3,不同红曲菌发酵的红曲米MFA、MFB含量差别很大,其中菌株YKLSZ的MFA、MFB含量最低分别仅为0.29 g/kg、1.41 g/kg。菌株WZWZ的MFA、MFB含量最高分别可达3.63 g/kg、7.29 g/kg,筛选出MFA、MFB产量高的菌株WZWZ。
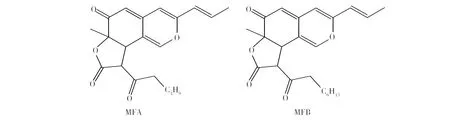
图6 MFA和MFB的化学结构式
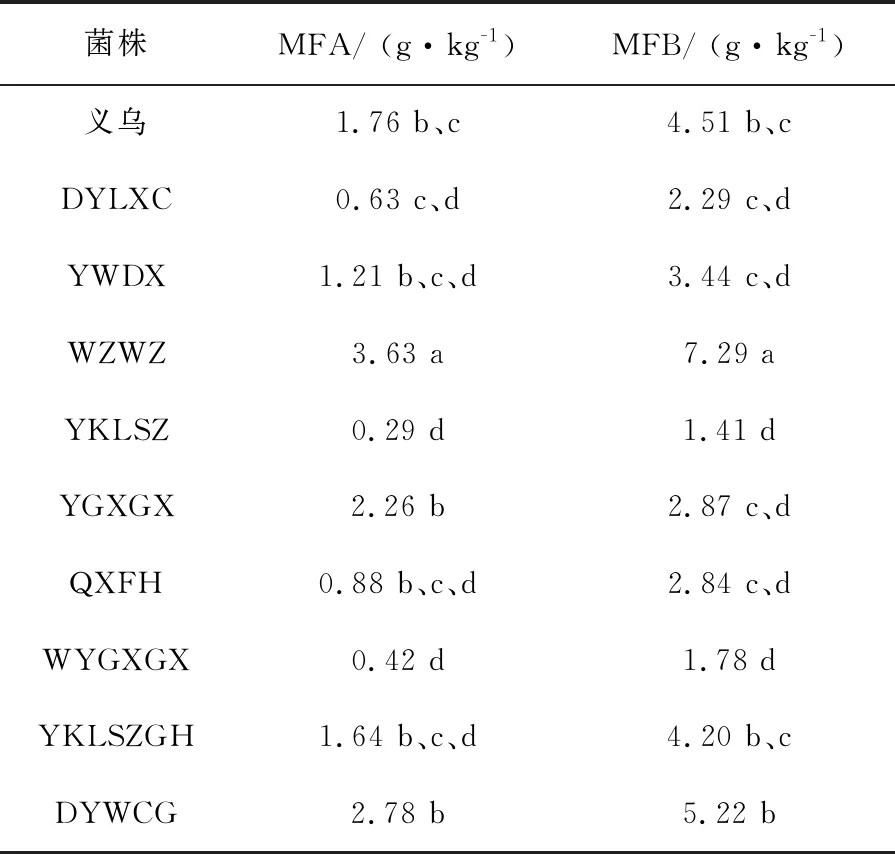
表3 不同红曲菌发酵后大米中MFA和MFB的含量
注:MFA、MFB含量为3次测定的平均值,差异显著性经Duncan′s新复极差法检验,不同字母表示在P≤0.05水平上差异显著性
2.9 高产MFA、MFB红曲菌株的分子鉴定
将上海生工测序得到的碱基序列,按照1.2.9的方法进行鉴定,最终将WZWZ菌株鉴定为紫色红曲霉 (Monascuspurpureus)。
3 讨 论
本研究得到两种荧光物质MFA、MFB,通过高分辨质谱计算出分子式为C21H24O5、C23H28O5。两者分子量相差28,后者可能比前者碳链长度多了一个[-CH2CH2-]基团。郑允权等[9]研究表明MFA、MFB能够预防和治疗阿尔茨海默氏症,能够良好地抑制细胞凋亡,包括Aβ1-42细胞、神经细胞等。不同红曲菌株产MFA、MFB能力有很大不同,黄志兵等[14]利用电喷雾质谱等方法研究了这两种化合物的结构并得到它们的化学式,与本研究基本一致。不同的是其实验筛选得到的红曲菌产MFA、MFB最高为81.4 g/kg、26.3 g/kg,而本研究筛选到的一些红曲菌MFA产量最高仅为3.63 g/kg,MFB产量最高仅为7.29 g/kg,可能是由于气候、地区与菌种不同,具体原因有待研究。国内外文献尚未对提高红曲米中荧光物质的产量做进一步探索,有必要采用诱变及基因工程等手段提高荧光物质产量。
