氟代吡啶甲酸解离的环金属铱配合物及其电致化学发光性能
2019-06-14胡媛媛童碧海张千峰周会东
潘 淼,胡媛媛,张 曼,童碧海,张千峰,周会东,时 鹏
(安徽工业大学冶金工程学院,分子工程与应用化学研究中心,冶金减排与资源综合利用教育部重点实验室,安徽马鞍山 243002)
1 引 言
环金属铱配合物由于具有容易制备、稳定性好、发光波长和效率易于调节等诸多优点,在有机电致发光(OLED)、传感等领域得到越来越多的应用[1-2]。吡啶-2-甲酸(PIC)配体的配位能力强,在温和条件下就能解离环金属铱二氯桥中间体,高产率地生成中性铱配合物,而且产物的稳定性也比乙酰丙酮等辅助配体生成的中性铱配合物强,因此这类配合物的研究应用极为广泛,比如含PIC的中性铱配合物FIrpic就是一种经典的蓝色磷光材料[3]。对PIC配体的修饰能调节铱配合物的发光性能,例如,用4-二甲胺基PIC生成的铱配合物N984,其电致发光光谱的半峰宽只有70 nm,且光色接近PAL制标准绿色的光色[4]。王世民等研究了PIC上5位的三氟甲基对铱配合物光电性能的影响[5]。湘潭大学朱卫国教授在吡啶羧酸修饰方面做了大量工作,他们将电子传输单元噁二唑通过偶联反应接到PIC辅助配体上,所制得的铱配合物比未修饰的铱配合物有更好的光电性能,制备出的聚合物电致发光二极管的最大流明效率达到7.7 cd/A[6]。而将三苯胺偶联到PIC上后,配合物表现出增强的MLCT电子跃迁吸收和低的氧化电位[7]。他们还通过非共轭的醚键,将各种功能基团连接到PIC上,并制备了聚合型铱配合物,这些材料均表现出优良的发光性能[8-9]。Lee等通过串联反应,在PIC衍生物与铱二氯桥反应时,将2乙氧基乙醇接到PIC配体上生成适于旋涂法制备OLED的新型铱配合物,旋涂器件的外量子效率能达到10.9%[10-11]。朱卫国等还用芴基或三苯胺基修饰上两个PIC,获得蓝光发射的配体,配体再与铱二氯桥反应生成双核铱配合物,实现了高效单发光层的白光OLED器件,为简化白光器件的制备提供了重要思路[12-13]。
电致化学发光(ECL)是一种具有很高灵敏度的分析方法,具有可忽略的背景干扰、测试方便、需要样品量少等优点,广泛应用于多种底物的超敏分析[14]。常用的配合物发光试剂为Ru(bpy)23+,但铱配合物作为ECL发光试剂的研究较少,然而在溶液中,铱配合物的光致发光效率比钌配合物要高得多,因此铱配合物在ECL的应用中有较好的应用前景[15]。本课题组长期研究环金属铱配合物的电致化学发光性质[16-20],并获得了良好的效果,例如合成的一些离子型铱配合物对色胺酸有较好的选择性识别效果好,最低检测限达到8.2×10-8mol·L-1,而制备的中性铱配合物则对半胱氨酸选择性识别效果,最低检测限达到了6.9×10-10mol·L-1。这些结果表明,铱配合物有很好的ECL性能。
氟原子是电负性最大的原子,发光分子用氟原子修饰后能降低发光猝灭,提高发光效率以及化学稳定性。在该背景下,本文用不同位置氟取代的PIC合成了系列铱配合物,研究了氟原子对其光物理性能的影响,并研究了这些铱配合物的电致化学发光性能,为其用于ECL分析提供了理论基础。
2 实 验
2.1 实验原料及主要设备
所用试剂均为市售分析纯产品,购买后直接使用。
采用Shimadzu UV-3600型紫外可见分光光度仪测试紫外-可见吸收光谱。采用Perkin Elmer LS55型荧光分光光度仪测试发光光谱;采用CHI1140B型电化学工作站测试循环伏安曲线。采用MPI-E型电致化学发光分析系统测试电致化学发光性质;采用岛津DTG-60H仪器测试热稳定性。采用Bruker AVANCE 400型核磁共振仪测试核磁共振。采用Thermo LCQ DECA XP型质谱仪测试质谱。
2.2 铱配合物的合成
准确称取2-苯基吡啶2.20 g(14.20mmol)和IrCl3·3H2O 2.00 g(5.68 mmol),放入两口圆底烧瓶中,加入10 mL去离子水和30 mL 2-乙氧基乙醇,氮气保护下升温至110℃并反应24 h,冷却至室温后析出固体,过滤后固体用去离子水和乙醇清洗后晾干,得铱二氯桥中间体,产率为76%。
将铱二氯桥中间体溶解于二氯甲烷中,加入2.5倍当量的吡啶-2-羧酸衍生物,加入乙醇和三乙胺混合液(V∶V=8∶1)作为溶剂,室温搅拌12 h,减压蒸除溶剂,用二氯甲烷/乙酸乙酯(V∶V=6∶1)在硅胶上柱层析得目标产物。
Ir(ppy)2(Pic)(Ir1):黄色固体,产率为71%。
1H NMR(CDCl3,400 MHz)δ9.24(d,J=5.2 Hz,1 H),8.34(d,J=8.0 Hz,1 H),8.80(d,J=6.8 Hz,1 H),7.78(d,J=4.4 Hz,1 H),7.83 ~7.91(m,4 H),7.71(t,J=8.0 Hz,1 H),7.60(d,J=8.0 Hz,1H),7.48(d,J=5.2 Hz,1 H),7.13(t,J=8.0 Hz,1 H),6.93(t,J=6.8 Hz,2 H),6.76 ~6.84(m,2 H),6.87(d,J=8.0 Hz,1 H),6.42(d,J=8.0 Hz,1 H),6.19(d,J=8.0 Hz,1 H),5.93(d,J=7.2 Hz,1 H).13C NMR(CDCl3,100 MHz) δ167.72,167.67,149.09,149.00,148.43,148.03,144.18,144.03,139.28,137.58,137.18,137.12,132.54,132.49,132.36,130.91,130.03,129.61,128.85,128.26,124.37,127.97,122.23,124.12,121.62,121.98,119.08,121.09.MS((+)-ESI):m/z=624.384(calcd.624.126 for
Ir(ppy)2(3FPic)(Ir2):黄色固体,产率为70%。
1H NMR(CDCl3,400 MHz) δ8.76(d,J=5.2 Hz,1 H),8.35(t,J=4.8 Hz,1 H),7.87(dd,J=8.0,8.0 Hz,2 H),7.73(t,J=8.0 Hz,2 H),7.60(dd,J=7.6,7.2 Hz,4 H),7.49(d,J=5.6 Hz,1 H),7.15(t,J=6.4 Hz,1 H),6.95(t,J=6.4 Hz,2 H),6.87(t,J=7.6 Hz,1 H),6.82(t,J=7.6 Hz,1 H),6.75(t,J=7.4 Hz,1 H),6.40(d,J=7.6 Hz,1 H),6.17(d,J=7.6 Hz,1 H).19F NMR(CDCl3,377 MHz)δ- 118.39(s,1F).13C NMR(CDCl3,100 MHz) δ171.13,169.12,167.66,167.64,163.43,160.85,149.00,147.94,146.37,144.05,143.98,139.27,137.36,132.59,132.42,132.40,130.91,130.23,129.68,128.86,124.53,124.16,122.34,122.09,121.78,121.49,119.17,118.61.MS((+)-ESI):m/z=642.436(calcd.642.117 for
Ir(ppy)2(5FPic)(Ir3):黄色固体,产率为52%。
1H NMR(CDCl3,400 MHz)δ8.76(d,J=5.6 Hz,1 H),8.35(t,J=8.0 Hz,1 H),7.87(dd,J=8.0,8.0 Hz,2 H),7.73(t,J=7.6 Hz,2 H),7.60(dd,J=7.6,7.2 Hz,4 H),7.48(d,J=6.4 Hz,1 H),7.15(t,J=6.4 Hz,1 H),6.95(t,J=7.6 Hz,2 H),6.87(t,J=7.6 Hz,1 H),6.82(t,J=7.4 Hz,1 H),6.75(t,J=7.6 Hz,1 H),6.40(d,J=7.5 Hz,1 H),6.17(d,J=7.5 Hz,1 H).19FNMR(CDCl3,377 MHz) δ- 118.38(s,1F).13C NMR(CDCl3,100 MHz)δ169.11,167.64,148.99,148.11,147.95,146.40,144.06,144.01,137.37,137.17,136.87,132.59,132.40,130.22,130.10,130.03,129.67,124.72,124.53,124.17,122.36,122.34,122.13,122.10,121.77,121.48,119.17,118.62,118.40.MS((+)-ESI):m/z=642.859(calcd.642.117 for
Ir(ppy)2(2FPic)(Ir4):黄色固体,产率为60%。
1H NMR(CDCl3,400 MHz) δ9.25(d,J=4.4 Hz,1 H),8.28(d,J=7.2 Hz,1 H),8.72(d,J=5.2 Hz,1 H),7.68 ~7.75(m,4 H),7.87(d,J=8.0 Hz,2 H),7.55(d,J=6.8 Hz,1 H),7.59(d,J=8.4 Hz,1 H),7.02(d,J=8.4 Hz,1 H),6.86(dd,J=7.6,7.2 Hz,2 H),6.70 ~6.79(m,3 H),6.39(d,J=7.6 Hz,1 H),6.06(d,J=7.6 Hz,1 H).19F NMR(CDCl3,377 MHz) δ- 62.98(s,1F).13C NMR(CDCl3,100 MHz)δ168.72,168.64,168.57,151.71,148.75,148.59,143.73,143.70,142.73,137.28,136.17,132.57,131.51,130.59,129.75,129.33,129.10,124.09,123.86,123.66,122.17,122.12,121.83,121.32,120.58,119.17,118.47,118.39.MS((+)-ESI):m/z=642.097(calcd.642.117 for
Ir(ppy)2(dFPic)(Ir5):黄色固体,产率为59%。
1H NMR(CDCl3,400 MHz) δ8.71(d,J=5.6 Hz,1 H),8.14(d,J=8.4 Hz,2 H),8.01(s,1 H),7.87 ~7.98(m,3 H),7.79(d,J=8.0 Hz,1 H),7.73(d,J=8.0 Hz,1 H),7.57(s,1 H),7.39(t,J=7.2 Hz,1 H),7.17(t,J=6.4 Hz,1 H),6.92(t,J=8.4 Hz,1 H),6.75 ~ 6.86(m,2 H),6.69(t,J=6.4 Hz,1 H),6.39(d,J=7.6 Hz,1 H),6.14(d,J=7.6 Hz,1 H).19F NMR(CDCl3,377 MHz) δ-109.13(s,1F),-114.28(s,1F).13C NMR(CDCl3,100MHz) δ171.80,168.72,167.64,151.81,149.06,148.49,147.53,138.09,138.07,137.92,134.07,134.04,133.84,133.73,132.51,132.18,129.78,129.05,124.69,124.04,122.85,122.77,121.36,121.33,119.12,119.10,118.62,118.39.MS((+)-ESI):m/z=660.394(calcd.660.107 for
2.3 电致化学发光性能测试
铱配合物的电致化学发光性能在以下条件下测试:电压扫描范围1.1~1.7 V,扫描速率100 mV/s,光电倍增管高压设为800 V,工作电极采用直径2 mm的金电极,参比电极采用KCl溶液饱和的,辅助电极采用铂片电极,铱配合物的浓度为,共反应物三乙醇胺(TPA)浓度为,采用乙腈与水做溶剂水溶液采用浓度为 0.1 mol/L(pH=7.4)的磷酸一氢钾/磷酸二氢钾PBS缓冲液。在测试过程中,作为参照物,比较铱配合物的电致化学发光性能。
3 结果与讨论
3.1 铱配合物的合成与表征
如图1所示,铱配合物的合成分为两步:第一步是用2-苯基吡啶与三氯化铱反应生成铱二氯桥中间体,该中间体不用提纯可进行下步反应。第二步反应是用吡啶甲酸衍生物解离铱二氯桥中间体,因为吡啶甲酸衍生物的配位能力强,在弱碱三乙胺存在的条件下室温反应就可以高产率得到铱配合物,产率在50% ~70%之间。配合物的结构通过核磁共振氢谱和碳谱进行了表征,氢与碳的个数与理论值吻合,说明得到了正确目标产物。含氟的配合物还进行了氟谱测试,测得氟谱的化学位移在 -109.13 ×10-6~ -118.39 ×10-6之间,但Ir4的的化学位移有较大变化,向低场移动至-62.98×10-6,这主要是因为 Ir4在空间上非常接近2-苯基吡啶,受2-苯基吡啶芳环环流的去屏蔽效应,向低场移动。

图1 目标铱配合物的分子式及合成路线Fig.1 Structures and synthetic routes of target iridium complexes
3.2 铱配合物的光物理性能
铱配合物在乙腈(5×10-5mol/L)中的紫外-可见吸收光谱和光致发光光谱如图2所示。配合物的结构相似,因此其紫外-可见吸收光谱也非常相似,在350 nm以下的强吸收带是由配体自旋允许的1LC(π-π*)跃迁引起。从350 nm到可见光区的弱吸收带,则可归属为金属与配体之间的电荷转移(1MLCT),配体与配体之间的电荷转移(1LLCT),3MLCT、3LLCT 和配体中心的3π-π*跃迁。由于铱的重原子效应,高层的1MLCT跃迁通过自旋轨道耦合作用与自旋禁止的3MLCT、3LLCT和跃迁混合,从而使这些跃迁获得了可观的强度 。
由图2光致发光光谱可知铱配合物的发光均为绿光发射,配合物Ir1~Ir3的发射波长均为504 nm,配合物Ir4的波长为498 nm,相比于配合物Ir1~Ir3有5 nm左右的蓝移,这可能是因为Ir4的氟处在PIC配位氮原子的邻位,而氟原子[5]较大,由于位阻效应降低了PIC与铱原子的配位强度,相当于降低了共轭,从而使发光有所蓝移。配合物Ir5的发射波长为516 nm,相比于配合物Ir1~Ir3则有12 nm左右的红移,这可能是因为Ir5上有两个氟原子,氟原子强烈的拉电子效应使配合物的能隙降低所致。以[Ru(bpy)3]Cl2为标准物(Φstd=0.062),测试了系列铱配合物在乙腈中的光致发光量子效率(Φem),其中配合物Ir1量子效率最高,达到32%,而Ir4的量子效率最低只有6%,其他铱配合物的量子效率在13% ~16%之间,相关数据列于表1。这说明氟取代使发光量子效率有所降低,而尤其以2位取代的降低最为明显,主要是因为2位取代位阻较大,降低了配位的稳定性,从而使非辐射跃迁增加明显。
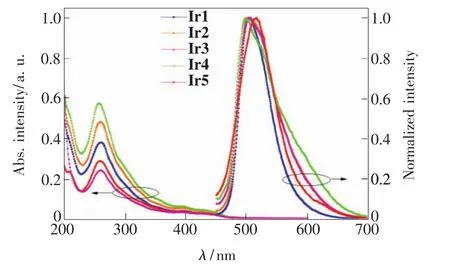
图2 铱配合物的紫外-可见吸收光谱及发光光谱Fig.2 UV-Vis absorption and photoluminescence spectra of the iridium complexes

表1 配合物的光物理数据Tab.1 Summary of photophysical properties of all complexes
3.3 配合物的电化学性能
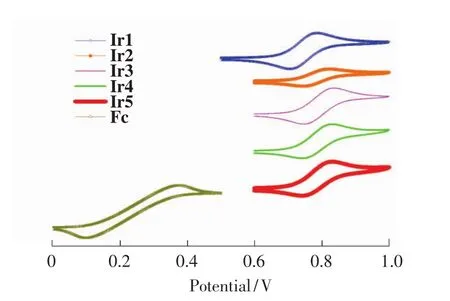
图3 二茂铁和铱配合物在二氯甲烷溶剂中的循环伏安曲线Fig.3 Cyclic voltammograms of ferrocene and iridium complexes in CH2 Cl2
用循环伏安法测试了铱配合物的电化学性能。从图3可知,配合物的氧化均为准可逆过程,引入氟原子后氧化电位都有所增加,单氟取代的氧化电位由511 mV分别增加到547 mV(Ir2)、554 mV(Ir3)和551 mV(Ir4),而双氟取代的配合物Ir5其氧化电位增加最大,达到574 mV。氧化电位与最高已占轨道(HOMO)对应,可知氟原子引入不同程度地拉低了HOMO轨道能级,结合紫外吸收边计算的能级差(Eg),可以推算出最低未占轨道(LUMO)能级也被氟原子拉低了(计算结果详见表1),但总的结果是Ir2和Ir3与Ir1的能隙差相当,Ir4的能隙差增加,Ir5的能隙差减小,与发光光谱的规律一致。
3.4 配合物的热稳定性
环金属铱配合物作为光电材料应用时,其热稳定性能相当重要。配合物的热重分析曲线如图4所示,从结果可以看出,参比配合物Ir1的5%失重温度(T5%)只有142℃,氟取代后配合物的热稳定性均有所增加,Ir2、Ir4和Ir5的T5%增加到180℃以上,而Ir3的T5%更是增加到380℃,说明氟取代对提高配合物的热稳定性非常有效。
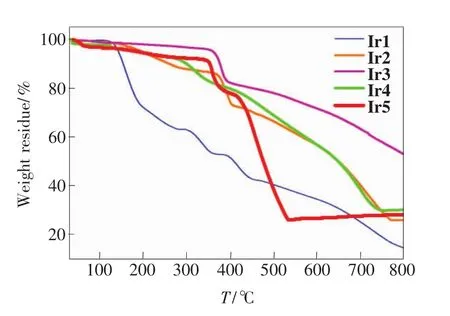
图4 铱配合物的热重曲线Fig.4 Thermogravimetric analysis of iridium complexes
3.5 配合物的电致化学发光性质
为研究铱配合物在电致化学发光方面应用的潜力,研究了电化学发光强度随电压的变化(图5),从图中可以看出,配合物只在正电位时发光,且与Ru(bpy)32+发光电位不同。参照物Ru(bpy)32+的最大发光电位在1.28 V,铱配合物的最大发光电位均比Ru(bpy)32+的高,在 1.34 ~1.44 V 之间。参照物[Ru(bpy)3]2+的电致化学发光强度为793,铱配合物的发光强度均低于Ru(bpy)32+,其中没有氟修饰的配合物Ir1的发光强度为332,氟修饰的配合物Ir2、Ir3和Ir5的发光强度分别为370,333和357,均比Ir1强度高,虽然这几个配合物的光致发光量子效率低,但电致化学发光性能好,说明这些配合物的电活性高,因此氟取代对于提高电致化学发光强度是有利的。而配合物Ir4的发光强度只有203,这主要是由于其光致发光量子效率太低导致的。

图5 铱配合物和[Ru(bpy)3]2+在乙腈/水溶剂中的ECL曲线Fig.5 ECL curves of iridium complexes and [Ru(bpy)3]2+in acetonitrile/H2 O solvents
4 结 论
本文合成了一系列氟取代吡啶甲酸解离的环金属铱配合物,通过核磁、质谱等表征了配合物结构,并研究了氟取代对其光物理等性能的影响。结果表明,配合物均为绿光发射,氟取代降低了配合物光致发光的量子效率,而尤其以2位取代的降低最为明显,同时氟取代还拉低了配合物的HOMO和LUMO能级,但拉低程度不同。但氟取代能提高配合物的热稳定性,最大能从142℃提高到380℃。应用于电致化学发光时,除2位取代外,氟取代都能增加其电致化学发光强度。以上研究表明氟取代吡啶甲酸配体在提高铱配合物的热稳定性和电致化学发光性能方面有一定优势,值得深入研究以开发综合性能优异的新型发光材料。
