藻类与微生物添加对高陡边坡生物结皮人工恢复的影响
2019-06-14鞠孟辰卜崇峰王清玄白雪强李亚红韦应欣
鞠孟辰, 卜崇峰,, 王清玄, 白雪强, 李亚红, 郭 琦, 韦应欣
(1.西北农林科技大学 水土保持研究所, 陕西 杨凌 712100; 2.中国科学院 水利部 水土保持研究所, 陕西 杨凌 712100)
作为旱区生态系统中重要的活性地被物,生物结皮(biocrusts, BSCs)能够显著提高土壤中碳、氮积累,提高地表的粘结力,调节土壤水文过程,提高启动风速,减轻风蚀,发挥着重要的水土保持作用[1-4]。另外,苔藓结皮作为生物结皮的高级演替阶段,具有极强的抗逆性[5-7],且能够生长在陡峭的土质坡面上,并可通过撒播茎叶碎片实现人工培育,作为一种生物防护新手段,近年来受到越来越多的关注[8-11]。陆生藻类是生物结皮的重要组成部分,其分泌的胞外聚合物与丝状结构能够稳定地表,促进生物结皮形成[12-13],陆生藻类对于干旱等极端条件有较强适应性,其能够忍受较大温度变化范围及强光环境[14-15]。土壤中的微生物群落同样是生物结皮的重要组分,调节着旱区生态系统中物质循环与能量流动[16-17]。自然环境中生物结皮的发育改善了土壤颗粒组成与水分再分配过程,影响土壤养分含量及土壤pH值[18],生物结皮的发育往往伴随着微生物群落的发展,二者相互作用,共同发挥生态效益[19-21]。现有野外培育研究多以苔藓或藻类为培育对象,在平缓土质或砂质坡面,直接撒播苔藓碎片或藻液,控制光照、温度、水分等环境条件,或施用营养液、生长调节剂等化学物质,促进生物结皮恢复[22-25]。如何在广泛存在的、工程开挖形成的高陡边坡上接种恢复生物结皮,目前关注有限。本研究将苔藓茎叶碎片与藻液及功能性微生物接种在布设于45°黄土坡面的自制培育基质上,了解藻类与微生物对生物结皮恢复效果的影响,以期更为有效的在高陡边坡上开展生物结皮接种恢复,为生态修复提供新思路。
1 材料与方法
1.1 研究区概况
培育试验在位于陕西省杨凌区五泉镇岭后水土保持试验站(34°—34°20′N,108°—108°07′E)的45°黄土坡面(方位角224°)进行。区内北高南低,属暖温带大陆性季风型半湿润气候,四季分明。年日照时数2 163.8 h;主导风向为东风和西风,最大风速21.7 m/s;年平均气温12.9 ℃,最热月在7月,平均26.1 ℃,最冷月在1月,平均-1.2 ℃,极端最高气温42 ℃,极端最低气温-19.4 ℃;年平均降水量635.1 mm,为全年农作物需水量的63.9%,降水量年际变化较大;潜在蒸发量1 505.3 mm,湿润指数0.64,无霜期211 d。区内主要植被为国槐(Sophorajaponica)、柏树(Cupressusfunebris)、榆树(UlmuspumilaL.)、鬼针草(Bidenspilosa)、蒺藜(Tribulusterrestris)、阿尔泰紫菀(Heteropappusaltaicus)等。
1.2 研究方法
1.2.1 苔藓种源采集与预处理 苔藓结皮采自陕西省延安市砖窑湾镇贾居沟(东经109°08′46″—109°14′30″,北纬36°42′21″—36°48′44″),海拔1 003.1~1 203.4 m,主要植被包括:小叶杨(Populussimonii)、柠条(Caraganakorshinskii)和长芒草(Stipabungeana)等,采样时选择发育良好,株高度大于5 mm,较为完整的苔藓结皮,利用小铲铲取苔藓结皮层(1 cm)。将采集好的结皮层,放在温度小于30 ℃,相对湿度不大于60%背阴处晾干备用。经鉴定,优势种为土生对齿藓(Didymodonvinealis),伴生有长尖对齿藓(Didymodonditrichoides)及丛生真藓(Bryumcaespitium)等。待晾晒干燥后,人工挑出结皮样品中杂质,使用高速植物粉碎机(艾泽拉-2 500 C)将结皮层粉碎为长度均匀分布在0.01~2 mm间的茎叶碎片,混匀后获得苔藓结皮种源。
1.2.2 坡面整备与接种 经预试验测试不同坡面承载结构的稳定性,基质对于苔藓茎叶碎片的接种适宜性,选择在45°黄土坡面布设三维土工网(国标EM3)并上覆10~20 mm厚,按照不同处理混合了功能性微生物(巨大芽孢杆菌、胶质芽孢杆菌)的基质(过4 mm孔径筛黄土、育苗基质、水、有机肥,它们的体积比为1∶1∶1∶0.2)后,立即于坡面上手工撒播苔藓茎叶碎片(500 g/m2),并适量洒水促进附着。
1.2.3 培育养护 试验于2018年7月至10月进行,考虑小球藻+硅藻复合藻液与功能性微生物两个因素,每因素各3个水平,采用完全试验设计,共9个处理(表1),每个处理3个重复,于坡面27个2 m×1 m小区中随机排布各处理。微生物按照重量比(10 g/kg)直接拌和于基质中,藻液于接种苔藓茎叶碎片后15 d根据处理要求均匀撒于坡面上。培育初期(0~30 d)使用遮阳网控制光强<20 000 lux,土壤水分>10%,并每隔5 d按照2.1 L/m2施用Hoagland营养液,培育中期(31~60 d)仅控制土壤水分与光照,培育末期(61~90 d)撤下遮阳网,不再人为补充水分。

表1 试验因子及其水平
1.3 观测指标与方法
1.3.1 生物结皮覆盖度 在处理小区两对角线上均匀选取5个点,放置由4线交叉等分为9个方格的10 cm×10 cm塑料样框,从中随机选取三个方格测量其中生物结皮覆盖度。
1.3.2 生物结皮厚度 在处理小区的两条对角线上均匀选取5个点,使用直径1.43 cm环形取样器取>10 mm厚度样品,使用电子游标卡尺随机选点测量生物结皮厚度3次。
1.3.3 苔藓株高度 在处理小区的两条对角线上均匀选取5个点,每个点使用电子游标卡尺随机选点测量苔藓植株体高度3次。
1.4 数据处理
采用Excel对数据进行处理,利用R语言首先进行巴特利特方差齐性检验(Bartlett’s test),随后进行方差分析,并检查双因素间交互作用,分析不同因素对处理间差异的贡献程度与显著性(p<0.05)。
2 结果与分析
2.1 生物结皮生长状况
生物结皮在小区内呈斑块状分布(图1),在小区间格挡处往往盖度较高,而在各小区上部盖度明显较小。添加1 g藻类并施用巨大芽孢杆菌处理下,生物结皮盖度有最大中位数,各处理中盖度均值为61.41%,最小值为32.72%,变异系数Cv=24.48,各处理间存在一定差异。添加3 g藻,不施用功能性微生物处理下,苔藓株高度有最大中位数,各处理株高度均值为2.67 mm,最小值为1.31 mm,变异系数Cv=33.34。不添加藻,施用胶质芽孢杆菌处理下,生物结皮厚度有最大中位数,各处理生物结皮厚度均值为2.58 mm,最小值为1.25 mm,变异系数Cv=32.63。

图1 培育90 d后生物结皮发育情况
2.2 藻类的影响
为了有效分析处理对生物结皮各指标的影响,首先使用巴特莱特方差齐性检验检查处理方差齐性(表2),结果显示在藻类与功能性微生物两因子作用下的生物结皮3个指标的方差齐性表现良好(average-p=0.45/0.88/0.45),可以进一步进行方差分析。
在生物结皮盖度方面,藻类添加物解释了95.81%的处理间方差,影响显著(p=8.01×10-12),而3种不同施用剂量的影响同样具有显著性(p=0.000 83/0.008 00/0.001 20)。在不施用藻类时,生物结皮盖度预测均值为59.32%,施用量为1 g/m2时,预测均值为66.8%,施用量增加至2 g/m2时,预测均值下降至62.2%。
在生物结皮厚度方面,藻类添加物解释了92.44%的处理间方差,影响显著(p=4.33×10-9),而3种不同施用剂量的影响同样具有显著性(p=0.005 6/0.003 0/0.001 6),当不施用藻类时,生物结皮厚度预测均值为2.54 mm,当施用量为1 g/m2时,预测均值下降为2.26 mm,当施用量提升至2 g/m2时,预测均值上升为3.10 mm,说明在添加剂量为2 g时,藻类能够最大限度的提高生物结皮厚度。
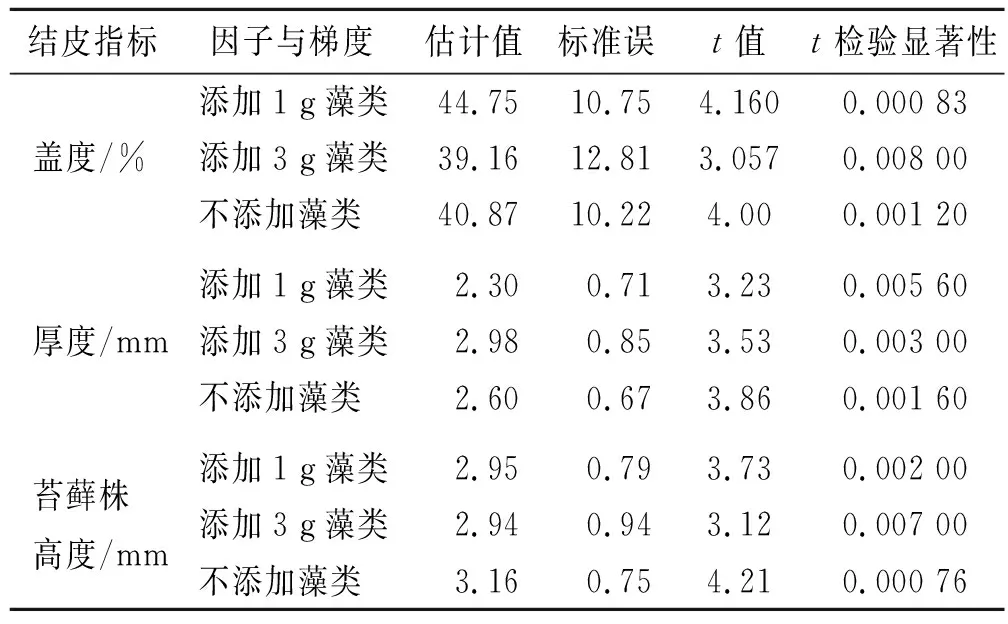
表2 不同梯度藻添加对各生长指标影响显著性
在苔藓株高度方面,藻类添加物解释了90.53%的处理间方差,影响显著(p=1.40×10-8),而3种不同施用剂量的影响同样具有显著性(p=0.002 00/0.007 00/0.000 76).,当不施用藻类时,苔藓株高度预测均值为2.81 mm,当施用量为1 g/m2时,预测均值开始下降,为2.61 mm,当施用量提升至2 g/m2时,预测均值下降为2.52 mm,说明随添加剂量的上升,藻类对苔藓株高度有明显负作用,当施用量为1 g/m2时,促进作用达到最大(coe-f=66.82)。
2.3 功能性微生物的影响
功能性微生物对表征试验样地生物结皮生长状况的3个指标影响微弱,分别解释了生物结皮盖度与厚度、苔藓株高度样地间方差的0.036%,0.66%和0.071%,p值分别为0.91,0.93和0.49,均不具有显著性(表3)。
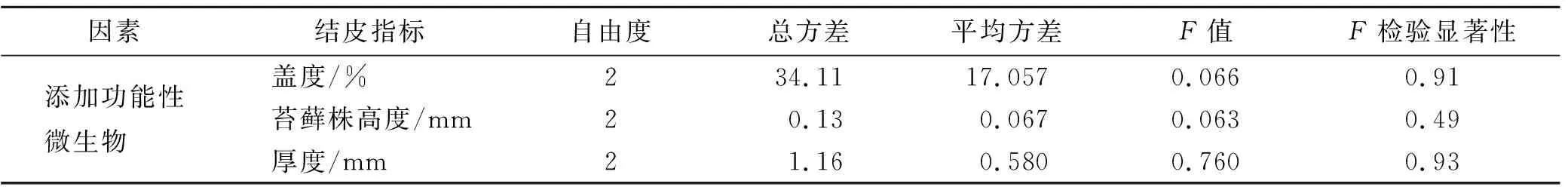
表3 双因素方差分析结果
2.4 藻类与微生物的交互作用
交互作用对表征试验样地生物结皮生长状况的3个指标影响微弱,分别解释了生物结皮盖度与厚度、苔藓株高度样地间方差的0.011%,0.005 0%和0.009 7%,p值分别为0.43,0.89和0.78,均不具有显著性(表4)。
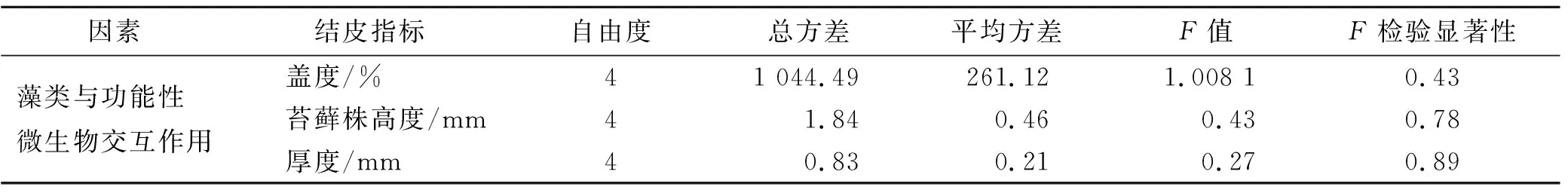
表4 交互作用方差分析结果
3 讨 论
以往利用藻类进行生物结皮人工恢复的研究多开展于干旱或半干旱荒漠的,流动或半流动沙丘表面。通过接种具鞘微鞘藻等陆生藻类,构建具有一定厚度的藻结皮[26-28],将水生藻类应用于人工生物结皮构建尚未见相关报道。水生藻类与陆生藻类在形态结构等方面具有相似性,其藻丝能够缠绕土粒,并通过分泌胞外聚合物增强土表稳定性,促进土壤团聚体形成,增加土壤水稳性,提高土壤肥力[13,29-30]。另外,藻类还能够通过提高土壤表层孔隙度,增加土表持水量,降低击溅侵蚀的同时,降低土表蒸发作用,提高水分在土壤中的留存时间,改善近地表水分条件[31-32],为生物结皮中其他组分的发育营造了适宜的土壤与水分条件。在生理活性方面,藻类能够与苔藓植株的叶片和假根紧密缠绕在一起,以低浓度胞外多糖促进藓类原丝体与配子体产生新的茎叶体,而苔藓植物提取液对藻类生长同样具有促进作用[33]。藻类与苔藓结皮的混生同样有利于细菌与真菌等微生物组份多样性的上升,从总体上提高群落多样性[34],从而促进了本试验中生物结皮的发育。
虽然本次使用的两种芽孢杆菌在农业生产中已被广泛应用[35],但未见将之应用于生物结皮人工培育恢复的研究报道。通过改善土壤结构,促进养分循环与能量流动,芽孢杆菌能够提高作物抗病能力,提升果蔬含糖量,改善口感、提高产量的同时降低化肥与农药的使用[17,35-36]。就试验结果的分析来看,两种芽孢杆菌的作用并不显著,这可能是由于而培养初期环境温度较高(地表温度录得47 ℃)[37],且菌种拌合于混合基质中,随水分散失基质内部有硬化现象,矿化作用弱,速效氮不足,不适宜功能性微生物的增殖并发挥作用[38]。
于培育结束时(90 d)观察坡面生物结皮,相较于缓坡(坡度<10°),多为斑块离散分布,藻结皮为主要覆盖,而苔藓组分较少且株高度较低。虽然在苔藓种源处理、接种方式、养护措施等方面,与李茹雪于2016年9月在同一地区5°黄土缓坡上开展的生物结皮人工培育恢复研究基本相同,但培育期末,苔藓株密度、盖度明显偏低[39]。这可能是坡度与坡向以及季节导致的立地条件差异造成的。方位角为224°的45°西南坡在7月时,使用90%遮光率遮阳网遮阴,坡面温度依然可达50 ℃,且坡面陡峭,即使配方基质也难以有效的蓄存水分,虽然接种于晚间进行,但因次日白天温度较高,导致种源着生前失水并最终失活。同时,7—8月主导风向为东、东南,与坡面水平走向重合,可能将茎段碎片吹起,使种源附着失败,降低接种成功率。
4 结 论
通过完全试验设计和系统观测分析,本研究表明水生藻类能够显著提高野外坡面人工恢复生物结皮的盖度与厚度及苔藓株高度,而功能性微生物的作用则并不明显。同时发现,复合藻种的最适施用量应该在2~3 g/m2,而环境条件的坡面分布差异可能影响生物结皮的人工恢复状况。综合认为,生物结皮坡面人工接种恢复具有可行性,添加藻类能够促进生物结皮形成覆盖,提升恢复效率,但需要充分考虑坡面立地条件及季节的适宜性。
