光合作用信号途径调控陆地棉矮化的机理研究
2019-06-14屠小菊汪启明谢陈灵李咏宇李瑞莲刘爱玉
屠小菊 ,汪启明 ,谢陈灵 ,李咏宇 ,李瑞莲 *,刘爱玉 *
(1.湖南农业大学理学院,长沙 410128;2.湖南农业大学生物科学技术学院,长沙 410128;3.湖南农业大学农学院,长沙 410128)
植物的光合作用是植物体重要的生理生态学特征之一,光合作用的产生是地球能量的直接来源,是人类社会产生和发展的基础[1-2]。矮化是植物绿色革命中非常重要的表型,矮化突变体具有抗倒伏、适宜密植及机械化生产、具有较高生产潜能的特征[3-5]。棉花具有无限生长的习性,目前棉花生产仍然需要人工打顶控制棉花的株高,大面积植棉区如新疆主要利用喷施缩节胺来代替人工打顶,但是缩节胺的使用严重污染自然环境。因此,培育矮化品种不仅可以给生产带来很多的便利,而且可以减少对环境的污染[6]。研究表明,植物光合作用信号传导途径相关基因的变化改变植物的光合特性,从而导致植物矮化。Rojas-González 等[7]发现拟南芥中光合作用途径的重要元件 cfbp1、cyfbp 的单基因以及双基因的T-DNA 插入突变体均表现出矮化的表型,突变体的光合速率也降低。Chen 等[8]将柳树LEA基因导入到杨树中,得到杨树矮化突变体dw1,其光合作用相关基因发生明显变化。Hu 等[9]通过对蓖麻矮化突变体Zhebi26 及高秆材料Zhebi100的研究发现,Zhebi26 中光合作用相关的蛋白质表达量下降,净光合速率(Pn)、气孔导度(Cond)、胞间CO2浓度(Ci)均显著降低,叶绿素荧光参数初始荧光(F0)、可变荧光产量(Fv)、光系统 II(PS II)最大光化学效率(Fv/Fm)、光化学猝灭系数(qP)均显著小于Zhebi100。
光合作用是植物体干物质的来源,通过对植物体光合特性的测定,能够详细了解植物体生长特征,对指导生产、调控植物体的生长具有重要的意义[10]。目前,关于棉花矮化突变体光合特征的研究鲜有报道。黄华宏等[11]的研究发现矮生杉木的光合能力缺陷可能是造成其低生长势的重要生理生态原因之一,其Pn、Cond及蒸腾速率(Tr)均低于正常型,叶绿素荧光参数中F0、最大荧光(Fm)、Fv/Fm及 PS II 的潜在活性(Fv/F0)均小于正常型。棉花sda矮化突变体的叶绿素含量、SPAD值及Pn较野生型(WT)均显著减少[12]。王静静[13]发现矮化杂交兰突变体中叶绿素a、叶绿素b、类胡萝卜素含量均显著低于正常杂交兰植株,其Pn和Tr显著降低,Ci显著增高,叶绿素荧光非光化学猝灭(NPQ)也显著高于正常杂交兰植株。
本研究以陆地棉矮化突变体LA-1 及其近等基因系LH-1 为材料,以同位素标记相对和绝对定量(Isobaric tags for relative and absolute quantitation,iTRAQ) 结合液相质谱串联(LC-MS/MS)的定量蛋白质组学的结果为切入点,找到光合作用信号传导途径中差异表达蛋白,比较两种材料光合特性的差异,进一步明确LA-1 矮化与光合作用的相关性,为LA-1 在棉花矮化育种中的应用提供理论基础。
1 材料与方法
1.1 试验材料
供试材料为陆地棉矮化突变体LA-1 及其近等基因系LH-1,均为湖南农业大学棉花研究所自育材料。前期的研究表明,在现蕾前LA-1 与LH-1具有相同的生长趋势; 进入现蕾期后LA-1 生长缓慢,逐渐表现出矮化表型,停止生长时间早;LA-1 在盛花期后伸长节间基本固定,表现为有限生长习性,两种材料表型差异出现在现蕾期[14]。
1.2 试验方法
1.2.1材料种植及试验设计。田间试验于2016年4月到8月在湖南农业大学浏阳试验基地完成,室内试验于湖南农业大学作物生理与分子生物学教育部重点实验室完成。4月28日直播,种植密度 4 株·m-2,小区面积 20 m2,对比试验,5 次重复,小区左右交叉排列。不施基肥,4 叶期(5月25日) 一次性施肥,N、P2O5、K2O 用量分别为180、90、180 kg·hm-2。
1.2.2棉花蛋白质组学分析。分别选取播种86 d后(现蕾期,此时两种材料株高差异达到显著[14])LA-1 及LH-1 的主茎茎尖为材料,两种材料茎尖分别来自于60 株相互独立的植株,这些材料被随机分为三组,用液氮冻融后放入-80 ℃冰箱中保存备用,按照前期的研究方法进行蛋白的提取及iTRAQ 定量蛋白质组学分析[14]。
1.2.3定量反转录- 聚合酶链式反应(Quantitative reverse-polymerase chain reaction,qRT-PCR)分析。用于qRT-PCR 的植物材料与iTRAQ 定量蛋白质组学的材料相同,按照前期的研究方法进行 RNA 的提取及逆转录[14]。根据 iTRAQ 定量蛋白质组学的检测结果,选取光合作用信号途径差异表达蛋白,根据其序列设计qRT-PCR 引物,以棉花内标准基因ACT(Actin)为对照,引物序列如表1。用qRT-PCR 检测这些基因在两种材料中的相对表达水平。反应仪器是Roche Light Cycler 480Ⅱ,温度循环参数为95 ℃,预变性10 min,95 ℃ 10 s,60 ℃ 30 s,40个循环。

表1 光合作用相关表达差异蛋白基因引物Table 1 Primers of photosynthesis related different expression proteins
1.2.4叶绿素含量测定。以现蕾期LA-1 及LH-1为材料,每小区随机选取连续5 株棉株的主茎倒4 叶进行测定。叶片剪碎后加入碳酸钙研磨,采用乙醇浸提方法,使用上海光谱SP-754 分光光度计,测定样品在645 nm 和663 nm 下的吸光度。计算叶绿素a、叶绿素b、总叶绿素、类胡萝卜素的浓度,每个材料3个重复。
1.2.5SPAD 值的测定。选取与叶绿素测定同一时间的两种材料的主茎倒4 叶,采用便携式SPAD 仪测定SPAD 值,每小区随机选取5 株进行测定,每片叶重复测定3 次。
1.2.6光合参数的测定。采用Li-6400 便携式光合测定仪(LI-COR,美国),分别于棉花现蕾期前及现蕾期有表型差异后对两种材料进行光合参数测定,选择光合活性强的主茎倒4 叶。每小区随机选取5 株进行测量,所有材料的测定时间选择晴朗的上午8∶00―11∶00,光量子通量密度(Photosynthetic photo flux density,PPFD) 设为1 000 μmol·m2·s-1,流速 (Flow) 设定为 500 μmol·m2·s-1。测量时提前进行预热,使仪器工作稳定后开始测量,每间隔 30 min 匹配(Match)1次,减小测量误差,测定的参数包括Pn、Cond、Ci和Tr。
1.2.7叶绿素荧光参数测定。以现蕾期LA-1 及LH-1 为材料,每小区随机选取连续5 株有代表性的棉株的主茎倒4 叶,采摘后立刻用湿毛巾包裹,带回室内,暗适应30 min。采用调制叶绿素荧光成像系统 IMAGING-PAM 2000(Walz,德国)预先编好的测定程序Ind.Curve (暗- 光诱导曲线) 测定叶绿素荧光参数,包括F0、Fm、Fv/Fm、Fv/F0、NPQ、qP、非光化学猝灭系数(qN)和 PS II 实际光合效率(YII)。适宜测量光强的选择:利用备用的棉花叶片,调节Meas.light(测量光),使测量区域 (Area of interest,AOI) 的实时荧光 (Ft)在0.1~0.15 之间,调节 Act.light(光化光),使ΔF值在Fv的 1/3~2/3 内。光强选择完成之后开始测量,测量过程中 Meas.light、Act.light 不再进行更改。
1.2.8统计方法。图表通过Excel 软件进行制作,通过DPS 软件进行单因素方差分析。PS II 实际光合效率YII=(Fm′-F)/Fm′,叶绿素荧光非光化学淬灭(NPQ)=(Fm-Fm′)/Fm′,光化学猝灭系数qP=(Fm′-F)/ (Fm′-F0′),非光化学猝灭系数qN=(Fm—Fm′)/(Fm-F0′)。其中,Fm′为光下最大荧光,F为荧光产额,F0′为光下最小荧光产额。
2 结果与分析
2.1 光合作用途径相关差异表达蛋白
通过对LA-1 及LH-1 两种材料进行iTRAQ定量蛋白质组学分析得到一系列差异表达蛋白[14],然后将差异表达蛋白进行KEGG(Kyoto encyclopedia of genes and genomes,http://www.kegg.jp/)富集分析,从而获得了参与光合作用信号途径的差异表达蛋白。通过分析发现光合作用途径共存在7 种差异表达蛋白,其中5 种在LH-1 中上调,包括PSⅡ外周小亚基蛋白PsbO、光系统I(PS I)亚单位 IV 蛋白 PsaE、PS I 亚单位 VI 蛋白 PsaH、铁氧化还原蛋白PetF-1 和PetF-2;2 种下调,包括细胞色素b6/f复合体 (Cytochromeb6f,Cytb6f)中的铁硫亚基 PetC、F 型 ATP 合酶(F-type ATPase)亚基delta(图1,表2)。存在于光合作用途径的上述7 种差异表达蛋白均在植物光合作用电子传递链中发挥重要的作用,其中PsbO 是PS II 的锰稳定蛋白;PsaE 能够直接锚定铁氧还原蛋白,在循环电子传递中发挥作用;PsaH 蛋白能够将能量从捕光色素蛋白复合物II (LHC II) 传递到PS I反应中心;PetF 是光合系统电子传递链中的第一个基质的电子接受者,主要负责电子传递;ATP合酶由F1和F0两部分组成,其中F1伸在膜外,具有水溶性,F0则嵌在膜内,delta 亚基对F1和F0的连接是至关重要的[10]。由于这些蛋白在两种材料中表达差异,会对两者的光合能力产生影响。这些差异蛋白的发现说明LA-1 矮化与植物光合效率存在联系。

图1 光合作用途径差异表达蛋白Fig.1 Differential expressed proteins in photosynthesis pathways

表2 光合作用途径差异表达蛋白Table 2 Differential expressed proteins in photosynthesis pathway
2.2 叶绿素含量及SPAD值差异
LA-1 及LH-1 细胞色素含量存在差异,与LH-1 相比,LA-1 的叶绿素a 及叶绿素的总含量均小于LH-1(表3),其中,叶绿素a、总叶绿素含量分别减少了10.53%和10.67%,差异均达到显著水平(P<0.05),叶绿素b 及类胡萝卜素含量无显著性差异。SPAD 值的测定方法具有高效、简便、损伤小的特点,目前广泛应用于各种植物中。植物叶片的SPAD 值一般与叶绿素含量呈极显著正相关的关系[15],因此对两种材料SPAD 值的测定能在一定程度上反映叶绿素的水平。结果表明,LA-1 的 SPAD 值显著小于LH-1(P<0.05)(表3)。综上,LA-1 的叶绿素 a、总叶绿素含量及SPAD 值均显著小于LH-1。

表3 LA-1 及LH-1 叶绿素含量及SPAD 值差异Table 3 Differences chlorophyll content and SPAD between LA-1 and LH-1
2.3 光合特性差异
通过对两种材料现蕾期前后光合特性的比较,从而进一步深入了解两种材料生长差异性的光合作用特征。结果表明,现蕾前,两种材料Pn差异不显著,但是Cond、Ci以及Tr存在差异,其中,与LH-1 相 比 ,LA-1 的Cond、Ci分 别 减 少 了9.41%和2.49%,而Tr增大了17.72%,差异均达到显著水平(P<0.05)(表 4)。矮化突变体LA-1通过较低的Cond和Ci及较高的Tr来增强光合作用效率,从而使其具有与LH-1 大约一致的光合效率,因而在现蕾前与LH-1 保持一致的生长趋势。在现蕾后,与LH-1 相比,LA-1 的Pn、Cond、Tr均减少,其中Pn减少了 12.19%,Cond减少了35.64%,差异均达到显著水平(P<0.05),Tr减少27.81%,差异达到极显著水平(P<0.01),但是Ci无显著性差异(表 4)。LA-1 的Pn、Cond及Tr出现明显小于LH-1 的现象,从而使得LA-1 的气体交换的速率明显降低,导致光合效率降低。在一定的光照强度下,植物的净光合速率可直接反映其光合积累有机物的能力。LA-1 在现蕾后Pn显著小于LH-1,导致LA-1 在现蕾后生长速度较LH-1 慢,从而导致LA-1 矮化,表明LA-1 植株矮化表型与光合特性存在联系。

表4 不同时期LA-1 及LH-1 光合特性的差异Table 4 Differences in photosynthesis parameters between LA-1 and LH-1 in different growth periods
2.4 叶绿素荧光参数差异
与LH-1 相比,LA-1 的YII减少了 23.17%,Fv/F0减少了 24.04%,NPQ增加了 16.18%,差异均达到显著水平(P<0.05),但是F0、Fm、F0′、Fm′、Fv/Fm、qP和qN 无显著性差异(表 5)。LA-1 的YII及Fv/F0的值小于LH-1,说明LA-1 合成的光合产物较少,另一方面作为非光化学淬灭的NPQ反映天线色素系统对激发能的热耗散;LA-1 的NPQ显著大于LH-1,这说明LA-1 中有更多的光能被用于热耗散,从而使得用于光合作用的能量较LH-1 少,这也是导致LA-1 具有较低的实际光合效率,从而导致矮化的另一个原因。
2.5 qRT-PCR检测相关基因mRNA水平表达
选取光合作用信号途径差异表达蛋白,进行qRT-PCR 检测其mRNA 水平表达。结果表明,除了delta基因的表达量与蛋白质组学的结果不一致外,其他的基因表达量与蛋白质组学的结果具有一致性。与LH-1相比 ,PsbO、PsaE、PsaH、PetF-1 及PetF-2 在LA-1 中的表达量均减少,其中 ,PsbO、PsaE及PsaH分别减少了48.75% 、34.40%和 25.49%;PetF-1和PetF-2 的表达量的变化最大,在LA-1 中分别减少了 62.29%和69.24%;PsaE和PsaH表达量差异达到显著水平(P<0.05);PsbO、PetF-1 及PetF-2 的表达量差异达到极显著水平 (P<0.01);PetC表达量增加了91.82%,差异达到极显著水平(P<0.01)。但是,delta的表达量在两种材料中差异不明显(图2)。结果表明,PsbO、PsaE、PsaH、PetF-1、PetF-2 及PetC基因的转录后调控与基因表达不相关,delta的表达量可能存在转录后调控的现象。

表5 LA-1 及LH-1 叶绿素荧光参数比较Table 5 Comparison of chlorophyll fluorescence parameters between LH-1 and LA-1
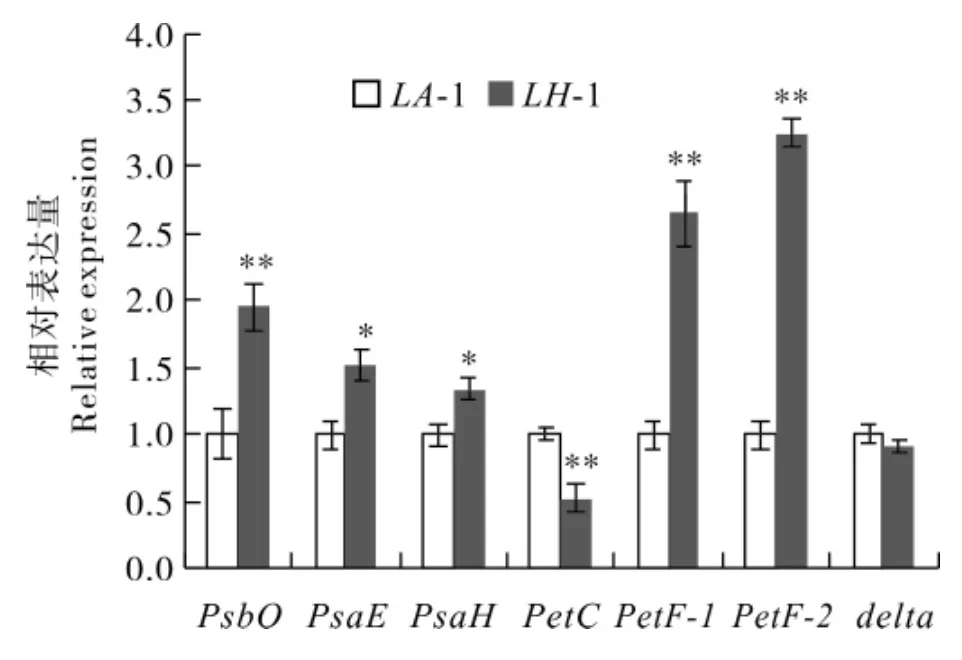
图2 qRT-PCR 检测光合作用相关基因表达Fig.2 qRT- PCR of photosynthesis related genes
3 讨论
3.1 光合作用差异表达蛋白与LA-1矮化的相关性
目前,关于采用蛋白质组学的方法研究植物矮化机理的报道不多见,本研究通过iTRAQ 定量蛋白质组学的研究表明,共有7个参与光合作用的蛋白表达量在LH-1 及LA-1 中存在差异。除PetF基因没有调控植物体高度的报道、单个PetC亚基的缺失不会对植物表型有影响外,其他几个差异表达基因均和植物体的生长有关,其中任何一个基因的缺失都能导致植物体的生长受阻。PsbO 是PS II 系统的重要组成成分,是PS II 的锰稳定蛋白[16-18]。Murakami 等[19]研究表明拟南芥含有 2个PsbO基因,分别为PsbO1和PsbO2,PsbO1 缺失突变体中PsbO1 基因的缺失导致PS II活性降低从而表现出生长阻滞的表型,PsbO1 比PsbO2 发挥更重要的作用,但是PsbO2 同样在PsbO1 缺失突变体中的表型变化发挥作用。PsaE是PS I 的重要组成部分,能够直接锚定铁氧还原蛋白,在循环电子传递中发挥作用[20-22]。Varotto 等[23]发现拟南芥PsaE基因缺失突变体Psae1 的光敏感度增加,表现出光抑制现象及植物高度降低50%的表型。结果表明,PsaE基因通过调控光合作用,与植物的生长密切相关。Naver 等[24]研究表明PsaH 是PS I 稳定积累及有效电子传递必需的,PsaH转基因植物含有PsaH 的含量比野生型少3%,在无菌培养基上生长比野生型小,与野生型相比缺少PsaH 的PS I 复合物,只有61%的辅酶 II(NADP+)光还原活性。Schneider 等[25]发现在集胞藻属中 PetC 蛋白包括 3个亚基 PetC1、PetC2 和PetC3,其中任何一个亚基的删除都不会明显地影响集胞藻属的表型。通过对拟南芥delta基因的干扰和抑制的研究发现,delta在拟南芥的配子形成中发挥重要作用,delta缺失导致拟南芥线粒体代谢活跃程度降低,从而使植株生长减弱及配体发育缺陷[26]。
到目前为止,关于本研究中涉及的光合作用差异表达基因调控植物矮化的研究较少,在棉花中还未见报道,作为光合作用过程的重要组成元件,蛋白表达水平的变化在一定程度上能够反应植物光合能力的强弱。本研究发现PsbO、PsaE、PsaH、PetF-1、PetF-2 蛋白的表达量在LA-1 中下调,PetC、delta蛋白在LA-1中上调(图1)。qRT-PCR 的结果表明,基因转录水平的表达与蛋白质组学的表达存在一定的差异,delta基因在两种材料中差异不明显,PetC基因在LA-1 中的表达量极显著大于LH-1,但是由于单一PetC基因的删除对植物生长不会产生显著的作用,所以PetC基因在LH-1 中表达量低并不会显著影响LH-1 的表型。因此,在LA-1 中表达量下调的上述5个蛋白可能通过影响光合作用效率和生物体中的其他途径,从而导致LA-1 的矮化,这从基因及蛋白表达水平进一步解释了LA-1 矮化的原因。但是具体是哪个基因在此过程中发挥主要作用,发挥作用的具体机理,还有待进一步采用分子生物学的手段来做更加深入地研究。
3.2 LA-1光合色素及光合效率降低导致矮化
目前,关于矮化突变体光合能力的检测主要集中在果树中,关于棉花的研究很少,张超等[27]的研究发现棉花矮化突变体AS98 表现出极端矮化的表型,其净光合效率显著小于正常棉花品种。叶绿素含量的大小反映叶片的生理活性的大小,是植物生长发育中的一个重要指标,在一定程度上反映植物光合能力的强弱。本研究中,LA-1 的叶绿素a、总叶绿素含量及SPAD 值均显著小于LH-1,这在一定程度上导致LA-1 的光合作用能力较LH-1 弱,从而导致LA-1 的矮化。LA-1 在现蕾前与LH-1 的Pn无显著差异,两者光合能力相似,因此,在现蕾前两者的植株高度无显著的差异,现蕾后LA-1 的光合能力显著降低,导致其光合产物的生产能力较弱,从而导致矮化,虽然LA-1 的光合能力较LH-1 弱,不利于光合产物的积累,但是在生产中可以通过高度密植的方式增加其单位面积的光合产物的积累。并且矮化棉花适宜机械化生产,因此在生产中具有重要的应用价值。
4 结论
本研究通过iTRAQ 定量蛋白质组学及qRT-PCR 的方法,结合一系列生理学检测,发现光合作用信号途径差异表达蛋白PsbO、PsaE、PsaH、PetF-1 及 PetF-2 在LA-1 中表达量下调。PetC 和delta 表达量在LA-1 中上调。上述蛋白的差异表达会导致LA-1 光合能力下降。这些研究结果说明LA-1 光合作用相关蛋白的表达量降低,导致其光合能力降低,从而导致其矮化,陆地棉矮化突变体LA-1 的矮化与光合作用途径存在相关性,为进一步研究LA-1 矮化的分子机理及棉花的矮化育种提供理论基础。
