不同浓度β1-肾上腺素受体自身抗体对心肌细胞存活影响的差异性
2019-06-13王兆佳王美丽刘慧荣
王兆佳 武 烨 刘 丹 王美丽 隗 歆 刘慧荣*
(1.首都医科大学基础医学院生理学与病理生理学系,北京 100069;2.代谢紊乱相关心血管疾病北京市重点实验室,北京 100069;3.首都医科大学燕京医学院,北京 101300)
《中国心血管病报告 2017》[1]显示,心血管疾病是威胁我国公众健康的主要的危险因素,呈逐年增高、居高不下的趋势,因此研究心血管疾病、尤其是各种心血管疾病的终末阶段——心力衰竭就显得尤为重要。多种机制参与心力衰竭的发生、发展,包括:交感神经系统紊乱、心血管活性物质分泌失衡、 细胞损伤等[2]。其中交感神经系统持续兴奋被证实为促进心力衰竭发生的核心机制之一[3],其主要机制为心肌细胞β1肾上腺素能受体(β1-adrenergic receptor,β1-AR)持续激活[4]。据调查[5],40%~60%的心功能不全患者血清中可检测到β1肾上腺素受体自身抗体(β1-adrenergic receptor autoantibody,β1-AA),其与β1-AR细胞外第二环特异性结合,起到类激动剂样作用,且具有持续激活不脱敏的特点,最终损伤心肌[6]。工作的心肌高度依赖线粒体呼吸维持足够的能量供应,而持续激活的β1-AR导致细胞代谢和线粒体呼吸异常,这可能是造成线粒体有害物质的产生并蓄积进而促进心肌细胞死亡、导致心功能不全、心力衰竭发生的原因[7]。笔者前期研究[8]显示,β1-AA可以损伤线粒体功能,导致细胞死亡。
笔者同样发现,除心力衰竭患者血清中存在β1-AA外,部分心功能正常的人血清中同样存在β1-AA[9],但是β1-AA造成的这种心功能差异机制不清。因此探寻其机制,为临床诊疗上延缓甚至阻止β1-AA阳性人群心功能恶化、缓解甚至逆转心功能不全患者提供了病理生理学基础。
1 材料与方法
1.1 主要试剂与材料
H9c2细胞系(中国医学科学院基础医学研究所细胞中心)、具有良好生物学活性的单克隆抗体(β1-AABs)[10]、胎牛血清(FNA500,上海依科赛生物公司)、DMEM高糖培养基(10817014, Corning公司,美国)、胰蛋白酶1∶250(trypsin powder,porcine 1∶250,Sigma-Aldrich公司,美国)、Ⅱ型胶原酶(collagenase type2,Worthington公司,美国)、CCK-8法细胞增生检测试剂盒(KGA317,南京凯基生物科技发展有限公司)、增强型ATP检测试剂盒(S0027,上海碧云天生物技术有限公司)、线粒体膜电位检测试剂盒(C2006,上海碧云天生物技术有限公司)、96孔不透光发光板(9502887,Thermo Scientific公司,美国)、BCA蛋白分析试剂盒(SF247582,Thermo Scientific公司,美国)。
1.2 主要仪器
全功能酶标仪(Synergy H1,BioTek公司,美国)、化学发光仪(Spectramax Molecular Devices公司,美国)、流式细胞仪(LSRFortessa,BD公司,美国)。
1.3 原代SD大鼠乳鼠心肌细胞(neonatal rat cardiomyocytes, NRCMs)提取
取数只新生SD大鼠心脏置于冰磷酸盐缓冲液(PBS)中,去除心耳等部位,剪碎并洗去残留血液。加入适量的胰蛋白酶与Ⅱ型胶原酶混合酶液,37 ℃水浴5 min,将混合液移至含有10%(体积分数)胎牛血清(FBS)的DMEM高糖培养基终止消化,重复上述操作,至组织消化完全。将培养基混浊液850 r/min离心5 min。弃上清,用培养基重悬细胞沉淀,差速贴壁法获得所需细胞。
1.4 细胞培养及药物刺激处理
用含有10%(体积分数)FBS的DMEM培养H9c2细胞至密度为60%~80%,培养NRCMs至第3~4 d时,加入β1-AA(10-10、10-9、10-8、10-7、10-6mol/L)24、36、48 h,检测后续指标。
1.5 细胞生存率检测
将新型细胞增生及毒性检测溶液按照10 μL/100 μL培养基加入待测细胞中,避光培养1 h后,使用酶标仪在450nm波长处检测吸光度(A值)。细胞生存率=(加药细胞A值-本底A值)/(对照细胞A值-本底A值)。
1.6 细胞ATP含量检测
吸除待测细胞培养基,按照50 μL/孔加入裂解液(24孔板),充分裂解细胞后,4 ℃, 12 000g离心 5 min,取上清。配置ATP标准溶液、ATP检测工作液。将工作液加入不透光的检测孔板内,室温放置3~5 min。再将待测样品、ATP标准溶液加入检测孔板内,迅速混匀,使用化学发光仪检测荧光值,并根据标准曲线计算ATP含量。BCA法检测细胞裂解液蛋白浓度。最终计算ATP的浓度(nmol/mg)。
1.7 细胞线粒体膜电势检测
根据说明书配置JC-1染色工作液。将待测细胞使用胰酶消化并收集至EP管中,加入等量的JC-1染色工作液,充分混匀后继续培养20 min。配置JC-1染色缓冲液(1×),使用此液洗涤细胞3次。最终使用流式细胞仪检测。
1.8 统计学方法

2 结果
2.1 不同浓度β1-AA对心肌细胞生存率的改变
与对照组相比,采用中、高浓度(10-7、10-6mol/L)的β1-AA在不同的时间刺激,NRCMs生存率皆明显下降(P<0.05),其中10-6mol/L β1-AA作用36 h时最为明显(0.18 ± 0.01vs1.00 ± 0.00,P<0.05);其他浓度(10-10、10-9、10-8mol/L)时,NRCMs生存率与对照组相比无明显变化(图1A~C)(F24 h=28.57,F36 h=245.29,F48 h=45.80)。提示,中高浓度β1-AA降低乳鼠心肌细胞(NRCMs)生存率,低浓度β1-AA对乳鼠心肌(NRCMs)生存率无明显影响。
与对照组相比,β1-AA在中高浓度(10-7及10-6mol/L)作用24 h后,H9c2细胞生存率下降,并且持续到48 h(P<0.05),尤其值得关注的是,10-6mol/L β1-AA在作用持续48 h后,与对照组相比,H9c2细胞生存率下降尤为显著(0.07 ± 0.01vs1.00 ± 0.00,P<0.05);而低浓度(10-10及10-9mol/L)β1-AA刺激36 h及低浓度(10-10及10-8mol/L)刺激48 h后,H9c2细胞生存率有轻微的增加(P<0.05),尤其是10-9mol/L β1-AA作用36 h后,与对照组相比,H9c2细胞的生存率增加最为明显(1.24 ± 0.04vs1.00 ± 0.00,P<0.05)(图2A~C)(F24 h=25.48,F36 h=35.90,F48 h=121.27)。提示:中、高浓度β1-AA降低H9c2细胞生存率、低浓度β1-AA增加H9c2细胞生存率。

图1 不同浓度的β1-AA对乳鼠心肌细胞生存率的改变Fig.1 Different cell survival of NRCMs by β1-AA of different concentrations
A-C: Cell survival was detected by using CCK8 assays after NRCMs were treated by β1-AA (10-10, 10-9, 10-8, 10-7, 10-6mol/L) for 24 h, 36 h and 48 h.*P<0.05vscon group;n=3~6 per group;con: control;NRCMs:neonatal rat cardiomyocytes;β1-AA:β1-adrenergic receptor autoantibody.

图2 不同浓度的β1-AA对H9c2细胞生存率的改变Fig.2 Different cell survival of H9c2 cells by β1-AA of different concentrations
A-C: Cell survival was detected by using CCK8 assays after H9c2 cells were treated by β1-AA (10-10, 10-9, 10-8, 10-7, 10-6mol/L) for 24 h, 36 h and 48 h.*P<0.05vscon group,n=3-6 per group,con: control;β1-AA:β1-adrenergic receptor autoantibody..
2.2 不同浓度β1-AA对H9c2细胞中ATP含量的影响
给予H9c2细胞不同浓度(10-10、10-9、10-8、10-7、10-6mol/L)的β1-AA刺激48 h(因生存率实验笔者发现作用时间无明显相关,后续实验使用48 h时间点),检测其ATP含量。结果显示:与对照组相比,高浓度(10-6mol/L)的β1-AA刺激后,H9c2细胞ATP含量明显下降(0.15 ± 0.08vs1.00 ± 0.24,P<0.05);与对照组相比,采用中、低浓度(10-10、10-9、10-8、10-7mol/L)的β1-AA刺激,H9c2细胞中ATP含量明显增加(P<0.05),尤其10-8mol/L β1-AA作用最为明显(4.08 ± 0.23vs1.00 ± 0.24,P<0.05)(图3)(F=21.06)。

图3 不同浓度的β1-AA引起H9c2细胞ATP含量改变Fig.3 Different content of ATP of H9c2 cells by β1-AA of different concentrations
The content of ATP was detected by Enhanced ATP Assay Kit after H9c2 cells treated by β1-AA (10-10, 10-9, 10-8, 10-7, 10-6mol/L) for 48 h.*P<0.05vscon group,n=4 per group,con: control;β1-AA:β1-adrenergic receptor autoantibody.
2.3 不同浓度β1-AA对H9c2细胞线粒体膜电势的影响
给予H9c2细胞不同浓度(10-10、10-9、10-8、10-7、10-6mol/L)的β1-AA刺激48 h,通过加载JC-1荧光探针、利用流式细胞术检测线粒体膜电势(即红色荧光、绿色荧光、红色荧光与绿色荧光的比值)改变情况。结果显示:与对照组相比,高浓度(10-6mol/L)的β1-AA组的H9c2细胞线粒体膜电势下降,即红色荧光降低(0.17 ± 0.14vs1.04 ± 0.02,P<0.05)、绿色荧光增加(5.15 ± 0.56vs0.82 ± 0.07,P<0.05)、红色/绿色荧光比值降低(0.03 ± 0.03vs1.00 ± 0.07,P<0.05);与对照组相比,低浓度β1-AA(10-10、10-8mol/L)组H9c2细胞线粒体膜电势增高,即红色/绿色荧光比值增加(10-10mol/L β1-AAvs对照组:1.95 ± 0.09vs1.00 ± 0.07,P<0.05;10-8mol/L β1-AAvs对照组:1.71 ± 0.09vs1.00 ± 0.07,P<0.05)(F红色荧光=36.18,F绿色荧光=46.38,F红色/绿色荧光比值=30.75)(图4)。
3 讨论
心血管疾病严重危害我国公众健康,其终末阶段心力衰竭危害最为严重。β-AR在心力衰竭(heart failure,HF)的发病机制和治疗中的重要性已被广泛接受[11-12]。而心脏中主要分布β1-AR,β1-AR是G蛋白偶联受体,通过腺苷酸环化酶(cyclic adenosine monophosphate,cAMP)和蛋白激酶A(protein kinase A,PKA)触发信号传导,增加心肌细胞的收缩性[5]。据报道[13],人体内针对β1-AR的自身抗体(β1-AA)在心力衰竭中发挥重要作用。
研究[14-15]表明,β1-AA是特异性识别并结合β1-AR细胞外第二环(the second extracellular loop of β1-adrenoreceptor,β1-AR-ECII)天然受体构象的自身抗体,40%~60%的心功能不全患者血清中存在β1-AA[5],其可以激活受体及其下游信号通路,发挥类激动剂样效应[16],最终造成心肌细胞损伤、心功能受损[17]。然而,笔者前期研究[9]显示,除心力衰竭患者血清中存在β1-AA外,部分心功能正常的人血清中存在低水平的β1-AA,那么这是否是造成β1-AA阳性者不同心功能的原因呢?为此笔者进行了细胞实验。为还原人体内β1-AA持续作用于心肌细胞的效果,笔者选取了生物学活性接近人心肌细胞的原代SD大鼠乳鼠(出生72 h内)心肌细胞(NRCMs)、H9c2细胞系;在时间上选择长时间段,以模拟β1-AA在人体血清内长期存在的效应。据文献[17]报道,β1-AA刺激NRCMs 48 h可以引起凋亡,因此笔者选取24、36、48 h时间点。笔者发现10-7、10-6mol/L β1-AA作用于NRCMs、H9c2细胞后,可以引起其生存率降低,并且随着浓度增加, 10-6mol/L β1-AA引起的生存率降低更明显;而且,随着时间延长,10-7mol/L β1-AA 引起的生存率降低较为明显,这与“升高的儿茶酚胺激活β1-AR的程度与生存率呈负相关”的报道一致[12]。可能是部分β1-AA阳性人群心功能异常的原因,即β1-AA长期中高浓度刺激下心肌细胞生存率降低、进而导致心功能异常。
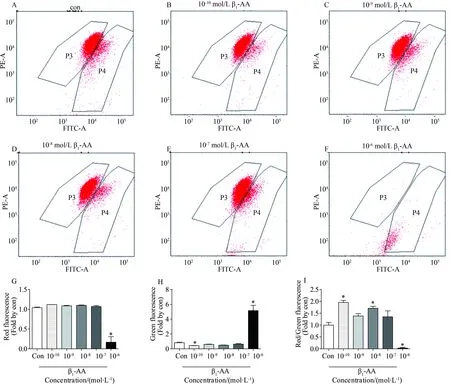
图4 高浓度β1-AA引起H9c2细胞线粒体膜电势下降Fig.4 Decreased mitochondrial membrane potential of H9c2 cells by β1-AA of high concentration
Mitochondrial membrane potential was detected after H9c2 cells was treated by β1-AA (10-10, 10-9, 10-8, 10-7, 10-6mol/L) for 48 h and JC-1 staining.A-F:results of flow cytometry, P3 for red fluorescence and P4 for green fluorescence.G: statistical graph of the red fluorescence;H: statistical graph of the green fluorescence;I: statistical graph of ratio of the red and green fluorescence, representing the mitochondrial membrane potential;*P<0.05vscon group.n=3 per group,con: control;β1-AA:β1-adrenergic receptor autoantibody.
笔者发现10-10~10-8mol/L β1-AA作用于NRCMs后,其生存率无明显改变,并且随着时间延长仍然无明显改变,这与心功能正常人群中含有β1-AA阳性者的调查一致。然而低浓度 β1-AA作用于H9c2细胞36、48 h后有轻微增生,提示低浓度β1-AA可能存在正性作用,这与“异丙肾上腺素(一种β受体激动剂)产生正性变力与变时效应”的报道[18]一致。即低浓度β1-AA对心肌细胞存在正性作用、而中高浓度则引起心肌细胞过度工作而失代偿终致心功能异常。
心脏维持全身各器官、组织充足的血液供应,为维持其功能,需要高度耗能,而心肌90%以上的能量来自于线粒体[19]。ATP在能量代谢中起核心作用,由线粒体氧化磷酸化产生,其含量可直接反映线粒体功能。有文献[7]显示,β1-AR激活会增加细胞代谢和线粒体供能,本研究结果表明,10-10~10-7mol/L的β1-AA 显著增加H9c2细胞ATP含量,提示中低浓度β1-AA增加ATP,可能致心肌细胞收缩功能增加,起到正性肌力作用。10-7mol/L的β1-AA引起细胞生存率下降,而整体ATP含量仍为增加,提示此浓度下β1-AA引起心肌存活降低,心功能仍然正常,可能是因ATP增加所代偿。10-10~10-7mol/L的β1-AA刺激的结果皆进一步解释了β1-AA阳性者人群存在心功能正常的现象。有文献[7]显示,β1-AR过度活化会增加线粒体有害物质产生,进而损伤线粒体,最终致心肌细胞死亡。 10-6mol/L β1-AA刺激结果说明高浓度β1-AA损伤线粒体功能,这也进一步提示部分β1-AA阳性人群中心功能异常的可能是因为心肌ATP生成明显减少、最终心脏因能量不足而发生功能异常。
线粒体膜电势(mitochondrial membrane potential,MMP,ΔΨm)是线粒体健康的重要指示因子,因ΔΨm的维持需要线粒体呼吸链电子传递正常、即线粒体氧化功能正常[20],也因ΔΨm可以驱动ATP合酶生成ATP、即线粒体磷酸化正常,起到将线粒体氧化与磷酸化偶联的重要作用。JC-1是一种常用的ΔΨm检测荧光探针,在线粒体膜电位较高时, JC-1聚集在线粒体的基质(matrix)中,形成聚合物(J-aggregates),可以产生红色荧光;在线粒体膜电位较低时, JC-1不能聚集在线粒体的基质中,此时JC-1为单体(Monomer),可以产生绿色荧光;因此通过荧光颜色的转变来检测线粒体膜电位的变化,用红绿荧光的比值来衡量线粒体去极化程度。利用流式细胞术检测线粒体膜电势情况,高浓度(10-6mol/L)的β1-AA严重损伤线粒体功能(ΔΨm下降),与细胞生存结果、ATP含量结果一致,提示部分β1-AA阳性人群中心功能异常的可能是因为心肌线粒体功能障碍、最终心肌细胞死亡;低浓度(10-10、10-8mol/L)β1-AA刺激使得线粒体膜电势增高(10-9、10-7mol/L有增高的趋势),与ATP含量的结果相符,文献[21-22]报道,具有高运动能力的精子都具有更高的线粒体膜电势,提示高膜电势使得细胞具有更好的能量储备,低浓度β1-AA刺激使得细胞因增加膜电势而具有较好的能量储备、产生更多的ATP,进一步解释了部分β1-AA阳性者心功能正常的现象。
本文利用不同浓度β1-AA长时间刺激NRCMs、H9c2细胞,以模拟β1-AA在不同人群中的心功能表现,以期解释人群中β1-AA阳性者心功能不同的可能原因,为临床诊疗提供一定的病理生理学基础,即对于β1-AA阳性人群中心功能异常患者,可以采用去除或降低血清中β1-AA含量,亦可将保护线粒体功能、维持线粒体膜电势、提高ATP生成作为可能的治疗方向,对于心功能正常人群中β1-AA阳性者,实时监测β1-AA浓度和心功能,并且通过多种方法提高心肌线粒体功能,达到三级预防的效果,以此降低我国心血管疾病发病率和致死率,改善人民生活质量。
