半滑舌鳎gata5基因的克隆及表达分析
2019-06-12董忠典崔忠凯徐文腾陈松林
董忠典,张 宁,崔忠凯,徐文腾,陈松林
半滑舌鳎基因的克隆及表达分析
董忠典1,2,3,张 宁1,2,3,崔忠凯2,3,徐文腾2,3,陈松林2,3
(1. 广东海洋大学水产学院,广东 湛江 524088;2. 中国水产科学研究院 黄海水产研究所,山东 青岛 266071;3. 青岛海洋科学与技术国家实验室 / 海洋渔业科学与食物产出过程功能实验室,山东 青岛 266071)
【】研究半滑舌鳎()基因()的序列特征及该基因在半滑舌鳎性腺分化、成熟过程中的表达模式。【】通过克隆获得csgata5编码区序列,利用荧光定量PCR(RT-qPCR)方法检测mRNA在不同类型性腺、胚胎和性腺发育中的表达模式,借助原位杂交技术定位mRNA表达的细胞类型。【】克隆获得cDNA序列1 777 bp,包含1 167 bp的编码区(Coding sequence,CDS),262 bp 的5′UTR 和348 bp的 3′UTR区,预测编码388个氨基酸残基(aa),分子质量为41.9 ku,等电点为8.90,在C端含有两个典型的GATA锌指结构域;基因组分析显示位于半滑舌鳎10号染色体上,包含7个外显子和6个内含子区。RT-qPCR分析显示mRNA在2龄雄鱼和伪雄鱼精巢中表达高于卵巢;mRNA主要定位在卵母细胞、精原细胞和精子中。胚胎发育过程中,mRNA表达在1细胞期至囊胚期呈下降趋势,之后上升,至原肠胚期达到峰值,随后降低并维持较低水平至孵化出膜。在精巢发育过程中,mRNA表达水平呈升高趋势,在1龄达到检测的峰值;在卵巢发育过程中,mRNA表达趋势类似精巢,表达水平低于同期精巢。【】参与半滑舌鳎原肠胚期的组织器官分化,具有促进原始生殖细胞向雄性生殖细胞分化及雄性生殖细胞发育的作用。
半滑舌鳎;;RT-qPCR;原位杂交;性腺分化
半滑舌鳎()是我国重要海水养殖对象,其生长具有显著的性别二态性,1龄雌鱼的体重及生长速度是雄鱼的2~4倍[1]。半滑舌鳎性染色体组成类型是ZZ/ZW型,即遗传雌鱼为异型染色体ZW型,遗传雄鱼为同型染色体ZZ型[2]。有些遗传雌性的半滑舌鳎在人工养殖条件下其性腺会发育成精巢,这种鱼称为伪雄鱼[3]。研究发现,伪雄鱼可以产生精子繁殖后代,且后代中伪雄鱼比例更高,养殖中伪雄鱼的存在会导致养殖群体雄性比例增加,影响产业的健康发展[4]。因此,研究半滑舌鳎的性别决定和分化机制,发现与半滑舌鳎性别决定、分化相关的基因,培育高雌比例半滑舌鳎品种至关重要。
通过AFLP、微卫星及基因组测序技术筛选可获得半滑舌鳎遗传性别鉴定的分子标记[5-7]。Shao等[4]还利用半滑舌鳎的全基因组甲基化测序初步揭示了甲基化与半滑舌鳎性反转的关系。目前已经在半滑舌鳎中鉴定了多个性别相关的基因,如、、、、、、等[8-14]。
GATA家族是一类能够识别目标靶基因启动子区域GATA基序[T/A(GATA)A/G],并与之结合的一类转录调节因子,在脊椎动物的细胞增殖、生殖细胞分化和繁殖等生命活动中发挥重要作用[15-18]。脊椎动物GATA家族主要包含6种GATA基因,可以分为GATA1/2/3亚家族和GATA4/5/6亚家族[19],其中GATA4/5/6主要表达于心脏和性腺等内胚源组织,对脊椎动物性腺生长和分化起重要作用[20-24]。GATA4能够通过和剪接因子(splicing factor 1,SF1)的协同作用激活抗穆勒氏管激素(anti-Mullerian hormone,AMH)的表达,引发缪勒氏管的单向退化从而影响脊椎动物性别分化。GATA4和GATA6可以通过调节支持细胞和间质细胞来促进精子的成熟[23-30]。GATA5最早被发现表达于非洲爪蟾()和原鸡()的心脏、肠中,在其他鸟类和两栖动物相同组织中也有表达,而关于GATA5在性腺发育及生殖过程中的研究较少[31-32]。在小鼠()中,纯合GATA5突变体是可育的,但雌性表现出明显的泌尿生殖系统异常,雄性泌尿生殖系统不受影响[32]。
本研究以半滑舌鳎为研究对象,利用分子克隆方法获得编码序列,荧光定量PCR(RT-qPCR)技术检测了该基因在胚胎和性腺发育过程中的表达模式,通过原位杂交技术明示在精巢和卵巢中的细胞定位,以期为进一步阐明鱼类在性腺分化及繁殖过程中的功能提供数据和参考。
1 材料和方法
1.1 材料
本研究所用半滑舌鳎取自山东海阳黄海水产有限公司提供。成鱼(2龄)半滑舌鳎雌、雄、伪雄鱼各3尾,经麻醉剂MS-222麻醉后解剖。取一侧性腺组织于液氮速冻保存用于RNA提取,另一侧性腺组织用质量分数4%多聚甲醛PFA固定;分别收集不同发育时期的胚胎(1细胞、32细胞期、囊胚期、原肠胚期、胚体雏形期、心跳期、晶体期、脑分化期、胚胎扭动期、孵化出膜)40~50枚,液氮速冻保存,用于RNA提取。不同生长时期(52、80、126、150、180、210 d和1 a)性腺取样如下:解剖后取一侧性腺于液氮中速冻保存,用于RNA提取;另一侧用质量分数2%的戊二醛固定,用于生理性别鉴定;取部分鳍条于体积分数95%的酒精中保存,用于基因组DNA提取。
1.2 引物设计及合成
根据mRNA序列(Genebank: XM_0250 59544)及半滑舌鳎基因组数据(GCA_000523025.1)设计引物,以(Genebank: XM_008307613.1)作为定量的内参基因[14],引物序列见表1,引物由苏州金唯智生物科技有限公司合成。

表1 引物及用途
1.3 半滑舌鳎生理及遗传性别鉴定
半滑舌鳎性腺组织用质量分数2%戊二醛固定12 h后参考Zhang[33]方法进行切片制备,观察生理性别;遗传性别鉴定参考文献[7]。
1.4 csgata5克隆及分析
参照Trizol试剂操作说明(Invitrogen,上海)提取各样本总RNA,经电泳和浓度测定后,参照PrimeScriptTMRT regent kit with gDNA Eraser(TaKaRa,大连)说明书进行cDNA合成。以2龄精巢cDNA为模板,以、为引物对,进行PCR扩增。反应体系50.0 μL:10× LA Buffer 5.0 μL,dNTPs(2.5 mmol/L)4.0 μL,上下游引物(10.0 μmol/L)各1.0 μL,cDNA 3.0 μL,LATaq E 0.5μL,ddH2O 35.5 μL。反应条件:95 ℃预变性 2 min;变性95 ℃ 30 s,退火 58 ℃ 30 s,延伸72 ℃ 1 min,35个循环,72 ℃总延伸 10 min;4 ℃保存。PCR产物经切胶回收纯化后链接pEASY-T1载体并转化至大肠杆菌,并将阳性克隆送至金唯智生物科技有限公司进行测序,测序结果用DNASTAR进行结果比对拼接,根据验证后序列设计定量、原位杂交引物(表1)用于后续分析用ChromasPro检测测序质量,用DNASTAR对测序结果进行拼接,经BLAST(https://blast.ncbi.nlm.nih. gov/Blast.cgi)确定序列准确后,Clustal Omega(https://www.ebi.ac.uk/Tools/msa/clustalo/)进行氨基酸比对,进一步采用邻位连接法(Neighbor-Joining,NJ)构建GATA4/5/6亚家族系统进化树,各节点置信度采用bootstrap重抽样1 000次获得。
1.5 csgata5 mRNA表达模式分析
通过RT-qPCR方法检测mRNA在2龄雌、雄、伪雄半滑舌鳎性腺中的表达模式,以及在胚胎和性腺发育不同时期表达水平的变化。RT-qPCR反应在7500 Fast Real-time PCR仪(Applied Biosystems,美国)上进行。PCR反应体系如下:7.5 μL 2×SYBR Premix Ex Taq II (Tli RNaseH Plus),上、下游引物(10.0 μmol/L)各0.6 μL,0.3 μL ROX Reference Dye II,cDNA 1.5 μL,ddH2O 4.5 μL。RT-qPCR反应条件:95℃ 30 s,95 ℃ 5 s,60 ℃ 34 s,40个循环。以作为内参基因对mRNA表达水平进行校正,基因相对表达水平用2-ΔΔCt计算,数据用SPSS 19.0进行统计学分析。
1.6 csgata5 mRNA在性腺中的定位检测
以&为引物,以精巢cDNA为模板进行PCR扩增,用和对纯化后PCR产物和pBluescript II SK(+)质粒进行双酶切,连接转化取阳性克隆测序获得原位杂交重组质粒,参照罗氏体外转录试剂盒(Roche Diagnostics GmbH,德国)操作说明进行地高辛标记探针的合成,原位杂交具体步骤参见Dong等[14]的方法。
2 结果与分析
2.1 csgata5序列特征分析
通过克隆测序获得完整编码区(CDS)(1 167 bp)和部分5′UTR(262 bp)、3′UTR(348 bp)区的cDNA序列共1 777 bp(图1);基因组分析表明定位在半滑舌鳎10号染色体上,包含7个外显子和6个内含子区,蛋白编码起始于第2外显子,终止于第7外显子上(图2)。预测编码388个氨基酸残基(aa),分子质量为41.9 ku,等电点为8.90。在第 190~214 aa 和 245~269 aa 位置分别含有两个典型的GATA锌指结构域(Cys-X2-Cys-X17-Cys-X2-Cys)。

大写字母表示完整编码区CDS,小写字母表示5′UTR和3′UTR,起始密码子和终止密码子用方框标注,GATA锌指结构域用下划线表示
2.2 GATA家族蛋白序列比对和进化分析
对半滑舌鳎GATA家族基因结构分析,结果显示GATA1/2/3编码区包含5个外显子;GATA4/5/6亚家族基因编码区包含6个外显子(图2),蛋白序列分析显示半滑舌鳎GATA家族蛋白的C-端均含有两个典型的GATA锌指结构域(Cys-X2-Cys-X17-Cys-X2-Cys)(图3)。
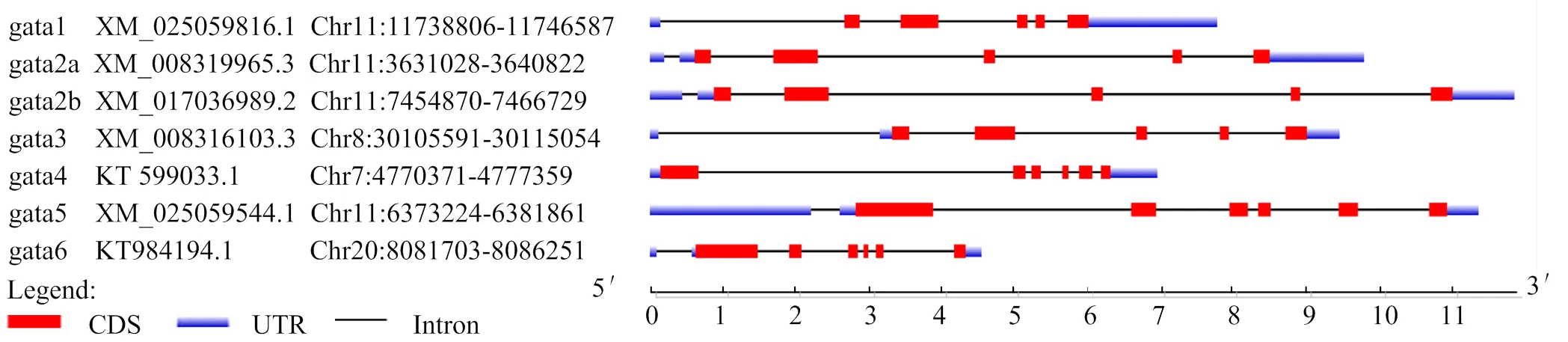
图2 半滑舌鳎GATA家族基因结构示意

方框表示GATA锌指结构域,箭头表示保守半胱氨酸位点
在不同物种中,GATA4/5/6亚家族系统进化树分析(图4)显示,GATA4/5/6蛋白分为两个分支,GATA6蛋白聚类在一起形成进化树的一个分支,GATA4和GATA5蛋白聚类在一起作为进化树的另一个分支。在GATA5蛋白中,半滑舌鳎GATA5蛋白首先和硬骨鱼类GATA5蛋白聚类在一起,随后和爬行类、鸟类、两栖类及哺乳类的GATA5蛋白聚类在一起。进一步对不同物种及其上下游基因进行共线性分析,结果显示(图5),不同物种中与其邻近的几个基因具有保守的共线性关系。在所比对物种中下游均为基因,随后在鱼类中依次为、、;在其他脊椎动物中则为、、。在上游区域中基因排列在不同物种中有较大差异:相比于斑马鱼()、西部锦龟()、原鸡、小鼠、智人()半滑舌鳎基因和基因之间存在多个基因的插入。

图4 GATA4/5/6家族成员系统进化树
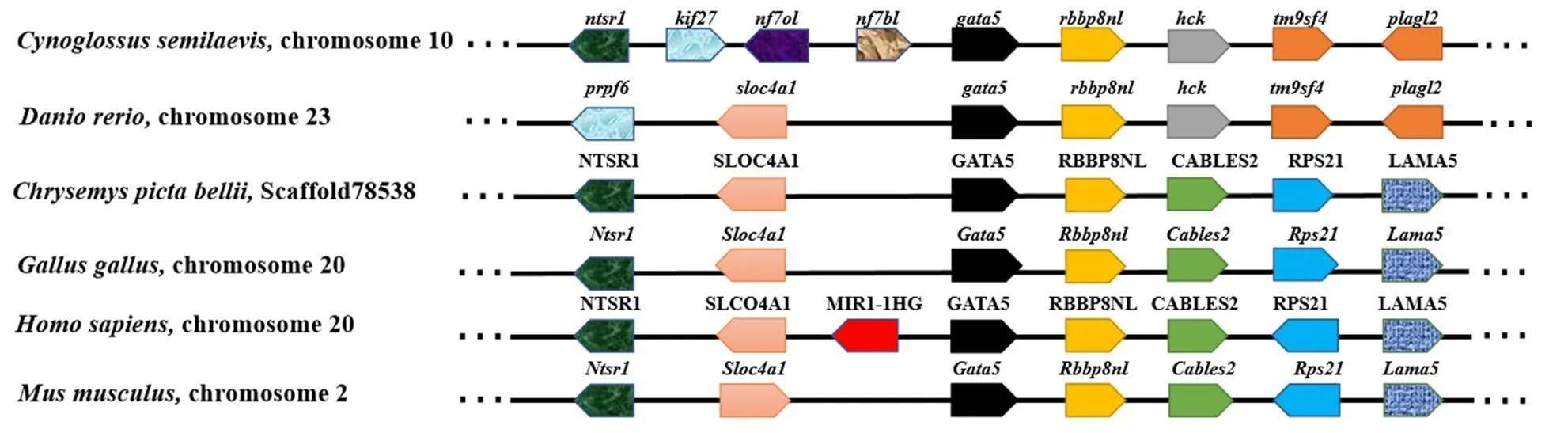
图5 gata5与其邻近基因在半滑舌鳎和其他脊椎动物中共线性关系
2.3 csgata5 mRNA表达检测
对mRNA在2龄半滑舌鳎不同性腺中的表达进行定量检测,以基因对进行校正[14]。结果显示mRNA在精巢中表达水平显著高于卵巢(<0.05),在雄性和伪雄鱼精巢中表达水平相近(图6A)。在胚胎发育不同阶段,mRNA在原肠期表达最高(图6B)(<0.05);mRNA在受精卵到囊胚期阶段表达水平下降,在原肠胚期表达突然升高,随后降低并维持较低水平表达至孵化出膜,这其中在晶体期mRNA相对表达水平相比于其他检测时期较高。在精巢发育过程中,mRNA随着发育进行表达水平逐渐升高,在1龄时期达到检测的最高表达水平(图6C)(<0.05),mRNA在相同发育时期的卵巢中表达水平低于卵巢(图6C),mRNA在52~210 d时期的卵巢中表达维持在较低的水平,在1龄卵巢中表达水平有显著升高(图6C)(<0.05)。
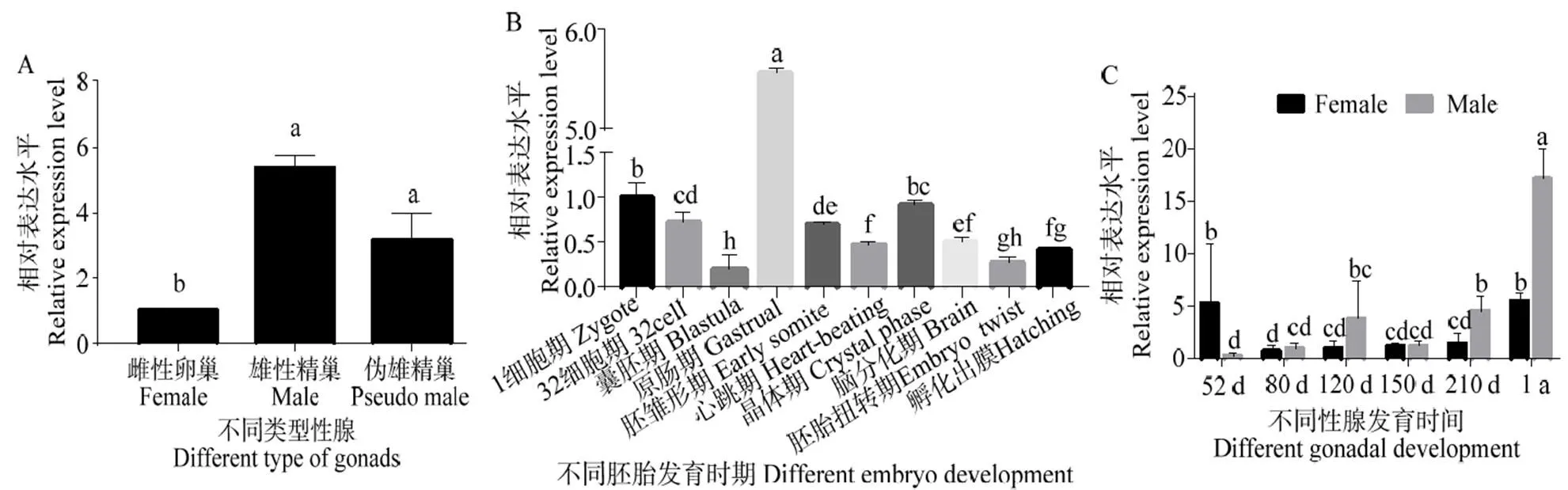
凡有一个标记相同字母即为差异不具统计学意义(P > 0.05)
2.4 csgata5 mRNA在性腺细胞的定位
利用合成的RNA探针对2龄半滑舌鳎雌鱼卵巢和雄精巢进行原位杂交,结果如图7显示,正义探针在卵巢和精巢中均无杂交信号(图7A,C);反义探针在卵巢的卵母细胞中有较弱的杂交信号(图7 B),在雄鱼精巢的精原细胞和精子中有较强的杂交信号(图7 D)。

A:2龄雌鱼正义探针杂交结果;B:2龄雌鱼反义探针杂交结果;C:2龄雄鱼正义探针杂交结果;D:2龄雄鱼反义探针杂交结果;OC:卵母细胞;SP:精子;SG:精原细胞;标尺:100 μm
3 讨论
本研究获得了完整的编码区序列,定位在半滑舌鳎10号染色体上,包含7个外显子和6个内含子区,蛋白编码起始于第2外显子,终止于第7外显子上。在半滑舌鳎基因组中共发现7个家族成员GATA1/2a/2b/3/4/5/6,都定位在常染色体上。半滑舌鳎GATA1/2/3和GATA4/5/6两个亚家族基因编码区分别为5个和6个外显子,在半滑舌鳎中含有两个成员,即和,这是因为在鱼类中发生了一次复制[34]。在尼罗罗非鱼中同样鉴定了7个GATA家族成员,即GATA1/2a/2b/3/4/5/6[35]。GATA4/5/6亚家族系统进化分析显示,GATA成员在物种间的保守性要高于在同一物种内GATA家族成员之间的保守性。在进化关系上GATA4/5/6亚家族之间GATA4和GATA5在进化关系上相比于GATA6更接近。
mRNA在2龄半滑舌鳎精巢中的表达水平显著高于卵巢,这与半滑舌鳎GATA4/5/6亚家族中和mRNA的表达模式相似[23-24],GATA4和GATA6可以通过调节支持细胞和间质细胞来促进精子的成熟[23-30, 36-37],说明GATA5在半滑舌鳎性腺中发挥了相似的功能。性腺切片原位杂交结果显示mRNA主要定在生殖细胞中。
在脊椎动物胚胎发育过程中,从受精开始到卵裂期很多基因的表达都受母源效应影响[38-39]。本研究中,mRNA主要在半滑舌鳎成熟卵巢的卵母细胞中表达,通过母源遗传给后代,表现为mRNA在卵裂期至囊胚期呈较低表达水平并持续下降。在鱼类胚胎发育过程中,原肠胚期主要发生内胚源和中胚源组织器官的分化,而GATA4/5/6亚家族基因主要在内胚源和中胚源组织中表达,故而在该阶段mRNA表达水平显著升高。
雌性半滑舌鳎在孵化后120 d,卵巢腔形成并开始出现初级卵母细胞,200 d左右卵巢腔分化完成,卵巢达到1期卵巢[40-41]。本研究中,mRNA在52 d至210 d卵巢中维持在较低表达水平,在1龄时期表达水平达到检测的峰值,因此,可能不参与半滑舌鳎卵巢的分化,而是在卵母细胞的成熟中发挥作用。在雄性半滑舌鳎发育过程中,孵化后120 d精巢开始出现精小叶,标志着精巢开始分化[41],在150 d精巢内形成多个精小叶,精小叶中含有多个精原细胞和初级精母细胞形成的精小囊,在190 d精巢中出现了初级精原细胞、次级精原细胞、初期精母细胞和二期精母细胞,在225 d有成熟精子发生[42]。本研究中,mRNA在半滑舌鳎精巢发育过程中的表达变化,可能说明该基因在半滑舌鳎原始生殖细胞向精原细胞分化以及初级精母细胞产生过程中发挥作用,并且参与了随后的精子发生过程,在维持精子成熟中具有重要作用。综上,具有促进原始生殖细胞向雄性生殖细胞分化的作用,并维持生殖细胞的成熟。
[1] CHEN S L, ZHANG G J, SHAO C W, et al. Whole-genome sequence of a flatfish provides insights into ZW sex chromosome evolution and adaptation to a benthic lifestyle[J]. Nature Genetics, 2014, 46(3): 253-260.
[2] ZHUANG Z M, WU D, ZHANG S C, et al. G-banding patterns of the chromosomes of tonguefishGunther, 1873[J]. Journal of Applied Ichthyology, 2010, 22(5): 437-440.
[3] 季相山, 陈松林,马洪雨, 等. 半滑舌鳎养殖群体中自然性逆转伪雄鱼的发现[J]. 水产学报, 2010, 34(2): 322-327.
[4] SHAO C W, LI Q Y, CHEN S L, et al. Epigenetic modification and inheritance in sexual reversal of fish[J]. Genome Research, 2014, 24(4): 604-615.
[5] CHEN S L, LI J, DENG S P, et al. Isolation of female-Specific AFLP markers and molecular identification of genetic sex in half-smooth tongue sole ()[J]. Marine Biotechnology (New York), 2007, 9(2): 273-280.
[6] 刘洋, 陈松林, 高峰涛, 等. 半滑舌鳎性别特异微卫星标记的SCAR转化及其应用[J]. 农业生物技术学报, 2014, 22(6): 787-792.
[7] 董忠典, 张宁, 徐文腾, 等. 一种快速鉴定半滑舌鳎遗传性别的方法[J]. 农业生物技术学报, 2016, 24(5): 764-769.
[8] LI H L, XU W T, ZHANG N, et al. Two figla homologues have disparate functions during sex differentiation in half-smooth tongue sole ()[J]. Scientific Reports, 2016, 6(1): 28219.
[9] LI H L, XU WT, ZHU Y, et al. Characterization and expression pattern of r-spondin1 in[J]. Journal of Experimental Zoology Part B Molecular and Developmental Evolution. 2017, 328(8): 772-780.
[10] 邓思平, 陈松林, 刘本伟, 等. 半滑舌鳎脑芳香化酶基因cDNA克隆及表达分析[J].动物学研究, 2008, 29(1): 17-24.
[11] DONG X L, CHEN S L, JI X S, et al., Molecular cloning, characterization and expression analysis ofandgenes in half-smooth tongue sole () [J]. Acta Oceanologica Sinica, 2011, 30(1): 68-77.
[12] WANG L N, ZHU Y, XU W T, et al., Molecular characterization ofduring sex development in Chinese tongue sole () [J]. Biochemical and Biophysical Research Communications, 2017, 494(3/4): 714-718.
[13] CUI Z, LIU Y, WANG W W, et al, Genome editing revealsas an essential male sex-determining gene in Chinese tongue sole () [J]. Scientific Reports, 2017, 7: 42213.
[14] DONG Z D, ZHANG N, LIU Y, et al. Expression analysis and characterization ofin the Chinese tongue sole () [J]. Gene, 2019, 683: 72-79.
[15] PEVNY L, SIMON M C, ROBERTSON E, et al. Erythroid differentiation in chimaeric mice blocked by a targeted mutation in the gene for transcription factor GATA-1[J]. Nature, 1991, 349(6306): 257-260.
[16] MERIKA M, ORKIN S H. DNA-binding specificity of GATA family transcription factors[J]. Molecular & Cellular Biology, 1993, 13(7): 3999-4010.
[17] KATSUMURA K R, BRESNICK E H. The GATA factor revolution in hematology[J]. Blood, 2017, 129(15): 2092-2102.
[18] LIN H Y, ZENG D, LIANG Y K, et al. GATA3 and TRPS1 are distinct biomarkers and prognostic factors in breast cancer: database mining for GATA family members in malignancies[J]. Oncotarget, 2017, 8(21): 34750-34761.
[19] LOWRY J A, ATCHLEY W R. Molecular evolution of the GATA family of transcription factors: conservation within the DNA-binding domain[J]. Journal of Molecular Evolution, 2000, 50(2): 103-115.
[20] PATIENT R K, MCGHEE J D. The GATA family (vertebrates and invertebrates)[J]. Current Opinion in Genetics & Development, 2002, 12(4): 416-422.
[21] WEN B, YUAN H, LIU X H, et al. GATA5 Sumoylation is indispensable for zebrafish cardiac development[J]. Biochimica et Biophysica Acta (BBA) - General Subjects, 2017, 1861(7): S0304416517300880.
[22] HEMPEL M, CASAR T T, DIEHL T, et al. Compound heterozygous GATA5 mutations in a girl with hydrops fetalis, congenital heart defects and genital anomalies[J]. Human Genetics, 2017, 136(3): 339-346.
[23] LIU J X,ZHANG W,SUN Y, et al. Molecular characterization and expression profiles of GATA6 in tongue sole () [J]. Comp Biochem Physiol B Biochem Mol Biol, 2016, 198: 19-26.
[24] LIU J X,ZHANG W,DU X X, et al. Molecular characterization and functional analysis of the GATA4 in tongue sole()[J]. Comparative Biochemistry & Physiology Part B, 2016, 193(2): 1-8.
[25] BIELINSKA M,SEEHRA A,TOPPARI J, et al. GATA-4 is required for sex steroidogenic cell development in the fetal mouse[J]. Developmental Dynamics, 2010, 236(1): 203-213.
[26] KETOLA I, PENTIKÄINEN V, VASKIVUO T, et al. Expression of transcription factor GATA-4 during human testicular development and disease[J]. Journal of Clinical Endocrinology & Metabolism, 2000, 85(10): 3925-3931.
[27] WATANABE K, CLARKE T R,LANE A H, et al. Endogenous expression of Müllerian inhibiting substance in early postnatal rat Sertoli cells requires multiple steroidogenic factor-1 and GATA-4-binding sites[J]. Proceedings of the National Academy of Sciences of the United States of America, 2000, 97(4): 1624-1629.
[28] ROBERT N M, TREMBLAY J J, VIGER R S. Friend of GATA (FOG)-1 and FOG-2 differentially repress the GATA-dependent activity of multiple gonadal promoters[J]. Endocrinology, 2002, 143(10): 3963-3973.
[29] BOUMA G J,WASHBURN L L,ALBRECHT K H, et al. Correct dosage ofand Gata4 transcription factors is critical for fetal testis development in mice[J]. Proceedings of the National Academy of Sciences of the United States of America, 2007, 104(38): 14994-14999.
[30] LI J Z,CHEN W J, WANG D S, et al. GATA4 is involved in the gonadal development and maturation of the teleost fish tilapia,[J]. Journal of Reproduction & Development, 2012, 58(2): 237-242.
[31] WEBER H. SYMES C E, WALMSLEY M E, et al. A role for GATA5 inendoderm specification[J]. Development, 2000, 127(20): 4345-4360.
[32] MOLKENTIN J D, TYMITZ K M,RICHARDSON J A, et al. Abnormalities of the genitourinary tract in female mice lacking GATA5[J]. Mol cell biol, 2000, 20(14): 5256-5260.
[33] ZHANG L Y, LIU W J,SHAO C W, et al. Cloning, expression and methylation analysis of piwil2 in half-smooth tongue sole ()[J]. Marine Genomics, 2014, 18: 45-54.
[34] 叶凯. 尼罗罗非鱼GATA因子表达及其功能的初步研究[D]. 重庆: 西南大学, 2012.
[35] 张未丽, 刘智皓,吴风瑞, 等. 转录因子GATA-2在脊椎动物发育过程中的作用[J]. 四川动物, 2009, 28(6): 945-948.
[36] LIU X M, LI Z, WANG B, et al. GATA4 is a transcriptional regulator of R-spondin1 in Japanese flounder () [J]. Gene, 2018, 648: 68-75
[37] LI Z,LIU X, SUN Y, et al. Roles of GATA6 during gonadal development in Japanese flounder: gonadogenesis, regulation of gender-related genes, estrogen formation and gonadal function maintenance[J]. International Journal of Molecular Sciences, 2017, 18(1): 160.
[38] DE SOUSA P A,CAVENEY A,WESTHUSIN M E, et al. Temporal patterns of embryonic gene expression and their dependence on oogenetic factors[J]. Theriogenology, 1998, 49(1): 115-128.
[39] 马馨, 张胜, 杨树宝, 等. 母源效应蛋白在基因组印记维持中的作用[J]. 遗传, 2014, 36(10): 959-964.
[40] 柳学周, 徐永江, 刘乃真, 等. 半滑舌鳎卵巢发育的组织学和形态数量特征研究[J]. 渔业科学进展, 2009, 30(6): 25-35.
[41] 刘长琳. 半滑舌鳎麻醉及性腺分化的研究[D]. 武汉: 华中农业大学, 2007.
[42] 吴莹莹. 半滑舌鳎精子发生及其受精过程[D]. 青岛: 中国海洋大学, 2008.
Cloning and Expression Analysis ofin Chinese Tongue Sole
DONG Zhong-dian1,2,3, ZHANG Ning1,2,3, CUI Zhong-kai2,3, XU Wen-teng2,3, CHEN Song-lin2,3
(1.,524088,; 2.,,266071,; 3./,266071,)
【】In order to elucidate the gene function ofof Chinese tongue sole()(), the sequence characteristics and the expression patterns of this gene in Chinese tongue sole were studied.【】The coding region ofwas obtained by cloning and the expression pattern ofmRNA in embryonic development and gonadal development was detected by real-time PCR(RT-qPCR).hybridization was used to localize the expression ofmRNA in the gonads.【】ThecDNA sequence is 1 777 bp in length and contains the entire coding region of 1 167 bp, the 262 bp 5′UTR and 348 bp 3′UTR. The location ofis on chromose 10, and it includes seven exons and six introns. The predicted protein ofcontains 388 amino acid residues(aa), the molecular weight is 41.9 ku, the isoelectric point is 8.90, and it has two typical GATA zinc finger binding domains at the C-terminus. Phylogenetic analysis shows that the same GATA proteins are clustered together, and the clustering pattern is independent of species. The expression levels ofmRNA are higher in the testis of two-years old male and pseudomale than in the ovary of two-years old female and it is mainly localized in the oocytes, spermatogonia and sperm. During embryonic development, the expression levels ofmRNA decrease from the cleavage stage to the blastocyst stage, peak at the gastrula stage, and then decrease and maintain at a lower level until hatching. During the development of testis, the expression levels ofmRNA tend to increase, reaching the peak of detection at the age of one-year old. In the ovary, the expression profile ofmRNA is similar to that of the testis, and the expression level is lower than that of the testis.【】These results show thatmay be involved in the differentiation of organs in the gastrula stage of Chinese tongue sole; it has the effect of promoting the differentiation of primordial germ cells into male germ cells and the development of male germ cells.
;; RT-qPCR;hybridization; gonadal differentiation
S917.4
A
1673-9159(2019)03-0006-09
10.3969/j.issn.1673-9159.2019.03.002
2019-03-09
黄海水产研究所科研事业单位基本科研业务费项目(20603022017003);山东省泰山学者攀登计划项目;国家自然科学基金青年科学基金项目(31402293);广东海洋大学博士启动项目
董忠典(1987-),男,博士,讲师,研究方向为水产生物技术研究。E-mail:dzhd888@163.com
陈松林(1960-),男,博士,研究员,研究方向为水产生物技术研究。E-mail:chensl@ysfri.ac.cn
董忠典,张宁,崔忠凯,等. 半滑舌鳎基因的克隆及表达分析[J]. 广东海洋大学学报,2019,39(3):6-14.
(责任编辑:刘朏)
