不同类型视网膜病变患者视网膜外层厚度变化研究△
2019-06-12雷祥范珂崔红培李漫丽李翔武文忠栗占荣赵朝霞
雷祥 范珂 崔红培 李漫丽 李翔 武文忠 栗占荣 赵朝霞
糖尿病视网膜病变(diabetic retinopathy,DR)是糖尿病(diabetes mellitus,DM)常见微血管并发症,是导致患者视功能下降、生活质量降低的重要原因[1]。早期认为DR发病主要与血视网膜屏障破坏有关[2]。近期也有研究发现,DR早期即伴有神经细胞受损,视网膜神经节细胞、神经胶质细胞凋亡,伴视网膜厚度及视网膜神经纤维层厚度(retinal nerve fiber layer,RNFL)改变,且其改变可能早于微血管病变[3]。而光学相干断层扫描(optical coherence tomography,OCT)是目前用于检查视网膜各层细微结构改变及定量测定视网膜厚度的非侵入性、非接触性、新型组织形态学检查工具,对视网膜形态学改变及厚度变化检测有较高的敏感度[4]。基于此,本研究采用OCT技术检测正常健康人与DM伴或不伴DR患者视网膜厚度的变化,旨在明确DR早期组织形态改变,为DR诊疗提供依据。
1 资料与方法
1.1 一般资料 选择2015年2月至2017年1月于河南省人民医院收治的DM患者194例(194眼)。纳入标准:均经空腹血糖、餐后2 h血糖及糖化血红蛋白确诊为DM;经荧光素眼底血管造影或散瞳眼底检查确诊为无糖尿病视网膜病变(non-diabetic retinopathy,NDR)组或DR,增殖型DR(proliferative DR,PDR)满足PDR诊断标准[5];DM病程>3个月;双眼中选择病变较重患眼纳入研究,若双眼病情相似则选右侧患眼,单眼患病者取单侧患眼,患眼未合并其他眼底疾病;最佳矫正视力0.1~1.0,可中心固视或内固视;屈光不正≤±2.0 DS;无高血压病史及眼部手术史。排除标准:青光眼、虹膜睫状体炎、葡萄膜炎、视网膜血管炎或视网膜静脉阻塞者;严重白内障、玻璃体积血及角膜瘢痕者;已接受治疗的黄斑水肿(macular edema,ME)者;有激光治疗史者;无法行OCT检查者;眼压>21 mmHg (1 kPa=7.5 mmHg)者;合并高血压、冠心病、心功能不全、血液系统疾病、红斑狼疮、贫血等全身疾病者。其中NDR患者75例为NDR组;PDR患者64例为PDR组;DR并黄斑水肿(diabetic ME,DME)患者55例,为DME组[3-4]。NDR组男42例,女33例;年龄32~66(51.1±5.3)岁;DM病程3个月~3 a,平均(7.1±2.1)个月。PDR组男39例,女25例;年龄33~67(51.3±4.9)岁;DM病程3个月~4 a,平均(7.3±2.4)个月;其中Ⅳ期39例,Ⅴ期25例。DME组男35例,女20例;年龄32~67(51.7±5.0)岁;DM病程4个月~3 a,平均(7.5±2.5)个月。选择同期来医院体检的50名(50眼,右眼)正常健康人作为对照组。年龄、性别与DM患者相匹配;无不适主诉;眼科常规检查未见异常;最佳矫正视力≥1.0,屈光度≤±2.0 DS;无眼部手术史;无DM、高血压;无眼部畸形且可获得清晰OCT图像(图1A-D)。其中男32名,女18名;年龄34~66(51.4±5.6)岁。NDR组、PDR组、DME组、对照组性别、年龄等一般资料比较差异均无统计学意义(均为P>0.05)。
图1 各组OCT图。A:对照组;B:NDR组;C:PDR组;D:DME组
1.2 方法 所有患者入院后均行最佳矫正视力及常规眼科检查,并于上午10:00行OCT检查,采用海德堡Spectralis OCT(德国海德堡公司)对受试者黄斑部行辐射线性扫描,采用内固视法,参照文献[6]全部对象检查前均充分散瞳,下颌放置于颌架,内注视,以黄斑中心凹为中心,采用“容积扫描”模式,扫描线长度为6 mm,间隔0.5 mm,夹角30°,分别自左往右,自下而上进行垂直及水平线性扫描,选择信号强度评分超过60分的图片,均由同一位检测者利用自带图像分析软件自动测量视网膜光感受器层外节厚度(photoreceptor retinal outer segment,PROS)、RNFL、视网膜光感受器厚度(total length of the photoreceptors,TLP),PROS由系统自带检测卡测定黄斑中心凹处PROS,测定部位包括黄斑中心凹、黄斑中心凹外750 μm旁中心凹;RNFL由系统自动识别视盘中心,确定直径3.4 mm测量环位置,自6 mm方形区域提取数据,分析该环上RNFL厚度;TLP为内节及外节厚度之和,黄斑中心凹每次均获得6张视网膜断层图片,旁中心凹每次均获得12次视网膜断层图像(图2),取均值。

图2 OCT测量正常人视网膜RNFL(红线)、TLP(IS/OS黄线所示)、PROS(黄线下半段)图

2 结果
2.1 各组黄斑中心凹、旁中心凹PROS比较 四组黄斑中心凹PROS比较差异有统计学意义(P<0.05)。PDR组、DME组黄斑中心凹PROS低于对照组(t=4.131、5.844,均为P<0.05)与NDR组(t=4.044、6.359,均为P<0.05);DME组PROS低于PDR组,差异有统计学意义(t=2.939,P<0.05),四组旁中心凹鼻上、颞上PROS比较差异均无统计学意义(均为P>0.05),见表1。
表1 各组黄斑中心凹、旁中心凹PROS比较
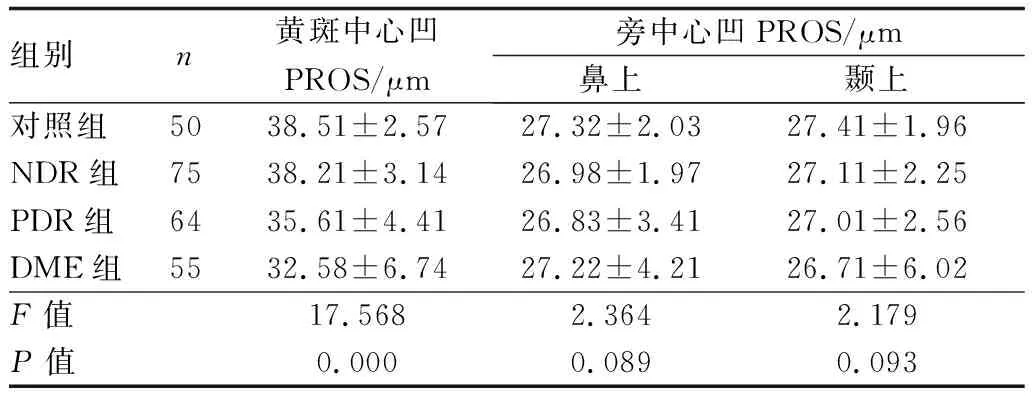
组别n黄斑中心凹PROS/μm旁中心凹PROS/μm鼻上颞上对照组5038.51±2.5727.32±2.0327.41±1.96NDR组7538.21±3.1426.98±1.9727.11±2.25PDR组6435.61±4.4126.83±3.4127.01±2.56DME组5532.58±6.7427.22±4.2126.71±6.02F值17.5682.3642.179P值0.0000.0890.093
2.2 各组黄斑中心凹、旁中心凹TLP比较 四组黄斑中心凹TLP比较差异有统计学意义(P<0.05),PDR组、DME组黄斑中心凹TLP短于对照组(t=4.618、12.952,均为P<0.05)与NDR组(t=3.957、11.899,均为P<0.05),DME组TLP短于PDR组,差异有统计学意义(t=7.260,P<0.05),四组旁中心凹鼻上、颞上TLP比较差异均无统计学意义(均为P>0.05),见表2。
表2 各组黄斑中心凹、旁中心凹TLP比较

组别n黄斑中心凹TLP/μm旁中心凹TLP/μm鼻上颞上对照组5050.71±2.4936.06±3.0237.06±2.17NDR组7550.26±3.0536.17±2.5936.74±2.79PDR组6448.14±3.2636.51±3.8736.65±3.02DME组5544.11±2.7136.71±5.4436.59±4.79F值14.6581.7881.597P值0.0000.1260.216
2.3 各组黄斑中心凹、旁中心凹RNFL比较 四组黄斑中心凹、旁中心凹RNFL比较差异有统计学意义(P<0.05),PDR组、DME组黄斑中心凹、旁中心凹鼻上及颞上RNFL均低于对照组(tPDR组=6.408、9.195、7.717,均为P<0.05;tDME组=10.834、13.742、12.657,均为P<0.05)与NDR组(tPDR组=5.738、7.564、7.909,均为P<0.05;tDME组=9.329、10.565、12.707,均为P<0.05),DME组黄斑中心凹、旁中心凹鼻上及颞上RNFL又低于PDR组,差异均有统计学意义(t=3.468、4.045、4.465,均为P<0.05),见表3。
表3 各组黄斑中心凹、旁中心凹RNFL比较

组别n黄斑中心凹RNFL/μm旁中心凹RNFL/μm鼻上颞上对照组5059.05±4.3373.12±5.0670.26±4.79NDR组7558.52±5.7972.77±7.6569.89±5.02PDR组6453.02±5.4464.25±5.1563.25±4.83DME组5549.85±4.3660.74±4.1659.66±3.77F值13.54712.37411.768P值0.0000.0000.000
2.4 各组最佳矫正视力比较 四组最佳矫正视力比较差异有统计学意义(F=10.674,P<0.05),PDR、DME组最佳矫正视力分别为0.81±0.24、0.55±0.23,均低于对照组1.00(tPDR组=5.592,P<0.05;tDME组=13.828,P<0.05)与NDR组1.00(tPDR组=6.860,P<0.05;tDME组=16.968,P<0.05),DME组视力又低于PDR组,差异有统计学意义(t=6.006,P<0.05)。
2.5 DR患者黄斑中心凹PROS、TLP及RNFL与最佳矫正视力相关性 DR患者黄斑中心凹PROS、TLP及RNFL均与患者最佳矫正视力呈正相关(r=0.567、0.478、0.551,均为P<0.05),其中PROS相关度最高(P<0.05),即DR患者黄斑中心凹PROS、TLP、RNFL越高,患者最佳矫正视力越好。
3 讨论
DR所引起黄斑水肿是成年人群视力降低及致盲的主要原因[7]。目前认为血-视网膜屏障破坏所致视网膜组织层液体聚集及视网膜厚度变化是引起视力降低的重要原因[8]。但Berkowitz等[9]指出,DR患者神经元变性、神经脱髓鞘、轴突萎缩等神经病变早于视网膜血管病变。而早期研究报道多围绕视网膜内核厚度变化展开[10-11],少有报道对视网膜外层PROS厚度的变化进行研究,而视网膜变性及黄斑病变等其首要病变均出现于视网膜外层,以光感受器层与色素上皮细胞层为主[12]。而外界膜、IS/OS交界连接带、视锥细胞外节末梢则均存在于光感受器细胞内,且其高反射光带的完整性直接影响光感受器细胞功能状态及其完整性。Toprak等[13]建立动物模型,并采用频谱OCT进行视网膜结构及功能筛查,发现IS/OS条带所对应视网膜组织为光感受器细胞内节椭圆体,因此认为IS/OS异常可能与光感受器线粒体异常有关,即视网膜光感受器细胞能量代谢异常,其功能受损,引起该区域细胞变性及坏死,导致视力降低,因此提出黄斑区IS/OS缺损或断裂均为患者视力异常的反馈。
研究发现,长期处于高血糖状态可能对血-视网膜屏障产生干扰,造成黄斑区视网膜增厚,引起毛细血管通透性提升,导致水分进入组织内,导致视网膜增厚[14]。PROS、TLP均为反映视网膜光感受器厚度及长度的指标,其水平的变化在很大程度上反映视网膜变性及早期黄斑病变。本研究对正常健康人、NDR、PDR及DME患者PROS、TLP监测发现,PDR与DME患者PROS较健康人与NDR患者薄,TLP较健康人及NDR短,分析原因可能为DM患者视网膜微血管长期暴露于高血糖环境内,可造成眼部微血管病变,导致视网膜功能降低,早期DR患者均伴不同程度脉络膜毛细血管萎缩及内皮细胞功能受损,导致蛋白、脂质、细胞等成分渗出视网膜血管,而大分子物质无法通过外界膜,并聚集于外界膜前,引起渗透压增加,导致细胞外液聚集于同视网膜内核层,造成黄斑区肿胀,进一步引起组织缺氧、缺血,造成血-视网膜屏障破坏,引起光感受器细胞损害,造成神经元组织变性或缺失,导致PROS变薄。
此外,进行RNFL厚度监测发现,PDR、DME患者视网膜黄斑中心凹、旁中心凹鼻上及颞上RNFL厚度均较对照组与NDR组降低,表明DR患者视网膜神经纤维亦存在不同程度的损害,与Yohannan等[15]研究结论一致,而DME患者RNFL又低于PDR患者,分析原因可能为随DM病程的进展,患者ME程度上升,视网膜神经细胞轴突日趋变性且数量逐渐减少,引起RNFL变薄。另外,进行相关性分析发现,DR患者早期PROS、TLP、RNFL的变化均与患者最佳矫正视力呈正相关,表明视网膜病变患者PROS及TLP与RNFL的变化均与患者视力损伤存在密切联系。而密切监测DM视网膜损伤患者PROS、TLP、RNFL的变化则可为其诊断、治疗及预后的改善提供依据。
综上所述,不同类型视网膜病变患者视网膜外层厚度存在一定的差异,PDR、DME患者PROS、RNFL、RLP均较正常健康人与非DR患者变薄或缩短,且PROS、RNFL、RLP变化与患者视力变化存在紧密关联,其PROS、TLP、RNFL越高,患者视力越好。
