低氧诱导因子-1α(HIF-1α)在年龄相关性白内障晶状体上皮细胞中的表达△
2019-06-12孙蕾关丽娜胡姗姗于建渤
孙蕾 关丽娜 胡姗姗 于建渤
年龄相关性白内障(age-related cataract,ARC)是一种以晶状体混浊为主要特征的眼部疾病,糖尿病、高血压、紫外线和吸烟等是ARC发生和发展的致病因素,而这些因素均可导致机体处于氧化应激状态[1-7]。氧化应激状态下产生的过氧化物积累进一步导致晶状体上皮细胞(lens epithelial cells,LECs)的损伤,出现晶状体混浊。因此,氧化应激被认为是ARC的主要发病机制[8-9]。低氧诱导因子-1α(hypoxia
inducible factor-1α,HIF-1α)是低氧应激反应的关键转录调节因子,氧化应激会导致HIF-1α的表达发生变化,HIF-1α在心肌、肝、肺等组织的氧化应激反应中通过不同的机制发挥作用[10-12]。解剖结构上,晶状体属于无血管组织,人LECs的天然生存环境处于缺氧状态,而缺氧会导致HIF-1α的合成增加[13]。目前,尚未有HIF-1α与ARC相关的报道。本研究基于实验前期已建立的氧化应激诱导SRA01/04凋亡的细胞模型,以及通过建立自然衰老的ARC小鼠模型,并结合临床收集ARC患者前囊膜标本为基础,检测HIF-1α在ARC中的表达情况,以及通过本研究为ARC的治疗提供理论基础。
1 材料与方法
1.1 材料
1.1.1 试剂与仪器 体积分数10%胎牛血清、100×103U·L-1青霉素和100 g·L-1链霉素(美国Gibco公司),DMEM培养液、磷酸盐(PBS)缓冲液(美国HyClone公司),6孔培养板(美国CoStar公司),细胞冻存瓶、离心管(美国Corning公司),鼠抗人β-actin单克隆抗体(美国Sigma公司),兔抗人HIF-1α多克隆抗体(美国Abcam公司),山羊抗小鼠IgG(G+L)二抗、山羊抗兔IgG(G+L)二抗、兔二步法试剂盒、DAB显色试剂盒、柠檬酸盐修复液、PBS缓冲液粉末、阳离子防脱玻片、中性树胶(北京中杉生物技术有限公司),发光试剂盒(美国Millipore公司)。电热恒温干燥箱(上海精宏实验设备有限公色),漂片仪(常州市郝思琳医用仪器有限公司),轮转切片机、细胞培养箱(美国Thermo Fisher公司),离心机(美国Sigma公司)。
1.1.2 实验动物及分组 选用30只Bal/bc小鼠,给予标准实验室饲养至18个月龄,作为自然衰老小鼠模型纳入实验中,小鼠脱臼处死后显微镜下摘除眼球,完整分离晶状体,筛选出混浊、透明度降低的晶状体为白内障组;另选用30只Bal/bc小鼠,给予标准实验室饲养至8个月龄,为青年小鼠模型纳入实验中,小鼠脱臼处死后显微镜下摘除眼球,完整分离晶状体为正常对照组。所取标本于40 g·L-1多聚甲醛中固定(北京维通利华实验动物技术有限公司提供)。
1.1.3 病例收集与分组 白内障组为2018年1月至10月在牡丹江医学院附属红旗医院诊断为ARC,并接受白内障手术的住院患者,于术中行连续环形撕囊,收集含有人LECs的晶状体前囊膜标本10例,年龄60~80岁,排除其他类型白内障以及眼部其他疾病,同时否认有全身性疾病,如糖尿病、高血压、心血管疾病等。正常对照组为同期我院眼外伤晶状体脱出患者及角膜移植捐献的新鲜眼球,收集含有人LECs的透明晶状体前囊膜标本7例,排除白内障、青光眼、虹膜炎等眼部疾病。所有标本取材后均于40 g·L-1多聚甲醛中固定。
1.2 方法
1.2.1 细胞培养 人LECs系(SRA01/04)购于中国广州吉尼欧生物科技有限公司。培养于含体积分数为10%胎牛血清、100 × 103U·L-1青霉素和 100 g·L-1链霉素的DMEM培养液中,置37 ℃、含体积分数5%CO2的恒温培养箱中。
1.2.2 H2O2处理细胞 将SRA01/04细胞以每孔100×103个置6孔培养板中培养24 h。设置H2O2组和对照组,H2O2组药物浓度为200 μmol·L-1H2O2,对照组不作处理,药物作用24 h后进行后续实验。
1.2.3 Western blot检测 加入蛋白裂解液提取总蛋白,蛋白上样后电泳分离蛋白,冰转法将蛋白转移至PVDF膜,用50 g·L-1牛血清白蛋白室温下封闭1 h,加入HIF-1α抗体于4 ℃封闭过夜。加入山羊抗兔(二抗)于37 ℃孵育1 h,ECL发光反应后,暗室曝光显影。以β-actin为内参,用Image J 软件对HIF-1α蛋白质含量进行半定量分析。
1.2.4 免疫组织化学检测 将获取的人前囊膜标本和小鼠晶状体标本常规石蜡包埋,组织切片,厚度4 μm。60 ℃ 烤片2 h,常规脱蜡水化后,用pH 6.0柠檬酸盐缓冲液高温高压修复30 min,室温冷却后,H2O2室温孵育10 min,滴加胎牛血清封闭液30 min,滴加HIF-1α抗体后4 ℃过夜。滴加二抗(兔二步法试剂盒)于37 ℃孵育30 min,DAB显色后,梯度酒精脱水,甲苯透明,中性树胶封片。
1.3 统计学方法 采用GraphPad Prism7进行统计学分析。数据以均数±标准差表示,多样本均数比较采用单因素方差分析(one-way ANOVA),两样本之间比较采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 HIF-1α蛋白在氧化应激的SRA01/04细胞中的表达 Western blot检测对照组和H2O2组中HIF-1α蛋白表达情况,结果表明,与对照组比较,H2O2组HIF-1α蛋白表达明显降低,差异有统计学意义(P<0.01,图1)。
2.2 HIF-1α蛋白在自然衰老的白内障小鼠LECs中的表达 免疫组织化学检测小鼠正常对照组和白内障组中HIF-1α蛋白表达情况,结果表明,与正常对照组比较,白内障组小鼠LECs中HIF-1α蛋白表达明显降低(图2)。
2.3 HIF-1α蛋白在ARC患者LECs中的表达 免疫组织化学检测人类正常对照组和白内障组中HIF-1α蛋白表达情况,结果表明,与正常对照组比较,白内障组HIF-1α蛋白表达明显降低(图3)。
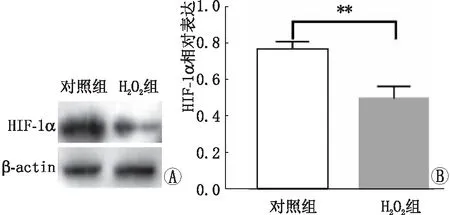
图1 Western blot检测对照组和H2O2组SRA01/04细胞中HIF-1α蛋白的表达。A:对照组和H2O2组HIF-1α蛋白表达水平;B:HIF-1α蛋白灰度值比较。与对照组比较,**P<0.01
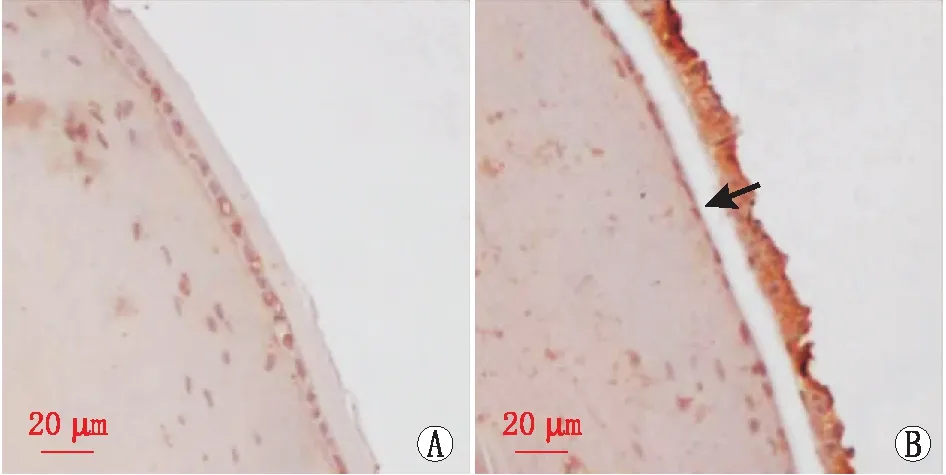
图2 免疫组织化学检测小鼠正常对照组和白内障组LECs中HIF-1α蛋白的表达。A:正常对照组;B:白内障组。箭头指代表性区域

图3 免疫组织化学检测人正常对照组和白内障组LECs中HIF-1α蛋白的表达。A:正常对照组;B:白内障组。箭头指代表性区域
3 讨论
本研究通过建立氧化应激诱导SRA01/04细胞系凋亡的细胞模型,模拟ARC中LECs的氧化应激状态,通过Western blot检测HIF-1α蛋白在LECs的表达变化;另外,通过建立自然衰老的白内障小鼠模型,模拟ARC形成的自然病程,通过免疫组织化学检测HIF-1α蛋白在小鼠LECs中的表达变化;同时,结合临床收集ARC患者的前囊膜标本,利用免疫组织化学的方式更准确直观地检测HIF-1α蛋白在ARC中LECs的表达,通过这三个层面的实验结果均显示,ARC LECs中HIF-1α蛋白的表达降低。
HIF-1是低氧应答的首要转录因子,由Semenza等[14]首次发现。HIF-1由HIF-1α和HIF-1β两个亚单位组成;HIF-1β亚基在细胞内稳定表达,起结构性作用;HIF-1α亚基受低氧信号的调控,是HIF-1的活性亚基[15]。组织内的低氧条件能够阻断HIF-1α的泛素化,从而阻断 HIF-1α的降解途径,HIF-1α在低氧条件下积累并与HIF-1β结合形成异源二聚体转运至细胞核内,与基因组中的低氧反应元件结合,调控下游靶基因的转录与表达[14]。有研究显示,HIF-1在低氧条件下能促进糖酵解酶、葡萄糖转运蛋白、促红细胞生成素和血管内皮生长因子-A(VEGF-A)的表达,这些基因支持细胞在低氧条件下的存活[16]。
HIF-1α作为机体应对缺氧的重要调节因子,在不同组织的氧化应激反应中产生不同的作用机制。有研究显示,HIF-1α可通过抑制氧化应激并保护心脏,使其免于脓毒性心肌病导致的功能障碍[17];也有研究显示,在高氧和H2O2刺激条件下,肠上皮细胞损伤加重,同时HIF-1α表达升高[18]。在非酒精性脂肪性肝病中,氧化应激参与病变进展,而HIF-1α呈现下降趋势[11]。严重的缺氧或较长时间暴露于轻度缺氧的环境中可引起内皮细胞的强氧化应激反应,并通过HIF-1α的大量积累导致细胞凋亡[19]。
Chang等[20]研究中,常氧高糖条件下,碳水化合物反应元件结合蛋白(ChREBP)介导HIF-1α活化,可能在年龄相关性视网膜病变中参与新生血管的形成。另外,在后囊膜混浊中,LECs的上皮-间质转化是其病理基础,而HIF-1α可通过Notch1/Snail1/E-钙黏蛋白途径和调节转化生长因子-β2来促进上皮-间质转化[21-22]。Chen等[23]在蛋白水平检测了ARC患者前囊膜中HIF-1α的表达情况,发现其在ARC患者的LECs中表达降低,而且ARC晶状体混浊的程度越重,HIF-1α的表达也就越低。这与本研究结果吻合,但具体调控HIF-1α低表达的分子机制尚不清楚。
调控HIF-1α的基因众多。在常氧条件下,HIF-1α可受到脯氨酰羟化酶(prolyl hydroxylase,PHD)蛋白的调节,PHD可羟化HIF-1α并将其靶向蛋白酶体降解;在低氧条件下,线粒体内ROS反常增加,ROS可抑制PHD活性,从而增加了HIF-1α的活性和稳定性[18]。有研究发现,通过H2O2处理细胞诱发抗氧化反应的同时,也诱发抗氧化应激反应,此时作为抗氧化物的谷胱甘肽活性增加,其能抑制HIF-1α的表达;实验还发现,黄体酮能够完全消除抗氧化反应,而黄体酮能够增加HIF-1α的表达[24]。Miranda-Cruz等[15]发现,沉默HIF-1α后能抵抗白斑综合征病毒感染相关的氧化损伤,即HIF-1α的沉默改善了抗氧化反应,表现为氧化损伤的减少。Xiao等[25]研究发现,HIF-1α参与抑制细胞凋亡和抑制晶状体混浊,进一步延缓糖尿病性白内障的发展。因此,我们推测ARC中LECs在氧化应激条件下,能够通过降低HIF-1α蛋白表达进行抗氧化反应,但具体机制还需进一步研究证实。
抗氧化剂可以减少氧化损伤,降低白内障形成的风险。Hayashi等[26]发现,摄入含叶黄素的抗氧化剂后晶状体前囊膜中LECs的抗氧化酶mRNA表达增加,同时房水中超氧化物的清除活性增加。槲皮素可通过激活人LECs中的HIF-1信号转导途径,从而抑制白内障中的晶状体混浊,而过量的铁可以逆转槲皮素诱导的HIF-1α的增加和核转位[27]。Harned等[28]也发现,铁可以介导氧化损伤,铁可用性的增加能降低LECs中HIF-1α的核转位,而铁蛋白对铁的储存以及防止铁催化的氧化损伤就显得尤为重要。Shui等[29]通过向老年小鼠注射铁螯合剂,使小鼠内可用性铁降低后可减少LECs中HIF-1α的降解。那么,可用性铁与铁蛋白的动态平衡是否也对ARC中HIF-1α产生影响还有待研究。
综上所述,HIF-1α在ARC的细胞水平和组织水平表达均显著下降,HIF-1α可能通过特定的机制或通路导致ARC的发生发展,但其确切的发病机制仍需进一步实验进行研究。本研究为今后实验提供了明确的方向,为延缓ARC的发生发展提供了理论依据。
