不同来源酒曲酿制米酒中乳酸菌的分离与鉴定
2019-06-11向凡舒魏冰倩钟小丹张振东赵慧君
向凡舒,邓 风,魏冰倩,钟小丹,张振东,郭 壮,赵慧君*
(1.湖北文理学院 食品科学技术学院 鄂西北传统发酵食品研究所,湖北 襄阳 441053;2.湖北米婆婆生物科技股份有限公司,湖北 孝感 432003)
米酒,又称甜酒、酒酿、醪糟等,是一种澄清并具有甜味、略带酸味的发酵类含酒精饮料,通常以糯米类作物为原料,以米酒曲为发酵剂室温发酵2~3 d制得。米酒作为一种混合菌发酵产品,其质量和风味的好坏取决于米酒曲中微生物的群落组成及各菌种之间的代谢关系、代谢产物与产品的比例关系等。米酒曲是在特定的生态环境中,用成曲作为母种培养制作而成,含有包括细菌和真菌在内的大量微生物,对米酒品质的形成起着决定性作用,因而有“曲是酒之骨”之称[1-3]。相对于工业化生产的米酒曲,民间传统酿造米酒曲中微生物多样性更高,酿造的米酒风味也更为独特,同时也加剧了不同地区间米酒风味的差异。
目前,关于孝感米酒中微生物的研究多集中在霉菌和酵母菌,王小红等[4-5]采用传统纯培养法对孝感米酒或米酒曲中根霉和酵母菌进行了分离。目前,研究和应用的乳酸菌多从传统发酵乳制品、泡菜或者人体肠道中分离得到,而以米酒曲为分离源的乳酸菌报道尚少。乳酸菌在米酒发酵过程中起到了关键的作用,其产生的乳酸、乙醛和双乙酰等风味物质对米酒的感官品质具有显著地影响。米酒中乳酸菌多样性的研究已有很多,主要是基于宏基因组学方法和传统纯培养方法。JIAO J K等[6-9]利用(polymerase chain reaction-denaturing gradient gel electrophoresis,PCR-DGGE)技术分别对中国6个不同地区米酒、韩国烧酒发酵过程、韩国米酒以及中国7个不同地区米酒曲中乳酸菌的多样性进行了研究。除韩国烧酒在发酵过程中乳酸菌不是优势菌株外,其余均检测到多种乳酸菌;沈馨等[10]采用MiSeq高通量测序分析孝感凤窝酒曲细菌多样性发现,12个核心优势操作分类单元(operational taxonomic unit,OTU)中,2个隶属于乳酸菌;苗乘源等[11-14]采用纯培养方法对传统酿造米酒中的优势微生物及乳酸菌进行研究发现,不同来源米酒中的乳酸菌种类也不相同,具有地方差异性;沈馨等[15-16]从米酒中分离乳酸菌并研究其对米酒和黄酒品质的影响,探索米酒中乳酸菌在工业应用中的潜力。
本研究分别以湖北孝感和四川成都来源的米酒曲为发酵剂发酵制作米酒,并采用改良MRS培养基、分子生物学技术对米酒中的乳酸菌进行了分离、鉴定,深入研究传统制作米酒中乳酸菌的多样性,对其微生物多样性信息进行全面系统的解析具有极为重要的意义。
1 材料与方法
1.1 材料与试剂
1.1.1 米酒曲
酒曲:从湖北孝感地区和四川成都地区各采集10种,分别编号为XG1-XG10和CD1-CD10,其中孝感地区采集的米酒曲均为凤窝酒曲,成都导区采集的米酒曲为农家自制。
1.1.2 试剂
苯酚、氯仿、异戊醇、异丙醇、Tris、乙二胺四乙酸二钠、十二烷基硫酸钠、冰乙酸、碳酸钙、氯化钠、琼脂粉等(均为分析纯):国药集团化学试剂有限公司;r Taq脱氧核糖核酸(deoxyribonucleicacid,DNA)聚合酶(5U/μL)、脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP)、pMD18-T、DNAMarker:大连宝日医生物技术有限公司;蛋白胨、酵母粉、琼脂糖(均为生化试剂)、溶菌酶(酶活≥20000U/mg)、蛋白酶K(40 U/mg)、2×PCR mix、大肠杆菌(Escherichia coli)Top 10感受态细胞、氨苄青霉素:索来宝生物技术有限公司;AXGEN PCR清洁试剂盒:北京科博汇智生物科技发展有限公司;引物:武汉天一辉远生物科技有限公司。
1.1.3 培养基
MRS固(液)体培养基:北京陆桥技术股份有限公司。
改良MRS固体培养基[17]:在MRS固体培养基中添加1.5%的CaCO3。
LB液体培养基[18]:蛋白胨10 g/L,酵母粉5 g/L,氯化钠10 g/L。添加琼脂粉15 g/L为LB固体培养基。
上述培养基均在121℃条件下灭菌20 min。
1.2 仪器与设备
DG250厌氧工作站:英国Don Whitley Scientific公司;CT15RE冷冻离心机:日本HITACHI公司;SW-CJ-2D双人单面净化工作台:苏州安泰空气技术有限公司;PTC-100PCR仪:美国ABI公司;DYY-BC型电泳仪:北京六一仪器厂;Fluor Chem FC3:美国ProteinSimple公司。
1.3 试验方法
1.3.1 米酒的制作工艺流程及操作要点
4.检验方法。同一检验项目中一般存在着不同种类的检验方法,方法选取不当也会造成食品检验结果出现偏差,从而影响检验结果的准确性。
按照参考文献[19]制作米酒。操作要点:糯米浸泡、蒸煮和摊凉后,按照每千克糯米添加3 g米酒曲的比例进行落罐搭窝,并在28℃发酵48 h备用。
1.3.2 乳酸菌的分离与纯化
无菌条件下,取1mL米酒,加入9mL生理盐水中,然后以10倍稀释法进行梯度稀释后,吸取0.2mL稀释度为10-5和10-6的稀释液涂布于MRS固体培养基,每个梯度重复3次,置于30℃厌氧工作站中倒置培养48h。待乳酸菌长出后,在改良MRS固体培养基上划线分离纯化2~3次,挑取产生透明圈的单菌落于MRS液体培养基中,30℃振荡培养24h。革兰氏染色后进行镜检,同时进行过氧化氢酶试验。将纯种、革兰氏阳性、过氧化氢酶阴性的菌株保存于-80℃超低温冰箱中保藏。
1.3.3 乳酸菌的分子生物学鉴定
参照文献[20]提取乳酸菌的基因组DNA,以其为模板,采用通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1495R(5′-CTACGGCTACCTTGTTACGA-3′)PCR扩增乳酸菌的16SrDNA基因。PCR扩增体系:10×r Taq buffer(Mg2+plus)2.5 μL,27F(10 mmol/L)0.5 μL,1495R(10 mmol/L)0.5 μL,dNTP mix(2.5 mmol/L)2 μL,r Taq DNA polymerase(5U/μL)0.5μL,DNA模板2μL,无菌水补足25μL。PCR扩增条件:94℃预变性5min;94℃变性1min,55℃退火1min,72℃延伸2 min,30个循环;72℃再延伸10 min。PCR扩增产物经1%琼脂糖凝胶电泳检测。
PCR扩增产物经AXGEN PCR清洁试剂盒清洁后,与pMD18-T载体连接,并转化至E.coli TOP10感受态细胞中,挑取单克隆子进行菌液PCR扩增,验证阳性克隆。引物为M13F(-47)(5′-CGCCAGGGTTTTCCCAGTCACGAC-3′)和M13R(-48)(5′-GAGCGGATAACAATTTCACACAGG-3′)。PCR扩增体系:2×PCR mix 12.5 μL,M13F(-47)(10 mmol/L)0.5 μL,M13R(-48)(10 mmol/L)0.5 μL,菌液2 μL,无菌水补足25 μL。PCR扩增条件同16S rDNA扩增条件。PCR扩增产物经1%琼脂糖凝胶电泳进行检测,阳性克隆送往武汉天一辉远生物科技有限公司进行测序。测序结果在美国国立生物技术信息中心(national center for biotechnology information,NCBI)上进行BLAST同源性比对,选取同源性较高的模式菌株,采用MEGA 4.0软件中的邻接(neighbor joining,NJ)法构建系统发育树[21-22],自展数据集为1 000次。
2 结果与分析
2.1 孝感和成都米酒曲制作的米酒中乳酸菌的分离结果
采用传统培养进行乳酸菌的分离,选取改良MRS固体培养基上有透明圈、过氧化氢酶阴性和革兰氏阳性的菌株进行统计。从10个孝感米酒曲制作的米酒中共分离到42株疑似乳酸菌,菌株编号为XG1-1~XG1-4、XG2-1~XG2-3、XG3-1~XG3-3、XG4-1~XG4-5、XG5-1~XG5-4、XG6-1~XG6-3、XG7-1~XG7-4、XG8-1~XG8-3、XG9-1~XG9-6、XG10-1~XG10-7。从10个成都米酒曲制作的米酒中共分离到的35株疑似乳酸菌,菌株编号为CD1-1~CD1-5、CD2-1~CD2-4、CD3-1~CD3-4、CD4-1~CD4-5、CD5-1~CD5-4、CD6-1~CD6-3、CD7-1~CD7-3、CD8-1~CD8-3、CD9-1~CD9-3、CD10-1。
2.2 孝感米酒曲制作的米酒中乳酸菌的分子生物学鉴定结果
42株乳酸菌的16S rDNA测序结果在NCBI上进行BLAST同源性比对,并申请了登录号,结果见表1。
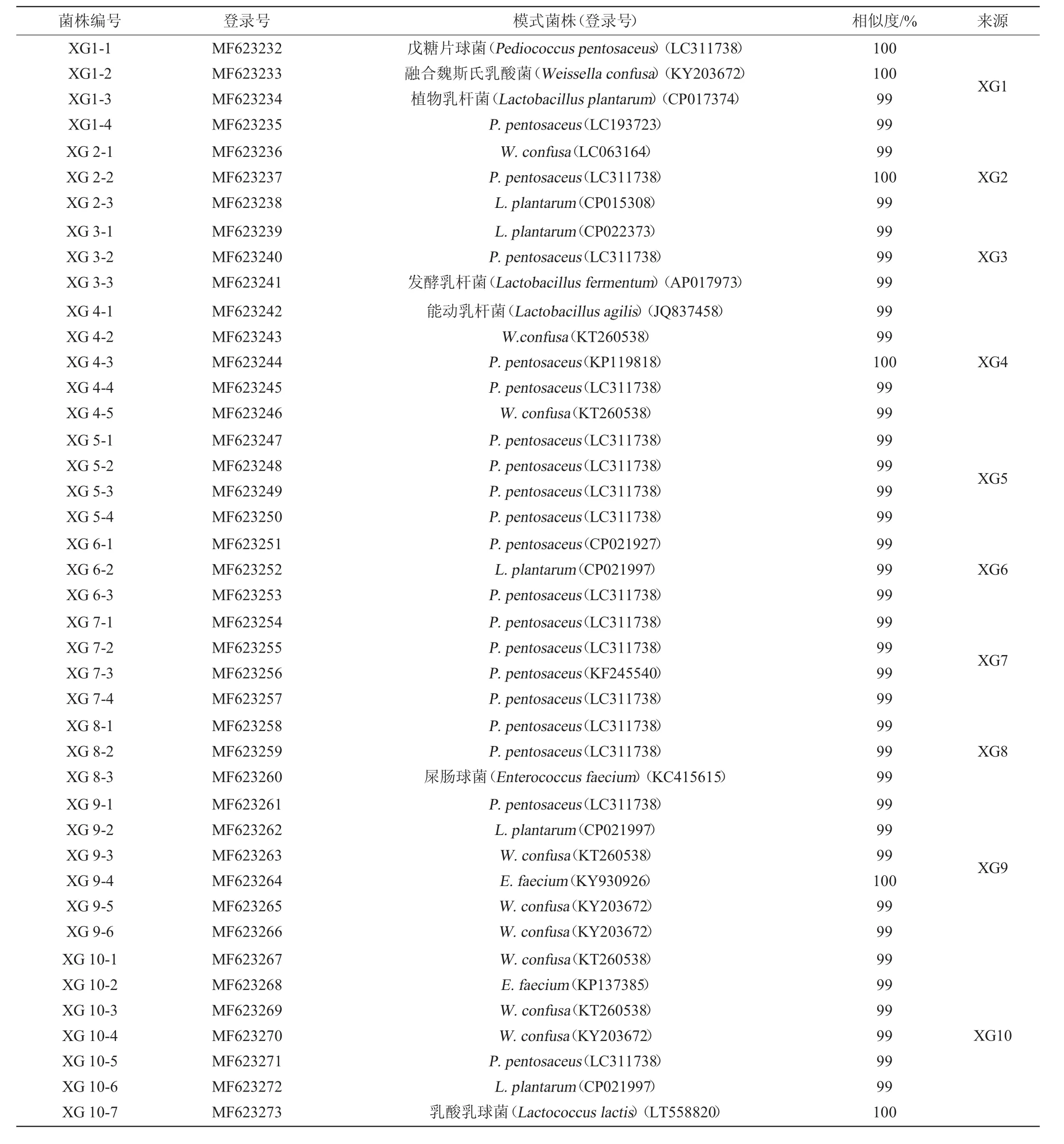
表1 孝感米酒中乳酸菌16S rDNA基因序列的比对结果及登录号Table 1 Alignment results of 16S rDNA sequences and accession number of lactic acid bacteria from Xiaogan rice wine
基于16S rDNA基因序列,采用MEGA 4.0软件中的NJ法构建系统发育树,结果见图1。
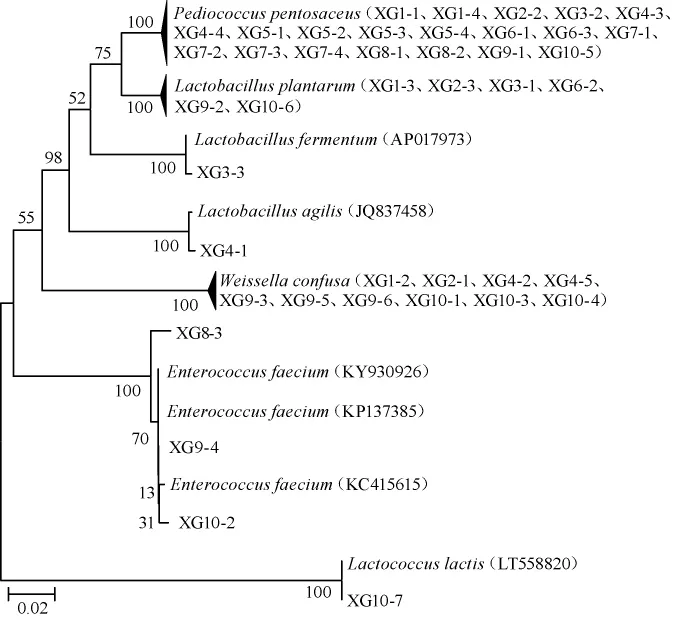
图1 基于16S rDNA基因序列构建孝感米酒中乳酸菌系统发育树Fig.1 Phylogenetic tree of lactic acid bacteria from Xiaogan rice wine based on 16S rDNA gene sequences
由图1可知,菌株XG1-1、XG1-4、XG2-2、XG3-2、XG4-3、XG4-4、XG5-1、XG5-2、XG5-3、XG5-4、XG6-1、XG6-3、XG7-1、XG7-2、XG7-3、XG7-4、XG8-1、XG8-2、XG9-1、XG10-5与P.pentosaceus聚于一支,相似度较高;菌株XG1-2、XG2-1、XG4-2、XG4-5、XG9-3、XG9-5、XG9-6、XG10-1、XG10-3、XG10-4与W.confusa聚于一支,相似度较高;菌株XG1-3、XG2-3、XG3-1、XG6-2、XG9-2、XG10-6与L.plantarum聚于一支,相似度较高;菌株XG8-3、XG9-4、XG10-2与E.faecium聚于一支,相似度较高;菌株XG3-3与L.fermentum聚于一支,相似度较高;菌株XG4-1与L.agilis聚于一支,相似度较高;菌株XG10-7与L.lactis聚于一支,相似度较高;因此,42株乳酸菌分别被鉴定为P.pentosaceus(20株)、W.confusa(10株)、L.plantarum(6株)、E.faecium(3株)、L.fermentum(1株)、L.agilis(1株)、L.lactis(1株)。
2.3 成都米酒曲制作的米酒中乳酸菌的分子生物学鉴定结果
35株乳酸菌的16S rDNA测序结果在NCBI上进行BLAST同源性比对,并申请了登录号,结果见表2。
基于16S rDNA基因序列,采用MEGA 4.0软件中的NJ法构建系统发育树,结果见图2。
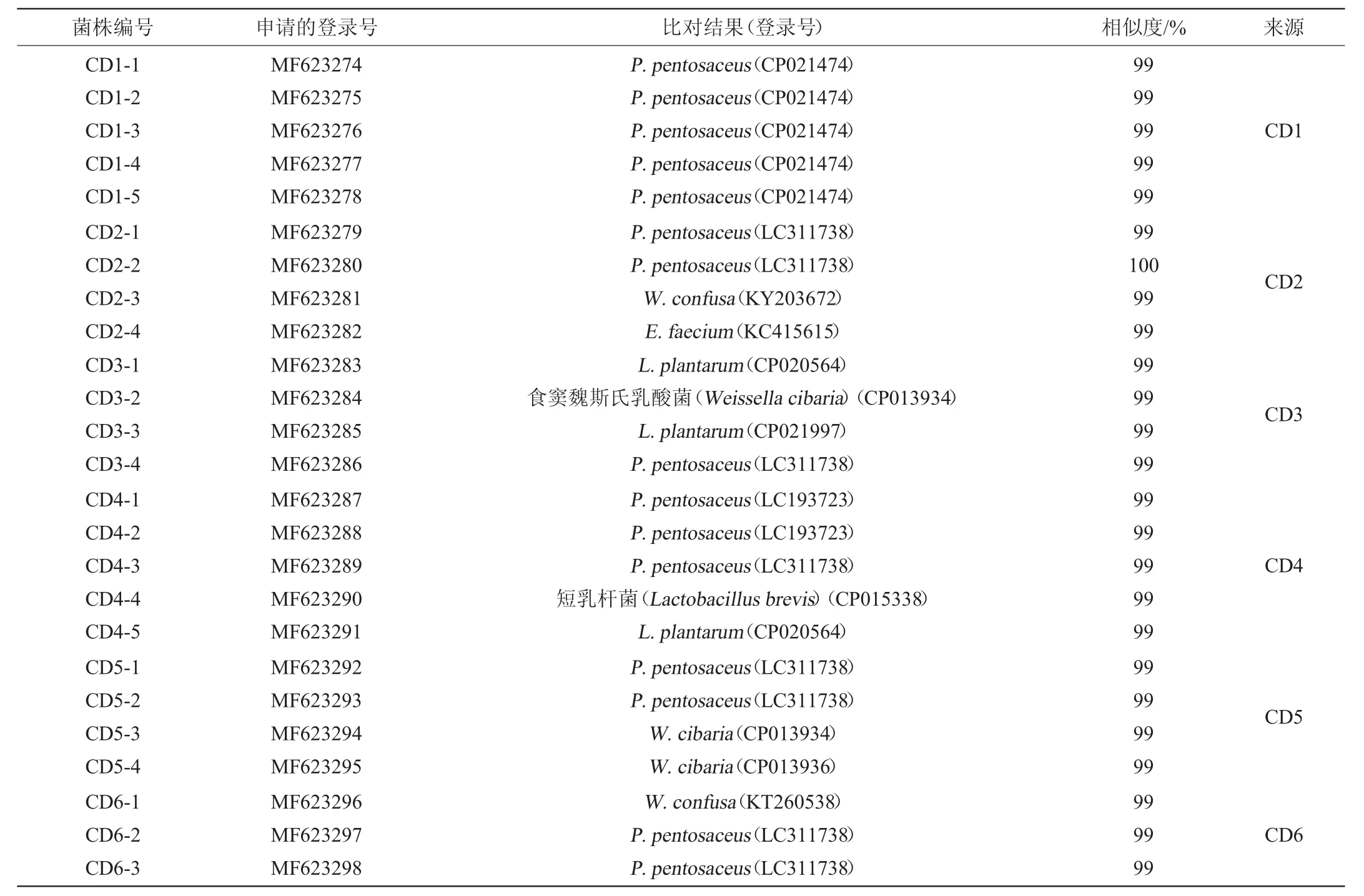
表2 成都米酒中乳酸菌16S rDNA基因序列的比对结果及登录号Table 2 Alignment results of 16S rDNA sequences and accession number of lactic acid bacteria from Chengdu rice wine

续表
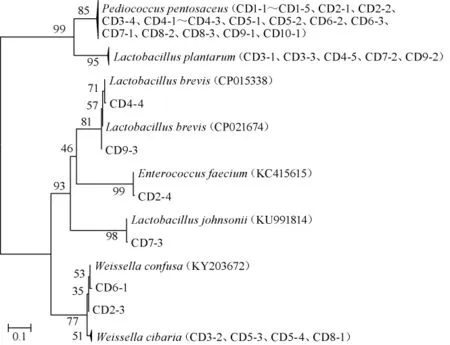
图2 基于16S rDNA基因序列构建成都米酒中乳酸菌系统发育树Fig.2 Phylogenetic tree of lactic acid bacteria from Chengdu rice wine based on 16S rDNA gene sequences
由图2可知,菌株CD1-1~CD1-5、CD2-1、CD2-2、CD3-4、CD4-1~CD4-3、CD5-1、CD5-2、CD6-2、CD6-3、CD7-1、CD8-2、CD8-3、CD9-1、CD10-1与P.pentosaceus聚于一支,相似度较高;菌株CD3-1、CD3-3、CD4-5、CD7-2、CD9-2与L.plantarum聚于一支,相似度较高;菌株CD3-2、CD5-3、CD5-4、CD8-1与W.cibaria聚于一支,相似度较高;菌株CD2-3、CD6-1与W.confusa聚于一支,相似度较高;菌株CD4-4、CD9-3与L.brevis聚于一支,相似度较高;菌株CD2-4与E.faecium聚于一支,相似度较高;菌株CD7-3与L.johnsonii聚于一支,相似度较高;因此,42株乳酸菌分别被鉴定为P.pentosaceus(20株)、L.plantarum(5株)、W.cibaria(4株)、W.confusa(2株)、L.brevis(2株)、E.faecium(1株)、L.johnsonii(1株)。
2.4 孝感和成都米酒曲制作的米酒中乳酸菌的比较
孝感和成都米酒曲制作的米酒中乳酸菌的比较结果见表3。
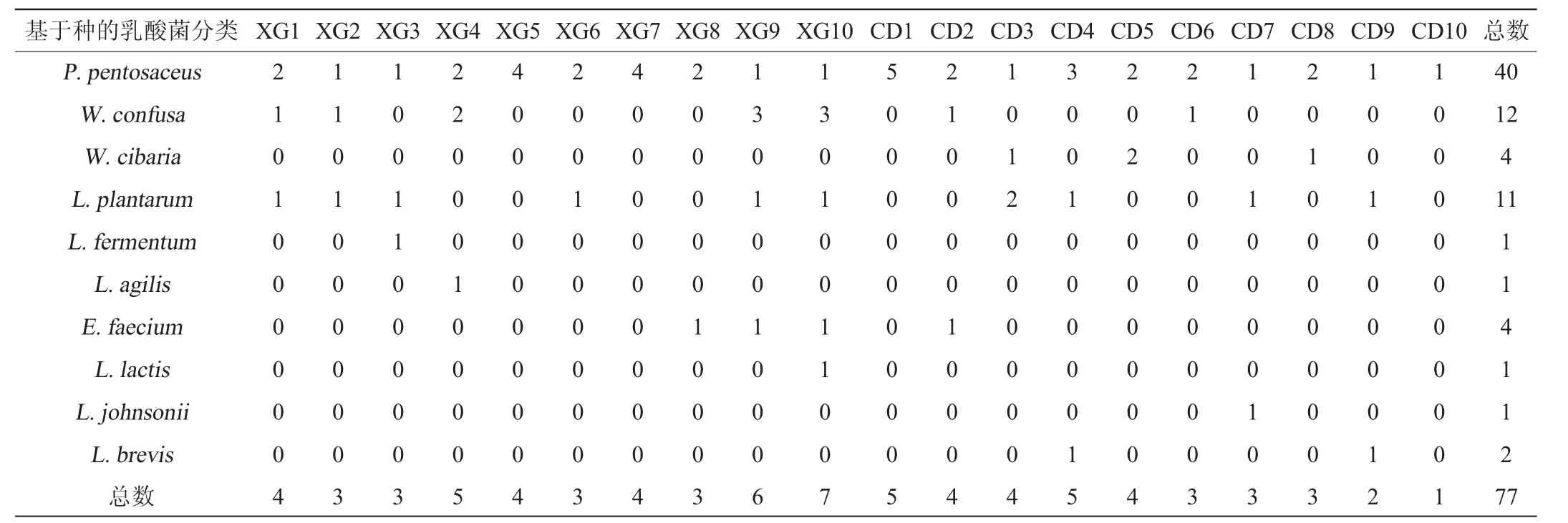
表3 孝感和成都米酒曲制作的米酒中乳酸菌的比较Table 3 Comparison of lactic acid bacteria between Xiaogan rice wine and Chengdu rice wine
由表3可知,在两种米酒中,分离的P.pentosaceus数量均最多,均为20株,分别占总分离乳酸菌数的47.6%、57.1%,说明P.pentosaceus为两种米酒的优势菌株。除P.pentosaceus外,两种米酒中分离出的相同种属的菌株还包括W.confusa、L.plantarum和E.faecium,其中,W.confusa在孝感米酒中分离出10株,在成都米酒中仅分离出2株;L.plantarum在孝感和成都米酒中分别分离出6株和5株,E.faecium在两种米酒中分离出的数量均较少。L.fermentum、L.agilis和L.lactis为孝感米酒中特有的乳酸菌,但数量均较少,均只分离到1株。W.cibaria、L.johnsonii和L.brevis为成都米酒中特有的乳酸菌,其中W.cibaria有4株,而L.johnsonii和L.brevis数量较少,分别分离到1、2株。结果表明,孝感米酒曲和成都米酒曲中的优势乳酸菌相同。
JIAO J K等[6]利用PCR-DGGE方法研究黑龙江、南京6个不同样本中的乳酸菌发现,L.plantarum、L.namurensis和P.acidilactici为优势菌株,与本研究分离的优势乳酸菌株为P.pentosaceus具有差异。张振东等[9,15-16,22]均采用纯培养方法从孝感米酒中分离乳酸菌,与本研究相比,虽然优势乳酸菌均有所不同,但是菌株的种属上是一致的,且本研究中分离得到的乳酸菌种类最全。
JIAO J K等[6]将分离到的乳酸菌用于米酒的发酵发现,参与发酵的乳酸菌的种类越多,米酒的感官特性就越好。王丹丹等[22]将分离自孝感米酒的乳酸菌用于米酒的制作发现,分离到的乳酸菌对米酒有机酸种类与含量、固形物含量与米酒的滋味产生了显著影响(P<0.05),且同一类乳酸菌对米酒滋味具有类似的影响。可见乳酸菌在米酒发酵过程中起到了关键的作用,其对米酒的感官品质具有显著地影响。本研究中分离到的各类菌株对米酒滋味的影响是下一步研究的重点。
3 结论
采用孝感凤窝米酒曲和成都农家自制米酒曲制作米酒,利用含有1.5%CaCO3的改良MRS培养基从两种米酒中共分离得到77株乳酸菌,其中,从孝感米酒中分离出42株乳酸菌,经分子生物学鉴定,隶属于7个种,分别为P.pentosaceus(20株)、W.confusa(10株)、L.plantarum(6株)、E.faecium(3株)、L.fermentum(1株)、L.agilis(1株)、L.lactis(1株)。从成都米酒中共分离出35株乳酸菌,经分子生物学鉴定,隶属于7个种,分别为P.pentosaceu s(20株)、L.plantarum(5株)、W.cibaria(4株)、W.confusa(2株)、L.brevis(2株)、E.faecium(1株)、L.johnsonii(1株)。两种米酒中分离的P.pentosaceus数量最多,分别占47.6%、57.1%,为优势菌株。除P.pentosaceus外,两种米酒中分离出的相同种还包括W.confusa、L.plantarum和E.faecium;L.fermentum、L.agilis和L.lactis为孝感米酒中特有的乳酸菌,W.cibaria、L.johnsonii和L.brevis为成都米酒中特有的乳酸菌。
