黄精多糖提取工艺、结构及药理活性研究进展
2019-06-11施吉祥徐希明余江南
施吉祥,徐希明,余江南
(江苏大学 药学院, 药物/基因转运与组织工程研究中心,江苏 镇江 212013)
黄精为百合科黄精属草本植物,始载于《名医别录》,是我国传统药材和食材。黄精种类繁多,国内现存31种,中国药典中收录了滇黄精(PolygonatikingianumColl.et Hemsl)、多花黄精(PolygonatumcyrtonemaHua.)和黄精(PolygonatumsibiricumRed.)三种;由于其形貌不同,也分别被称为“大黄精”、“姜形黄精”和“鸡头黄精”。除药典指明的三种外,其余种类的黄精药用价值全然不同。在我国,滇黄精主要生产在云南、贵州等地;黄精主要产自东北,西北以及河南、湖北等地;多花黄精则在华东地区、中南地区等地较为常见[1]。
黄精性甘,味平。能滋肾润肺,补脾益气。现代药理学研究发现,黄精具有降血糖[2]、降血脂[3]、抗衰老[4-5]、抗炎[6]、抗肿瘤、抗辐射、免疫促进等功效,在治疗糖尿病、结核病、心血管系统疾病等疾病中具有良好应用价值。黄精中主要含有:黄精多糖、甾体皂苷、蒽醌类化合物、生物碱[7]、强心苷等多种成分。其中黄精多糖的含量最高,且具有丰富的药理活性。本文对近10年来国内外对黄精多糖的提取工艺、结构及生物活性研究进行综述,以期为黄精多糖进一步的构效关系研究提供参考。
1 黄精多糖的提取工艺
植物多糖的提取一般按去杂质、破细胞壁和多糖提取三个步骤进行。黄精多糖多富集于黄精的根中,药典中也规定用根部入药,故而需要先将黄精根洗净、切片、干燥、粉碎后才能用于提取。为消除脂肪或皂苷对后续提取分离操作的影响,可先用石油醚、乙醇将脂类物质分离,处理后的药材粉末自然烘干或加热烘干散去有机溶剂后进行后续操作,脱脂的同时需要兼顾操作安全和环境保护。
植物细胞拥有一层维持细胞结构的细胞壁,其主要由果胶、纤维素和半纤维素组成,能有效保护细胞内的稳态环境。要从胞浆中释放多糖,就必须进行破壁处理,不同的破坏细胞壁方法决定了不同的提取方法。破坏植物细胞壁的方式有高温、酸碱、超声、酶解等。
1.1 热水提取法
热水提取法(Hot water extraction,HWT)又称煎煮法,是将药材加水煎煮取汁的方法,通过持续高温可使植物细胞壁软化而破裂,进而释放出多糖。
热水提取具有渗透性好、浸出率高、安全环保、操作简单的优点,是一种传统有效的提取手段。热水提取的对象需要水溶性好且具有一定的湿、热稳定性,能在一段时间内忍受高温而不发生结构的明显变化。
李丽[8]通过单因素实验确定料液比、提取时间、提取温度以及提取pH的适宜范围,用正交设计进行优化,发现料液比和提取温度是影响提取率的主要因素。在料液比为1∶20(g/mL),提取时间为2 h,提取温度为80 ℃,pH为7时,提取率最大,为8.984%。郭未艳[9]通过正交试验考察了滇黄精多糖提取率的影响因素,结果表明各因素对多糖得率的影响顺序依次为:提取温度>提取时间>提取次数>料液比,得出的最佳提取工艺是料液比1∶15(g/mL),重复3次,提取2 h,提取温度80 ℃,提取率为11.76%。陈钢[10]根据单因素影响实验,以提取温度、提取时间、料液比为因变量,多糖提取率为自变量,通过中心复合设计法进行多元回归拟合,分析得出提取温度对提取工艺有极其显著的影响,提取时间与料液比也较显著,各因素对黄精多糖得率的影响顺序为:提取温度>提取时间>料液比。最终确定料液比为1∶21.5(g/mL),提取温度为73.5 ℃,提取2.64 h时有最大提取率,为12.25%。
综上,不同文献中对提取率与提取温度、提取时间、料液比相关性的结论不统一,但提取温度都控制在70-80 ℃,提取时间也都控制在2-8 h,可能的原因是当提取温度过高或是提取时间过长时,多糖发生损失,提取率不增反降。另外,因追求较高提取率而忽略能源的高倍损耗也不利于工业化生产。因此,建议在用热水提取法提取黄精多糖时,提取温度设为70~80 ℃,加热时间控制在2~8 h,以保证一定水平的多糖提取率和结构完整性。
1.2 辅助提取法
为了能在提高提取率的同时,缩短提取时间或降低提取温度,可将水提法与其它辅助手段结合,主要原理是通过外力加快细胞壁的破坏。
1.2.1 超声辅助提取
超声辅助提取法(ultrasound-assisted extraction,UAE)通过机械化学作用使植物细胞壁结构瞬间破裂释放出有效成分,同时增加不混溶相之间的传质效率。与传统的热水提取方法相比,超声辅助提取法可以提高提取率,节省操作时间,简化操作流程[11]。徐艳[12]用超声波细胞粉碎仪对黄精中多糖进行提取获得的多糖同水煎法、稀碱浸提法相比颜色浅,杂质少,纯度高。侯双菊[13]在单因素试验的基础上以黄精多糖的提取率为响应值应用响应曲面法优化超声波强化法提取参数:超声时间、提取次数和固液比,以提高多糖的提取效率,得出最佳提取条件为超声时间2.6 min,提取次数2次,固液比为1∶23(g/mL)。在此条件下,与传统的热水提取法相比,黄精多糖的得率由11.685%提高至15.587%。
综上,使用超声辅助提取法,免去了加热过程,大大缩短了提取时间,提高了提取效率,但由于设备条件的限制,目前尚未用于大规模工业生产。
1.2.2 微波辅助提取法
微波辅助提取法(Microwave assisted extraction,MAE)提取多糖时,两种主要机制同时发挥作用。一种是通过电磁波穿透细胞壁对内外溶液进行辐射,溶剂与细胞液吸收微波后将其转化为热能,并迅速升温,使得乳化粘度降低,植物细胞外壁被破坏,有效成份从细胞内部中释放出来,被周围的溶剂所溶解。另一种是分子旋转,中和Zeta电位,从而提高提取率[14]。与传统方法相比,微波提取法具有许多优点,因为它消耗较少的时间就能获得较高的提取率,并且不会改变提取物的性质[15]。
李志涛[16]等人通过正交试验研究了微波辅助提取黄精多糖时影响提取率的因素大小顺序为:微波辐照功率>物料粒度>微波辐照时间>料液比,确定优化提取工艺条件:微波辐照功率为350 W,物料粒度为0.150 mm,微波辐照2 min,料液比为1: 30(g / mL),提取率为10.57%。胡芳[17]等人同样以正交试验考察了微波辅助提取法的工艺条件,发现最佳工艺为:黄精除杂后的粉末浸泡60 min后,按料液比1: 50(g / mL)、微波功率450 W,处理5 min,提取率为11.82%。
综上,微波辅助提取法最大的优势在于缩短了提取时间,提高了提取效率,但其所需的料液比较高,后续处理较为麻烦。
1.2.3 酶提取法
酶辅助提取(Enzyme assisted extraction,EAE)的基本原理是通过降低体系中的活化能,通过选取不同活性的酶在温和的环境中将植物壁中的纤维素和果胶水解,从而破坏细胞壁释放活性成分。用酶辅助提取法应考察酶的类型和浓度,反应时间,反应温度,pH值和植物粉碎的粒度大小[18]。该提取方法温和,不仅降低了对设备的腐蚀,而且减少了对有害溶剂的需求,缩短了提取时间。此外,在较低温度下就可实现提取,降低了能耗。常用的酶有纤维素酶、淀粉酶、木瓜蛋白酶、半纤维素酶、果胶酶等。酶辅助提取法的优势越来越受到人们的关注,用酶辅助提取植物多糖的报道也越来越多,对新酶的开发利用也有着广阔的前景。
杨德[19]等通过响应面法优化纤维素酶辅助提取黄精多糖,所得最佳提取参数为酶解温度54.8 ℃,酶解99 min,料液比1∶22.4(g/mL),纤维素酶添加量3%。在这些条件下,多糖得率为11.22%。李智慧[20]等用星点设计-效应面法优化纤维素酶提取黄精多糖,发现最佳提取工艺条件如下:纤维素酶添加量为黄精质量的0.25%(g/g),酶解120 min,酶解温度为49 ℃,酶解pH为4.6,料液比1∶7.2(g/mL),黄精多糖提取率可达(16.3±0.5)%。苑璐[21]等采用复合酶解法优化黄精多糖的提取工艺,最终确定pH为5.0,酶解温度为50 ℃,料液比为1∶20,加酶量为1.5 g/dL,酶解2 h,沸水浸提2 h时,提取率可达21.55%,为普通水提法得率的2.75倍;相比前者优化的纤维素酶辅助提取,提取率提高了5.25%。
综上,酶辅助提取法最大的优势是对料液比的需求不高,提取温度也比较温和,不需要加入额外的仪器设备;但若用于大规模生产,所需的用酶量也会随之提升,如何将灭活的酶彻底除去是需要考虑的问题。
1.2.4 其他辅助提取法
除上述几种方法外,其他被报道的黄精多糖提取方法见表1。
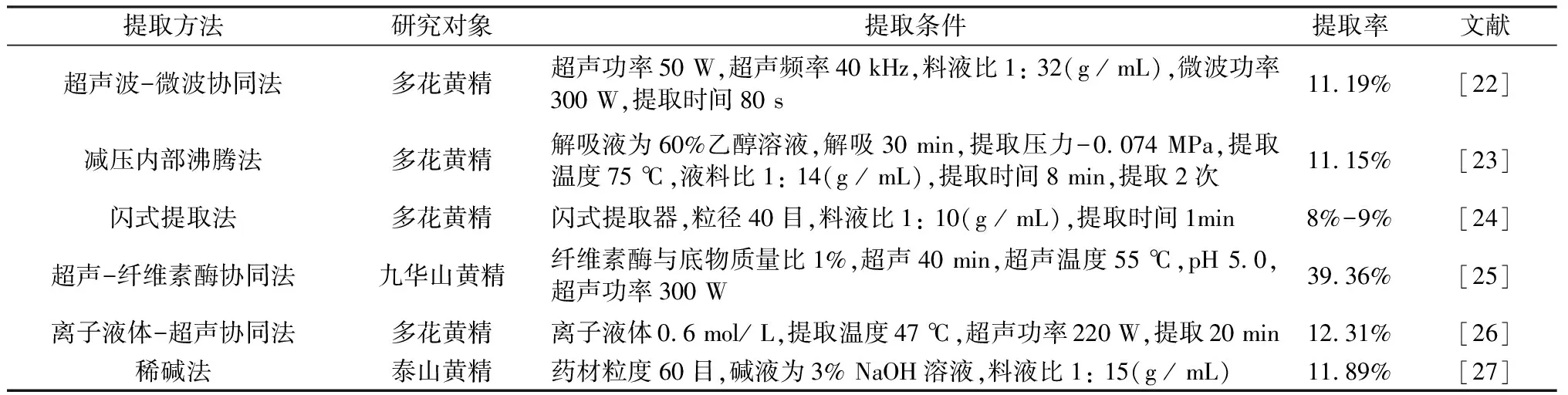
表1 黄精多糖的其他几种辅助提取法
2 黄精多糖的结构特征
多糖的结构特征可由分子量、单糖组成、单糖序列、糖苷键的构型和位置、糖链分支的类型和聚合度、空间构型等方面表征[28]。多糖结构的研究有初级结构和高级结构[29]研究两部分。其中,初级结构又称一级结构,是指将多糖置于二维平面中解析得出的构型,而多糖在空间中的立体构象则被称为高级结构。其中,研究最多的是一级结构,属于多糖一级结构的结构特征有分子量、单糖组成、糖苷键类型等。一级结构可通过化学分析方法结合现代仪器分析手段进行解析(详见表2),化学分析法包括甲基化、高碘酸氧化、Smith降解法等。一般认为,多糖的生物活性与其结构特征紧密相关[30]。对多糖初级结构和空间结构的探索能帮助人们更深入研究多糖的生物活性功能。表3为文献中关于黄精多糖结构的报道。得出的初步结论是:黄精多糖中多含β-吡喃环,分子量分布范围在2.2到360 KDa之间,黄精多糖的单糖组成中一般含有葡萄糖和半乳糖中的一种或两种。研究表明,同一黄精属的各个物种含有多种多糖成分,遗传背景、生长条件和收获季节均可能是导致这种变化的原因,而提取分离等方式的改变亦会对黄精的多糖结构产生影响。因此,为了让黄精多糖的研究更有价值,可以通过规范市场,设立黄精种植基地,建立黄精多糖的提取分离纯化标准,以减小得到的各黄精多糖结构上的差异性,使黄精多糖药理活性的发挥更加稳定,市场地位得到提高。
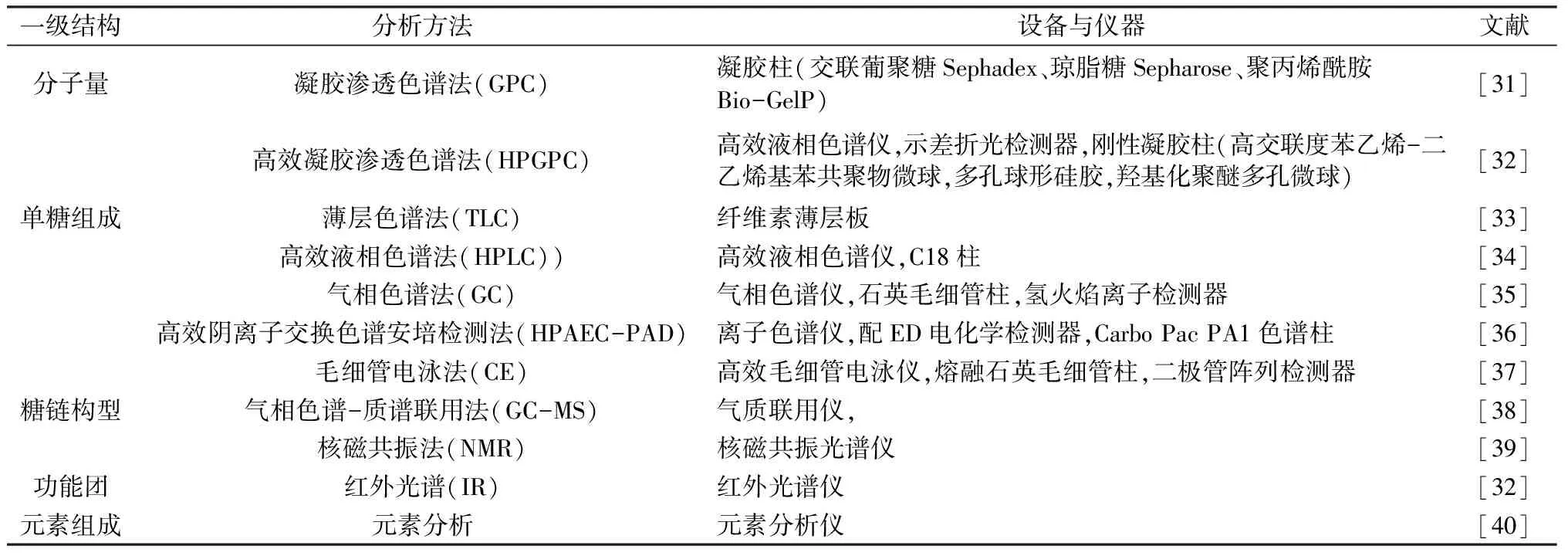
表2 多糖结构的现代分析手段

表3 文献中报道的黄精多糖的结构
注:NA:Not Available文献中没有提及。
3 黄精多糖的药理活性
黄精多糖具有多种药理活性,其相关研究详见表4。
3.1 抗氧化活性
活性氧(Reactive oxygen species, ROS)以超氧化物阴离子(·O2-),羟自由基(·OH)和过氧化氢的形式存在,由正常代谢过程或药物和外源性因素产生,是引发致癌、缺血再灌注损伤和炎症的介质[47-49],此外这些活性氧能够减缓衰老和预防阿尔茨海默病。人体能够主动防御抗氧化剂和修复氧化损伤,但无法完全防止氧化损伤,需要有抗氧化剂帮助清除活性氧和抑制活性氧的产生,加工食品中常用的合成抗氧化剂有BHA、BHT和TBHQ,然而考虑到这些合成抗氧化剂的安全性,可替代的天然抗氧化剂具有很好的开发前景。
研究发现,黄精多糖能显著提高内源性抗氧化酶SOD和GSH-Px的活性,抑制过氧化物MDA和LF的含量[50],对羟自由基和超氧化物阴离子具有直接清除作用[51]。当浓度大于0.05 mg/mL时,硫酸酯化黄精多糖对超氧阴离子自由基的清除率显著高于黄精多糖[52],说明结构的改变可能会影响黄精多糖的抗氧化活性。
3.2 降血糖活性
糖尿病是由胰岛素分泌不足或外周组织对胰岛素不敏感导致的代谢紊乱,其特征为持续性高血糖[53]。可将糖尿病分为I型糖尿病(T1DM),Ⅱ型糖尿病(T2DM),妊娠期糖尿病(GDM)和其他类型的疾病。
现如今,糖尿病风险的上升可能是由于现代生活水平的逐步提高和与之俱增的就业压力所致[54]。数据显示,亚洲地区II型糖尿病流行的比例很高[55],其中青少年患II型糖尿病的人数比例正日益增加。西药降糖速度快,是糖尿病患者的首选,但用西药降糖,病情易复发,尤其对一些慢性并发症缺乏有效的解决办法,且服用化学合成药会引发许多副作用[56],近年来,人们尝试从天然植物中开发无毒且高效的降糖药物,如苦瓜[57],黄芪[58]和黄精等。中草药治疗糖尿病,取材方便,疗效稳定,并能结合辨证灵活的组方[59],但其有效成分、作用机制及疗效验证等方面仍有不足,是现在研究的方向。
研究表明,黄精多糖对正常小鼠血糖水平无明显影响,但可显著降低肾上腺素诱发的高血糖小鼠血糖值,同时降低肾上腺素模型小鼠肝脏中cAMP的含量[60]。黄精多糖还可提高STZ糖尿病大鼠模型的胰岛素敏感性,抑制胰岛细胞凋亡,下调Caspase-3表达[61],降低NO和NOS水平[62]。此外,陈婷婷[63]等人发现黄精多糖能降低糖尿病大鼠心肌TLR4、NF-κB和MIF蛋白表达,对糖尿病大鼠心肌炎症具有保护作用。Wang Y[64]等人指出黄精多糖能通过降低STZ诱导的糖尿病大鼠高血糖症状和氧化应激,延缓糖尿病视网膜病变和白内障的发展。通过降低肾脏组织转化生长因子β1(TGF-β1)、内皮素-1(ET-1)、型胶原(Col-I)蛋白表达,黄精多糖能对糖尿病大鼠肾脏起到保护作用[65]。
3.3 抗肿瘤
近年来,研究者将肿瘤与炎症联系到一起[66],虽然非可控性炎症不是肿瘤等复杂疾病的起始诱因,但很多肿瘤都是在炎症部位被诱发,炎症与某些肿瘤之间存在着紧密的联系。Toll样受体(Toll like receptor,TLR)能选择性的识别病原体中的病原相关的保守结构,预先激活天然免疫,是宿主固有免疫的重要激活剂,其中TLR4在对抗细菌感染中发挥着核心的作用。
Long等[67]的实验结果表明:在用黄精多糖对雌性57BL/6小鼠治疗后,肿瘤重量明显下降,抑瘤率提高,脏器指数升高。此外,CD4+/CD8+淋巴细胞比例和血清细胞因子水平均有明显改善。黄精多糖通过激活TLR4受体和下游MAPK/NF-κB信号通路发挥抗肺癌的免疫增强作用。
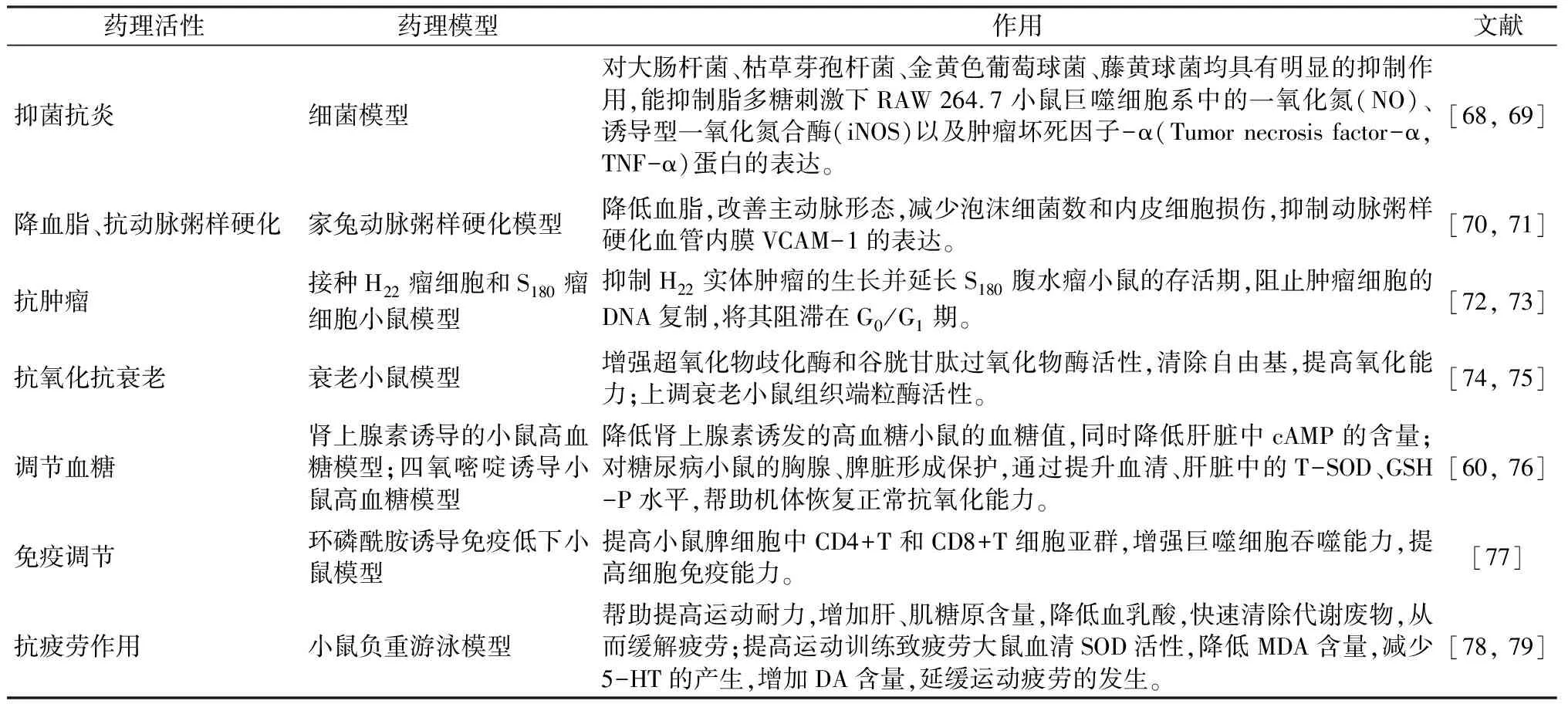
表4 黄精多糖的药理活性
4 小结与展望
黄精多糖的提取工艺、结构及其药理活性已取得一定的研究成果,但是由于黄精来源以及提取分离纯化方式的不一致,导致研究重复性不高,工作量较大,难以有进一步的突破,希望通过结构修饰早日解析出黄精多糖的构型关系,将植物多糖的研究推上新的台阶。
