宁肾祛湿化瘀汤对狼疮肾炎小鼠AT1R、HIF-1α和HO-1 mRNA的影响*
2019-06-11朱克俭郭玉星
黄 上,朱克俭,涂 岑,郭玉星
(湖南省中医药研究院附属医院,湖南 长沙 410006)
系统性红斑狼疮(systemic lupus erythematosus,SLE)是由多种自身抗体产生全身多系统损害的自身免疫性疾病,它的主要特征为以血清中出现抗核抗体(antinuclear antibody,ANA)为代表的多种自身抗体和多器官、多系统受累。SLE累及肾脏引起的肾损害被称为狼疮性肾炎(lupus nephritis,LN)。SLE最常见且严重的内脏损害就是LN。从临床表现来看,70%以上的SLE患者肾脏受累,从肾组织病理活检情况来看,几乎所有SLE患者均有肾脏损害[1],SLE预后受肾脏病变的严重程度的直接影响[2]。LN临床表现复杂多样、程度不同表现不同,但主要表现为蛋白尿、血尿、管型尿,或伴有高血压、水肿等临床肾损害和肾功能减退的实验依据,其临床诊治困难,易使病情逐渐进展,部分患者最终进展为终末期肾病(end-stage renal disease,ESRD)[3]。LN 的病因和发病机制目前还不明朗,治疗效果亦是良莠不济。目前现代医学以糖皮质激素、细胞毒药物、生物制剂、干细胞移植、大剂量免疫球蛋白冲击疗法等治疗,取得了一定效果。但这些药物的复发率高、副作用大、价格昂贵等劣势限制了其长期使用,而且因为SLE的复杂性、异质性,若单纯干预某一环节的治疗往往难以起到理想效果。中医药是我国医学资源中的瑰宝,长期临床实践证实中医药具有多部位、多环节和多靶点的整体调节功能,同时在疗效的提高、预后的改善、复发的减少、病情长期稳定的维持、激素减量使用等方面有着较佳表现。对于具有基因调控、发病机理复杂、病情多变的LN患者,采用中医药治疗具有非常重要的意义。在临床上我科常采用宁肾祛湿化瘀汤治疗该病并取得了较好的效果。但该病致病机制如何,该复方如何起到治疗效果,其作用靶点在哪,均值得进一步研究证实。通过文献学习发现,血管紧张素Ⅱ 1型受体(AT1R)、缺氧诱导因子(HIF-1α)和血红素氧合酶-1(HO-1)在LN中具有重要作用[4-5]。因此,本实验建立狼疮肾炎小鼠模型,探讨宁肾祛湿化瘀汤治疗LN的作用机制,观察宁肾祛湿化瘀汤对狼疮肾炎小鼠肾组织AT1R、HIF-1α及HO-1 mRNA表达的影响,现总结如下。
1 材料与方法
1.1 实验动物 6~8周龄清洁级雄性DBA/2J小鼠、B6D2F1小鼠,体质量20~22 g(由湖南省中医药研究院动物实验室购自湖南斯莱克景达实验动物有限公司),动物合格证号:SCXK(湘)2013-0004,SCXK(湘)2016-0012。
1.2 实验药物 宁肾祛湿化瘀汤:熟地15 g,麦冬10 g,干生地10 g,桃仁10 g,柴胡6 g,红花10 g,当归15 g,牛膝10 g,茯苓10 g,白术10 g,黄芪20 g,白蔻仁10 g,木香10 g,甘草6 g。由湖南省中医药研究院附属医院药剂科提供,加水煎煮2次后,制备宁肾祛湿化瘀汤水煎液,生药浓度为7.8 g/mL。
1.3 实验仪器及试剂 IgG-ELISA试剂盒(Abcam,ab151276)、IgG1-ELISA 试剂盒(Abcam,ab133045)、IgG2a-ELISA 试剂盒(Abcam,ab133046),反转录试剂盒(康为世纪生物科技有限公司,CW2582)、荧光定量PCR试剂盒(康为世纪生物科技有限公司,CW3008)。
1.4 实验方法
1.4.1 实验分组 根据小鼠体质量,随机分为空白组、生理盐水组、宁肾祛湿化瘀汤低、中、高剂量组,每组10只。
1.4.2 动物造模 采用慢性移植物抗宿主病(cGVHD)的方法诱导狼疮肾炎小鼠模型[6]:首先采用颈椎脱位法将DBA/2J雄性小鼠(供体小鼠)处死,用75%乙醇浸泡消毒5 min后,在无菌原则下取出小鼠淋巴结、胸腺、脾,放入器皿中,剪碎、研磨、过滤。Tris-NH4Cl红细胞裂解液裂解悬浮细胞,生理盐水洗涤3次,调整细胞悬液至所需浓度。将已调节好浓度的DBA/2J鼠细胞经尾静脉输入B6D2F1小鼠(同周龄)。按每鼠输入1×108个/mL,每周2次免疫小鼠,共4次。
1.4.3 实验干预 在造模2周后,各组予相应实验药物灌胃,具体剂量参照根据徐叔云教授主编的《药理实验方法学》中人和动物间体表面积折算的等效剂量比值表计算出每只宁肾祛湿化瘀汤低剂量组小鼠每日灌服宁肾祛湿化瘀汤19.5 g/kg,根据低、中、高剂量用药量比例为1∶2∶4得出中、高剂量组的给药剂量分别为每日39、78 g/kg;空白组、生理盐水组小鼠予生理盐水灌胃,25 mL/kg,1次/d,共干预8周。
1.5 观察指标 从造模后开始,每周收集一次24 h小鼠尿液,使用尿蛋白定性测试盒(磺基水杨酸法)(南京建成生物,C035-1-1)定性实验:取新鲜尿液转移入小试管。滴加磺基水杨酸溶液3~4滴,形成界面。立即观察,如有浑浊,提示尿液中含有蛋白质,浑浊深浅表示含量多少;确定尿蛋白含量以得出尿蛋白发生率。干预建模8周后,采血ELISA测定空白组和模型组小鼠血清IgG、IgG1、IgG2a,处死小鼠,取空白组及模型组小鼠肝、肾、肠,观察病理情况,ELISA数据和HE染色的数据均只检测空白组和模型组并进行比对。
1.6 qPCR检测 为证明建模成功,取各组肾组织采用qPCR检测AT1R、HIF-1α、HO-1 mRNA表达。qPCR引物序列(Primer Premier 5.0软件设计)GAPDH-F:5'-AGGTCGGTGTGAACGGATTTG-3',GAPDH-R:5'-GGGGTCGTTGATGGCAACA-3';AT1R-F:5'-ATGCTTGGGGCAACTTCACTA-3',AT1R-R:5'-CGGTGCATGTGGTAGACGAG-3';HIF-1α-F:5'-TCTCGGCGAAGCAAAGAGTC-3',HIF-1α-R:5'-AGCCATCTAGGGCTTTCAGATAA-3';HO-1-F:5'-AGGTACACATCCAAGCCGAGA-3',HO-1-R:5'-CATCACCAGCTTAAAGCCTTCT-3'。
组织样品提取RNA后反转录成的cDNA,反转录产物用于实时定量PCR,目的基因为AT1R、HIF-1α、HO-1,以 GAPDH 作为内参。qPCR 参数为:95℃预变性60 s 1个循环,95℃变性15 s和57℃退火20 s,72℃延伸20 s,40个循环。mRNA浓度通过公式x=2-△△Ct计算,其中x=各组目的基因经GAPDH校正后相对于对照组的倍数。
1.7 统计学方法 所有数据采用SPSS 17.0进行数据分析,计量资料以“均数±标准差”(±s)表示,采用单因素方差分析。以P<0.05表示差异具有统计学意义。
2 结果
2.1 小鼠蛋白尿发生率 从造模后第1周开始至第8周,空白组小鼠蛋白尿发生率为0%,模型组每周逐量递增,至第8周发生率为100%,而宁肾祛湿化瘀汤中高剂量组蛋白发生率较模型组明显降低,且宁肾祛湿化瘀汤3组剂量越高发生率越低,存在剂量趋势,见表1。
表1 各组小鼠蛋白尿发生率(±s,n=10,%)
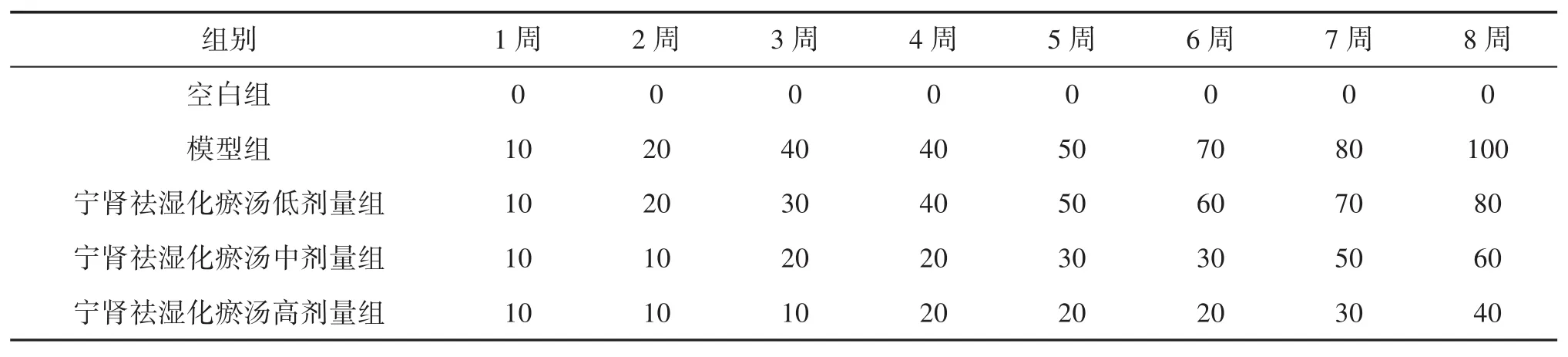
表1 各组小鼠蛋白尿发生率(±s,n=10,%)
组别 1周 2周 3周 4周 5周 6周 7周 8周空白组 0 0 0 0 0 0 0 0模型组 10 20 40 40 50 70 80 100宁肾祛湿化瘀汤低剂量组 10 20 30 40 50 60 70 80宁肾祛湿化瘀汤中剂量组 10 10 20 20 30 30 50 60宁肾祛湿化瘀汤高剂量组 10 10 10 20 20 20 30 40
2.2 空白组、模型组血清造模8周后IgG、IgG1、IgG2a变化 模型组小鼠在造模8周后血清中总的IgG、IgG1、IgG2a含量明显高于空白组(P<0.05),说明cGVHD法造模后IgG、IgG1、IgG2a明显升高,符合该法造模成功表现,见表2。
2.3 病理学结果 空白组小鼠肝肾肠病理检查未见明显异常。模型组可见肝细胞局灶性坏死、萎缩、肝索排列紊乱,在汇管区淋巴细胞浸润严重;肾脏见高度增生的肾小球毛细血管壁,其襻内的细胞数明显增多,有大量的炎性细胞浸润肾间质,有大量蛋白管型见于晚期肾小管腔内;肠黏膜下层见大量的淋巴细胞浸润,上皮黏膜呈现坏死表现。见图1。
表2 空白组、模型组IgG、IgG1、IgG2a变化(±s,n=10,ng/mL)

表2 空白组、模型组IgG、IgG1、IgG2a变化(±s,n=10,ng/mL)
注:与空白组比较,aP<0.05
组别 IgG IgG1 IgG2a空白组 775±147.1 578±183.5 240±47.4模型组 1431±230.7a 1516±355.4a 464±89.2a
2.4 AT1R、HIF-1α、HO-1 mRNA变化 与空白组比较,模型组 AT1R、HIF-1α、HO-1 mRNA 表达升高(P<0.05),说明小鼠造模后肾组织中AT1R、HIF-1α、HO-1 mRNA表达增高。与模型组比较,宁肾祛湿化瘀汤低、中、高剂量组 AT1R、HIF-1α、HO-1 的 mRNA表达降低(P<0.05)。而且宁肾祛湿化瘀汤低、中、高剂量组中肾组织AT1R、HIF-1α、HO-1 mRNA水平的降低存在剂量趋势,高剂量组降低最明显,见表3。
表3 各组 AT1R、HIF-1α、HO-1 mRNA 表达水平(±s,n=10)
注:与空白组比较,aP<0.05;与模型组比较,bP<0.05;与宁肾祛瘀化湿汤低剂量组比较,cP<0.05
HIF-1α 1±0模型组 -HO-1空白组 - 1±0组别剂量/(g·Kg-1)AT1R 1±0 3.71±0.78a 3.76±0.30a 2.93±0.53a宁肾祛湿化瘀汤低剂量组 19.5 2.48±0.10b 3.24±0.35b 2.10±0.28b宁肾祛湿化瘀汤中剂量组 39 1.48±0.11bc 1.80±0.26bc 1.82±0.24bc宁肾祛湿化瘀汤高剂量组 78 1.24±0.16bc 1.13±0.06bc 1.04±0.07bc
3 讨论
LN发病率逐年递增[7],严重影响人民生活质量,虽引起了大家的重视,但是其病因和发病机制目前还不十分清楚。在治疗上,目前临床主要以糖皮质激素、细胞毒药物、生物制剂、干细胞移植、大剂量免疫球蛋白冲击疗法等治疗,虽取得了一定效果,但是它们的副作用不容忽视[8]。中医药具有多靶点,副作用小的特点,用于治疗该病取得了良好效果[9-15]。宁肾祛湿化瘀汤为我院治疗狼疮肾炎的经验方,已在临床运用10余年,该方主要由熟地、麦冬、干生地、桃仁、柴胡、红花、当归、牛膝、茯苓、白术、黄芪、白蔻仁、木香等药物组成,共奏滋阴祛湿化瘀之功效。补益肾阴,扶助正气,有利于湿热、瘀血的清散;利湿有利于肾阴的恢复;祛瘀使水利气行,滋肾利湿祛瘀三者相得益彰,在临床治疗中取得较好的效果,但其作用机制不明。现代研究发现AT1R、HIF-1α、HO-1 mRNA[16-19]在 LN中具有重要作用。血管紧张素受体(Angiotensin receptor,ATR)有4种:AT1R,AT2R,AT3R,AT4R。在肾脏主要通过AT1R和AT2R发挥生物学作用,AT1R有调节血压、肾血流量、肾小球滤过率、水和电解质代谢以及刺激组织细胞增生等功能。缺氧诱导因子(Hypoxia-inducibler,HIF)是在缺氧条件下广泛存在于哺乳动物和人体细胞内的一种转录因子,HIF-1的表达以肾、心、胸腺最高,肝、脾、肺、睾丸次之,骨骼肌最低。α亚基为HIF-1所特有,HIF-1的生理活性主要取决于HIF-1α亚基的活性和表达,HIF-1α仅在缺氧细胞核中存在。研究证实[16]T1R,HIF-1 α表达增加在LN的发病和疾病的发展中有重要作用,参与LN细胞增殖、炎性浸润、缺血缺氧以及肾脏损伤进入纤维化的阶段。HIF-1α表达上调是机体缺氧早期首先发生的分子水平的适应性反应,并可促进多个靶基因表达上调,介导与缺氧有关的各种病理生理反应,使机体产生一系列缺氧适应反应。HIF-1α下调血红素加氧酶-1(heme oxygenase-1,HO-1)可能是其主要途径之一[20]。因此研究它们之间的关系对于厘清发病机制、作用靶点及中医药推广具有重要意义。
实验结果分析,从造模后至第8周后空白组小鼠蛋白尿发生率为0,模型组每周逐量递增,至第8周发生率为100%,说明用cGVHD法造模后蛋白尿明显增高。模型组小鼠在造模8周后血清中总的IgG、IgG1、IgG2a含量明显高于空白组(P<0.05),说明cGVHD法造模后IgG、IgG1、IgG2a明显升高;模型组小鼠肝肾肠表现出狼疮肾炎的病理结果。综合以上结果说明采用慢性移植物抗宿主病(cGVHD)的方法诱导狼疮肾炎小鼠模型复制成功[6]。
模型组小鼠蛋白尿发生率明显增高,而宁肾祛湿化瘀汤各组明显降低,且存在剂量趋势,说明宁肾祛湿化瘀汤可改善狼疮肾炎症状,且高剂量效果最佳。从肾组织AT1R、HIF-1α、HO-1 mRNA变化来看,模型组中三者较空白组明显升高,说明三者在LN发生过程中具有重要作用,而用宁肾祛湿化瘀汤3组剂量均较模型组明显降低,且AT1R、HIF-1α、HO-1 mRNA表达呈现出剂量趋势,高剂量最强,同时减轻了肾炎症状(3组均明显降低了尿蛋白发生率),说明AT1R、HIF-1α、HO-1 mRNA表达与LN发展呈现出正相关趋势,而宁肾祛湿化瘀汤具有明显抑制AT1R、HIF-1α、HO-1 mRNA表达的作用,由此推断宁肾祛湿化瘀汤治疗LN可能是通过抑制AT1R、HIF-1α、HO-1 mRNA表达而起作用的。
由实验结果分析得出,宁肾祛湿化瘀汤可改善狼疮肾炎小鼠模型症状,其作用机制可能与降低肾脏中AT1R、HIF-1α、HO-1 mRNA表达有关。但是由于体内实验存在不确定性因素较多,证实它们的关系还需结合体外实验的进一步验证。本研究还存在一定的局限性,本实验仅仅采用3个剂量比较而未加入阳性对照药物,会使实验结果有所偏倚,实验中只是选取了基因表达检测而未行免疫组织化学或蛋白质免疫印迹测定三者蛋白表达,证据支持力略显偏弱,这些有待于后续进一步研究改进。
