IL-6对体外培养的牛眼小梁细胞中纤维连接蛋白的影响
2019-06-10刘玉震
刘 攀,孟 杰,刘玉震,王 强
0引言
原发性开角型青光眼(primary open angle glaucoma,POAG)是一类以房角开放、眼压缓慢升高为特征的青光眼,具体的病理机制还不十分清楚。目前传统观点认为,其眼压的缓慢升高与小梁网组织的结构和功能发生改变导致房水流出阻力升高有关。当前多采用眼压监测和全自动视野机等辅助检查诊断POAG。而有研究指出,大于35%的就诊者在被发现视野缺损之前可能已经出现了视神经节细胞的丢失[1],并且有流行病学统计报道,在有诊断意义的POAG视神经损害的受试者中,约50%患者眼压低于21mmHg[2]。因此仅以视野检查和眼压检查作为POAG早期筛查的方法是非常局限的。白细胞介素-6(interleukin-6,IL-6)是常见的一种促炎性因子,其在多种疾病中发挥作用。有研究发现其通过与T细胞、B细胞和巨噬细胞相互作用可参与氧化应激和炎症作用的过程[3-4];还有研究指出,IL-6可以通过增加纤维连接蛋白(fibronectin,FN)表达的方式加速瘢痕增生并诱导肺动脉高压形成[5-6],在剥脱综合征中,IL-6参与和促进了FN蛋白的生成,并诱导了开角型青光眼的产生[7]。目前国内外有多篇文献报道,在POAG患者的房水和外周血液中,IL-6的含量较非青光眼患者均有所下降[8-11],而此种改变对患者产生了何种影响尚无报道。因此我们推测IL-6的此种改变在视网膜神经节细胞死亡和青光眼的发病机制中可能对FN存在影响,并以此改变POAG进程。本实验通过体外培养牛眼小梁细胞并模拟IL-6浓度改变的过程,进一步监测FN的变化,为探讨青光眼患者发病时IL-6浓度变化对其病情进展产生的作用,以及POAG的筛查与治疗提供新思路。
1材料和方法
1.1材料新鲜摘取的2岁以下公牛眼球;胎牛血清、高糖DMEM培养基、胰酶(美国Hyclone公司);PBS、BSA(北京Solarbio科技有限公司);Trizol试剂盒、逆转录试剂盒、荧光定量试剂盒(日本Takara公司);牛IL-6蛋白冻干粉、牛FN蛋白单克隆抗体(美国Abcam公司)。
1.2方法
1.2.1牛眼小梁细胞的原代培养和鉴定采用组织块培养法,摘取新鲜的牛眼眼球,去除眼外肌、结膜和筋膜组织,并用75%乙醇浸泡眼球5min,转移至超净工作台中,距角膜缘约4mm处环形剪开眼球。翻转眼前节组织,去除玻璃体,轻轻地撕除晶状体和虹膜组织,体视显微镜下于白色的巩膜突和Schwalbe线之间撕取小梁组织,平铺于预置2mL胎牛血清的培养皿中,待组织贴壁干燥后加入8mL含20%胎牛血清的高糖培养基中,将培养皿放入体积分数5% CO2、37℃的细胞培养箱中。待细胞爬出并融合,采用贴壁细胞传代的方法,传代并培养至第3代。
1.2.2 IL-6工作液制备以超速离心机在4℃下3000r/min离心2min,使所有IL-6冻干粉沉积于EP管底。以无菌PBS溶液制备10mL的0.1% BSA溶液,以此PBS-BSA溶液复溶IL-6干粉并吹打,制成浓度为10μg/mL工作母液。取1mL 0.1% PBS-BSA溶液为A组(对照组);取1μL母液溶于10mL 0.1% BSA溶液制成终浓度为0.1ng/mL的B组工作液;同样方法制备浓度为0.5、1ng/mL的C组和D组工作液。
1.2.3 IL-6对小梁细胞的干预将生长良好的第3代牛眼小梁细胞接种于6孔细胞培养板,培养24h待细胞铺满,以PBS冲洗培养板,分别加入2mL前述A~D组工作液,继续培养24h。
1.2.4实时荧光定量PCR法检测各组牛眼小梁细胞中FN mRNA的表达分别提取4组细胞的总mRNA,用分光光度计测定所提mRNA的浓度和纯度,含量为1.5~2.0g/L;260nm与280nm处的吸光度比值为1.8~2.0。按照逆转录试剂盒说明书的步骤合成cDNA,并进行实时荧光扩增,以β-actin为内参照,内参及目的基因FN引物由上海生工生物技术有限公司合成。β-actin引物序列:上游:5’-CCATCGGCAATGAGCGGTTCC-3’,下游:5’-CGTGTTGGCGTAGAGGTCCTTG-3’;FN引物序列:上游:5’-TGGCGAGTGGAAGTGTGAGAGG-3’,下游:5’-ATACGGAGGCGGCTGAGGATG-3’。反应条件为:95℃预变性30s,95℃变性5s,60℃退火30s,共40个循环,每次扩增均设置β-actin为内参对照。2-ΔΔCt法计算FN mRNA的相对表达量。实验重复3次,每组设3个复孔。
1.2.5蛋白质免疫印迹法检测各组牛眼小梁细胞中FN蛋白的表达取4组细胞使用预冷PBS洗涤3遍,弃去洗涤液。每孔细胞加400μL含PMSF的裂解液,于冰上裂解30min,用移液枪转移至离心管中,4℃、12 000r/min,离心5min,将上清转入一预冷的洁净EP管中,即得所需蛋白;测量蛋白浓度,按4∶1的浓度加5×上样缓冲液,煮沸15min,聚丙烯酰胺凝胶100V恒压电泳分离60min后,转移至PVDF膜上,用稀释浓度分别为1∶1000和1∶4000的鼠来源的牛FN一抗和HRP标记的山羊抗鼠二抗进行免疫酶联反应,曝光,得到胶片图像。利用Image J软件对所得灰度图像进行拍照和定量分析,得到目的蛋白FN与内参β-actin灰度的比值作为目的蛋白的相对表达量。实验重复3次,每组设3个复孔。
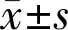
2结果
2.1牛小梁细胞的原代培养和鉴定小梁组织块培养7~9d后可见大量细胞自组织边缘爬出,呈长梭形、多角形,边界清晰,排列紧密,大小不一,生长状态良好(图1A)。培养至第3代的牛小梁细胞形态和大小变化情况趋于稳定,细胞中可见圆形细胞核,细胞内色素颗粒增多,符合既往本实验室所培养的牛眼小梁细胞形态特征[12](图1B)。
2.2小梁细胞在不同IL-6浓度下FN mRNA的变化实时荧光定量PCR检测结果显示,各组分别在0、0.1、0.5、1ng/mL IL-6刺激下FN mRNA的相对表达量分别为1.000±0.000、0.213±0.004、0.056±0.001、0.019±0.002,4组间差异有统计学意义(F=77.13,P=0.001,图2)。不同浓度IL-6下培养的牛眼小梁细胞产生的FN mRNA量呈下调趋势(rs=-0.713,P<0.05)。经LSD-t检验行两两比较:0ng/mL组与0.1、0.5、1ng/mL组间差异均有统计学意义(均P<0.001);0.1ng/mL组与0.5、1ng/mL组间差异均有统计学意义(P=0.03、0.01);0.5ng/mL组与1ng/mL组间差异有统计学意义(P=0.049)。
图1小梁细胞形态学鉴定A:倒置显微镜下可见培养9d的牛眼小梁细胞从小梁组织块周边游出,贴壁生长,形态多样(×100);B:第3代小梁细胞形态趋于稳定,呈梭形,有较多突起,细胞内可见色素颗粒(×200)。

图2不同浓度IL-6干预下各组小梁细胞中FN mRNA相对表达量。
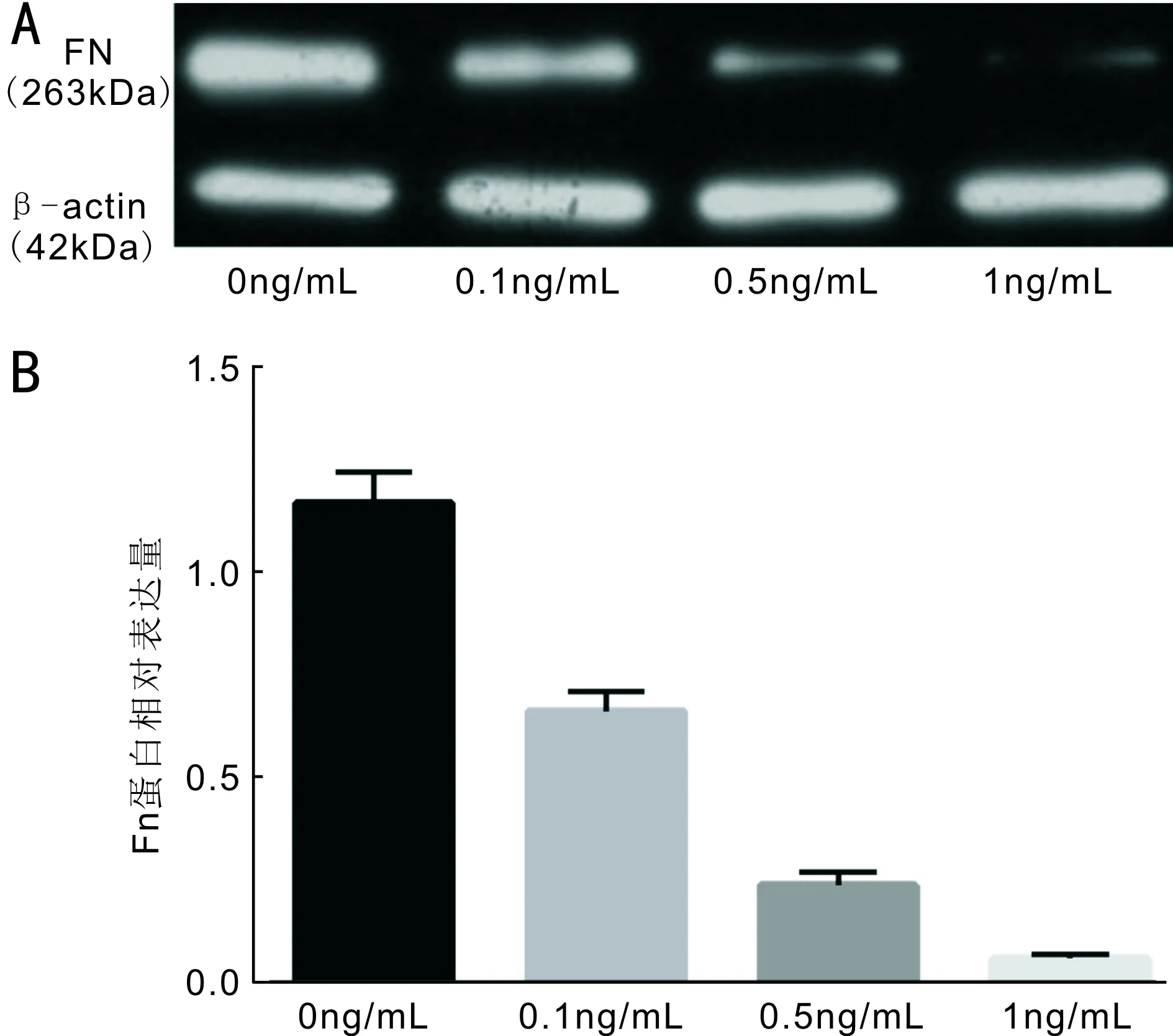
图3不同浓度IL-6干预下各组小梁细胞中FN蛋白表达量的比较A:FN蛋白电泳图;B:FN蛋白相对表达量。
2.3小梁细胞在不同IL-6浓度下FN蛋白的变化蛋白质免疫印迹法显示,各组分别在0、0.1、0.5、1ng/mL IL-6刺激下FN蛋白相对表达含量分别为1.167±0.012、0.662±0.009、0.238±0.011、0.061±0.011,4组间差异有统计学意义(F=95.01,P=0.01,图3)。不同浓度IL-6下培养的牛眼小梁细胞产生的FN 蛋白量呈下调趋势(rs=-0.901,P<0.05)。两两比较采用LSD-t检验:0ng/mL组与0.1、0.5、1ng/mL组间比较差异有统计学意义(P=0.01、<0.001、<0.001);0.1ng/mL组与0.5、1ng/mL组间差异有统计学意义(P=0.01、<0.001);0.5ng/mL组与1ng/mL组间差异有统计学意义(P=0.04)。
3讨论
目前POAG的确切病因还未完全证实,有学说认为,小梁网组织是房水流出通道中最重要的一环,原发性开角型青光眼房角开放但眼压升高是由于小梁组织的局部病变造成小梁途径房水引流系统发生了病变,房水流出阻力增加所致[13]。同时也有文献证明氧化应激损伤是导致POAG的病理原因之一[14],有证据支持氧化应激作为视网膜神经节细胞(retinal ganglial cells,RGCs)的亚细胞区的组成部分,参与了青光眼性的神经退行性变;除了直接的细胞毒性导致RGCs死亡外,ROS还很可能通过酶氧化特定的氨基酸残基,并且作为第二信使和/或通过氧化还原修饰下游效应物以调节蛋白功能,从而参与RGCs死亡信号的传递[15]。多种学说交汇,仍未有统一定论。
关于青光眼引起的组织损伤,目前大部分学者公认是由于眼压升高对神经元、筛板和血管的机械性压迫损伤。小梁网作为传统的房水流出通道中最重要的组织之一,其上有大量的小梁细胞内衬其中,位于近小管区和Schlemm管前部,是房水外流阻力最大的部分,其功能及其形态结构的变化直接影响了眼压的变化[16-18]。有实验指出,小梁网的内皮细胞和血管内皮细胞有分泌IL-6的功能[19]。而在POAG的基础和临床研究中,有学者发现了POAG患者房水和血液中IL-6表达含量较非青光眼患者有所下降[8-11,20],且房水引流通道中FN蛋白表达有所升高[21]。还有研究指出,POAG患者经过6mo以上局部降眼压药物治疗后,眼表的IL-6水平较正常人有所回升[22]。
细胞外基质重塑对小梁网的结构改变起到了不可或缺的影响[23-24]。FN蛋白是已知的细胞外基质之一,其不仅能通过增加小梁网细胞中整合素α5β1和α4β1的表达以促进小梁网细胞增殖、黏附和迁移能力[25-26],并且FN蛋白的刚度与小梁组织的刚度呈正相关[27],即FN蛋白数目与质量对小梁组织形态结构起到了影响。当前在多种疾病中都发现有IL-6对FN蛋白影响的报道。例如剥脱综合征是一类与年龄有关的弹性纤维系统疾病,其特征是细胞外基质中纤维物质的病理性沉积,其在眼部表现为晶状体皮质在房角的物理堆积导致眼压升高,激发开角型青光眼。而有实验证明在剥脱综合征导致的继发性开角型青光眼中,IL-6参与诱导了纤维连接蛋白1(FN1)和TGF-β1的表达[7]。在增生性瘢痕(HS)形成的病理机制中,与正常成纤维细胞相比,HS中的细胞因子IL-6受体被激活引起辅助T淋巴细胞在STAT3中表达上升;同时STAT3肽会抑制FN凋亡基因的表达;在HS中,研究人员发现细胞增殖标记物Cyclin D1、Bcl-X1和c-Myc表达均较正常人高[28]。
TGF-β是一组可调控细胞生长、分化和凋亡的细胞因子,其参与的多条细胞信号传导通路是促进细胞和组织纤维化的重要途径。曾有实验指出:在体外培养的人眼小梁细胞中TGF-β2眼内灌流可使房水流出率减少约27%,并且促进Schlemm管内壁多层结构中细胞外基质的聚集[29],即TGF-β信号通过积累细胞外基质的方式增加房水引流阻力,升高眼压。Seong等[30]曾指出IL-6参与TGF-β诱导人肌腱成纤维细胞向肌成纤维细胞的分化过程,并以此作为结膜下纤维化的重要过程。有日本学者曾做出实验表示,可溶性IL-6反式信号(sIL-6)与其受体sIL-6R结合可增强STAT3磷酸化,同时sIL-6与受体结合后表现出以抑制Smad2的方式抑制TGF-β受体的作用,而当TGF-β受体过度表达又将反作用抑制sIL-6反式信号的分泌和生成[10]。综上所述,sIL-6反式信号以激活HTM中STAT3的方式抑制了TGF-β导致的纤维化。房水中同时存在着IL-6及其受体,以上实验反而言之,在POAG患者前房中,当IL-6浓度降低,IL-6与受体结合减少,TGF-β含量上升,同时IL-6-STAT3轴由于负反馈而被破坏,FN及其他细胞外基质生成增多后堆积且降解降低,导致了房水引流受阻。而本实验证实,IL-6通过影响FN转录与蛋白表达的方式,呈现出与FN的负相关关系,即IL-6浓度越低,FN mRNA转录能力增强,小梁细胞产生的FN蛋白越多,侧面证实了上述众实验的结论。不仅如此,我们还认为,当眼压升高破坏血-房水屏障,可以使得房水中IL-6进入血管内壁,IL-6可通过改善细胞内吞与转运增加血管内皮通透性[31-33],从而使得血管中液体及其他促炎因子渗出,增加房水含量与前房炎症反应,能够进一步加重POAG患者眼部表现。
由于时间有限,本实验并未加入IL-6抗体测得抗IL-6与FN的关系,是该实验的局限性。下一步将由本实验室进一步印证IL-6与POAG之间的关系,以期IL-6的研究能够为POAG的早期筛查与治疗带来新的治疗思路和方法,以更加低廉、有效的途经解决患者病痛。
最新中国科技核心期刊眼科学类期刊主要指标及排名
刊名核心总被引频次数值排名核心影响因子数值排名综合评价总分数值排名中华眼科杂志2040(3435)2(2)0.953(1.073)1(4)78.41眼科新进展1273(545)3(4)0.690(1.344)4(3)60.52国际眼科杂志2446(5519)1(1)0.667(1.412)5(2)57.23中华眼底病杂志86550.878254.34中华实验眼科杂志101840.692346.25临床眼科杂志51370.523638.56眼科38780.398827.17中华眼视光与视觉科学杂志52860.390925.58中国斜视与小儿眼科杂志25690.470710.19 9种期刊平均值10360.629
摘编自2018版《中国科技期刊引证报告》核心版和扩展版(括号里面为扩展版的统计指标)
