基因修饰诱导骨髓间充质干细胞分化治疗视神经损伤
2019-06-10欧阳明刘静雯刘桂琴
欧阳明,刘静雯,刘 珂,刘桂琴,秦 波
0引言
视神经损伤又称为外伤性视神经炎病变,属于颅脑损伤中最为常见、严重的并发症之一,占颅脑外伤的2%~5%。视神经损伤诱因相对较多,包括车祸伤(最为常见)、坠落伤、打击伤等,且根据解剖结构、生理学特点,90.0%以上患者是由于视神经管段的间接性损伤导致[1]。当中枢神经受到不同程度损伤后,神经轴突将无法再生,导致视网膜上的神经节细胞发生凋亡,成为致盲的重要原因。因此,加强视神经损伤早期治疗和干预对改善预后具有重要的意义[2]。骨髓间充质干细胞是一种主要分布于骨髓中的干细胞,其具有干细胞的特性,即自我更新、多向分化,故已成为基因治疗的较为理想的靶细胞。在关于眼科疾病的相关治疗中,骨髓间充质干细胞的研究热点主要在角膜疾病、视网膜疾病方面。视网膜疾病的治疗主要有视网膜下移植与玻璃体腔内注射两种治疗手段。目前关于骨髓间充质干细胞在视网膜疾病治疗中的研究还处于动物实验阶段。本文旨在探讨基因修饰诱导骨髓间充质干细胞分化治疗视神经损伤的效果。
1材料和方法
1.1材料实验动物:选取检疫合格、健康无眼疾的SD大鼠26只[动物合格证号:SCXK-(吉)2007-0003;动物质量检测合格证书号:95A50;购自吉林大学白求恩医学院动物实验中心],8周龄,雌雄不限,体质量200~420(平均310.63±15.66)g,常规饲养,自由摄食、饮水。主要试剂:胶质原纤维酸性蛋白(glial fibrillary acidic protein,GFAP)抗体(上海图赫公司)、异硫氰酸荧光素标记Caspase-3蛋白抗体(上海西唐生物科技有限公司)、磷酸缓冲盐溶液(PBS)(常德比克曼生物科技有限公司)、4×SDS loading buffer(上海生工公司)、质粒载体转染试剂盒(北京义翘神州科技有限公司,货号STF02)、BCA试剂盒[天根生化科技(北京)有限公司]、DMEM培养基(美国Sigma-Aldrich)、胰酶(南京华耀医药科技有限公司)、生理盐水(南京便诊生物科技有限公司)、SDS-PAGE(北京百奥莱博科技有限公司)。主要仪器设备:细胞培养箱(美国Shellab)、光学显微镜(日本奥林巴斯公司)、电泳仪(长沙湘仪公司)。本研究符合动物管理保护条例,并经过伦理委员会批准。
1.2方法
1.2.1骨髓间充质干细胞的制备及修饰
1.2.1.1骨髓间充质干细胞的制备随机选取2只雄性SD大鼠(8周龄),颈椎脱臼处死,用75%乙醇消毒后转移至超净工作台中,分离大鼠的股骨,用PBS缓冲液冲出股骨中的骨髓。离心后取沉淀于37℃,5%CO2细胞培养箱中进行贴壁培养,显微镜下观察细胞增殖到70%~80%时进行传代。PBS缓冲液洗涤后加入适量胰酶消化,当细胞呈圆球形态后加入不含血清的DMEM培养基终止消化。低速离心后取沉淀,加入不含血清的DMEM培养基,吹打混匀后分入不同的培养瓶中,继续培养[3]。
1.2.1.2骨髓间充质干细胞的修饰将编码睫状神经营养因子(ciliary neurotrophic factor,CNTF)的全基因序列克隆至pHIV-dTomato载体中,鉴定后将质粒载体转染进T细胞中以实现慢病毒的合成[4]。分离慢病毒,将带有CNTF编码序列的慢病毒转染进入骨髓间充质干细胞中,选择表达GFAP的干细胞继续培养。
1.2.2动物模型的建立及分组
1.2.2.1视神经损伤动物模型建立选取24只SD大鼠,禁食12h后采用钳夹视神经法建立视神经损伤大鼠模型。应用3%水合氯醛麻醉大鼠,取俯卧位,去除左侧眼睑周围的毛发备皮,固定四肢后,将大鼠的头轻微偏向右侧,在上眼睑的1/3处进刀将眼睑打开约0.5cm长,游离眼球后的脂肪与眼直肌,暴露视神经,用止血钳夹取视神经约10s,撤走止血钳,缝合伤口后局部涂抗生素防止感染[5]。建模完毕后立刻利用手电筒直射大鼠的左侧瞳孔,如观察到瞳孔立即缩小而移开手电筒后瞳孔大小恢复正常表明对光具有反射,建模失败;如手电筒照射后瞳孔立即缩小且移开手电筒后瞳孔大小不能恢复,表明建模成功。本研究24只SD大鼠均造模成功。
1.2.2.2动物分组及干预造模成功后将大鼠随机分为研究组和对照组,各12只,经过3d恢复后,研究组大鼠于造模成功后第4d左眼玻璃体腔内注射约10μL经修饰的骨髓间充质干细胞悬液,对照组大鼠注射等量生理盐水[6]。在造模成功后第7、10、13d分别进行同样的注射操作。
1.2.3观察指标
1.2.3.1光反射恢复情况造模成功后第14d检测两组大鼠对光反射的恢复情况,手电筒照射后瞳孔立即缩小且移开手电筒后瞳孔的大小能恢复视为光反射恢复。
1.2.3.2 HE染色观察大鼠视网膜神经节细胞造模成功后第14d,以断颈方式处死大鼠,取左侧眼球,分离视网膜,制备4μm切片,应用HE染色法观察两组大鼠视网膜结构,随机选取5个视野(×200)计数视网膜神经节细胞(retinal ganglion cell,RGC)数目[7]。
1.2.3.3 Western blot检测GFAP和Caspase-3表达水平HE染色的同时收集制备切片沉淀,向其中加入细胞裂解液,10000r/min离心10min,取上清液30μL,加入4×SDS loading buffer 10μL,加热煮沸,速度12000r/min离心,取上清液。利用BCA试剂盒测定样品蛋白含量。采用浓度为8% SDS-PAGE完成电泳分离,每孔上样量为20μg,浓缩胶电泳80V 30min,分离胶电泳120V 70min。转膜至PVDF膜,电压80V。封闭液封闭1h,GFAP抗体(1∶400)、异硫氰酸荧光素标记Caspase-3蛋白抗体(1∶400)孵育24h,PBST洗涤3次,每次洗涤10min,相应二抗(1∶200)常温孵育1h,PBST洗涤3次,每次洗涤10min。利用ECL化学发光法检测结果,经过显影、定影后采用扫描仪扫描,将获得的数据传输到Gel Proanalyzer软件中完成灰度分析定量。
2结果
2.1两组大鼠光反射恢复情况造模成功后第14d,对照组大鼠有对光反射者3只,无对光反射者9只;研究组大鼠有对光反射者10只,无对光反射者2只。研究组大鼠光反射恢复率(83%)明显高于对照组(25%),差异有统计学意义(χ2=9.072,P<0.05)。
2.2两组大鼠RGC情况HE染色结果显示,研究组大鼠视网膜细胞结构相对整齐,可见少量空泡;对照组大鼠视网膜细胞结构欠整齐,可见明显的空泡,且研究组大鼠RGC细胞数(207.14±2.3个)明显多于对照组(137.89±1.4个),差异有统计学意义(t=89.0926,P<0.001),见图1。
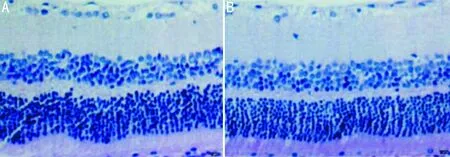
图1两组大鼠视网膜组织HE染色结果(×200)A:研究组;B:对照组。
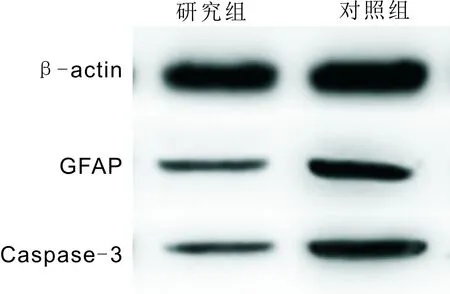
图2Western blot检测结果。
2.3两组大鼠GFAP和Caspase-3表达水平Western blot检测结果表明,研究组大鼠视网膜GFAP和Caspase-3表达水平(167.54±13.7和7.81±2.1)均低于对照组(206.87±17.6和69.53±8.3),差异均有统计学意义(t=6.1086、24.9726,均P<0.001),见图2。
3讨论
视神经受损后发生萎缩以及致盲,最重要的原因是视网膜神经节细胞数量减少[8]。神经节细胞是一种中枢神经元,没有分化能力。促使损伤的神经节细胞、视神经得到修复,是治疗视神经损伤的一个新思路[9]。鉴于神经节细胞无分化能力的特点,有学者提出通过补充外源性神经节细胞来修复视神经的损伤[10]。目前,由于受到多种技术条件的限制,很难在体外培养视神经节细胞,而且人体研究存在伦理学问题,故多选择在动物体内进行相关研究。骨髓间充质干细胞是一种位于骨髓中的干细胞,可在一定条件下经诱导分化成三胚层的细胞[11]。除了具有干细胞共同的多向分化与自我更新的特点以外,骨髓间充质干细胞还具有低免疫原性的特点。骨髓间充质干细胞可分泌中等量的主要组织相容性复合体(major histocompatibility complex,MHC)Ⅰ类分子,不表达Fas配体(FasL)(能够结合到死亡受体TNFRSF6/FAS的细胞因子)、MHCⅡ类分子,能够躲避自身T细胞的识别,不引起免疫排斥反应。所以,骨髓间充质干细胞在动物与人体的移植治疗中具有相当重要的作用[12]。无论是体内培养还是体外培养,在一定条件下骨髓间充质干细胞都能分化成神经元、神经胶质细胞,表现出修复神经的功能,呈现向损伤处迁移的特性[13-14]。为了进一步提高修复效率,培养骨髓间充质干细胞的同时,本研究将编码大鼠CNTF的全长基因序列借助慢病毒转染至骨髓间充质干细胞,以提高CNTF的表达水平。
目前对视网膜病变的治疗常采用玻璃体腔移植[15]。研究发现,当实验动物的视神经处于正常状态时,注入的骨髓间充质干细胞并未发挥作用,仅聚集于玻璃体腔中;而当实验动物的视神经受到损伤后,注入的骨髓间充质干细胞多分布于内界膜层,移植30d或1mo后大量的神经元特异性烯醇化酶、多种神经营养因子开始表达,证实玻璃体腔移植骨髓间充质干细胞能够修复视网膜损伤[16]。本研究将SD大鼠的视神经暴露后用止血钳夹数秒,构建单侧视神经损伤模型[17]。同时体外培养基因修饰过的骨髓间充质干细胞,待大鼠恢复一段时间后,吸取适量含干细胞的培养液,注入大鼠的玻璃体腔中。从建模成功后第4d开始,每隔3d注射一次干细胞,对照组则注射等量的生理盐水。建模成功后第14d,用手电筒进行直接对光反射检查发现,对照组大鼠光反射恢复率显著低于研究组大鼠。HE染色结果显示,研究组大鼠视网膜结构相对整齐,可见少量空泡;对照组大鼠视网膜结构欠整齐,可见明显的空泡,且研究组大鼠视网膜神经节细胞数明显多于对照组。视网膜神经节细胞在视觉的产生中具有举足轻重的作用,其数目的增加,反映了大鼠视力在一定程度的恢复。Western blot检测结果表明,研究组大鼠GFAP和Caspase-3表达水平均低于对照组。GFAP是参与构成中间纤维的一种丝状蛋白,存在于细胞内,与中枢神经系统不同,其作为胶质细胞特异性分布于视网膜Müller细胞[18-19]。正常情况下,Müller细胞不表达GFAP,当损伤发生时,其表达水平升高且与伤势呈正相关。Caspase-3是一种凋亡相关分子,而视神经的损伤与过度的细胞凋亡有着密切关系[20]。
综上所述,将基因修饰诱导骨髓间充质干细胞分化用于视神经损伤大鼠能有效恢复损伤的视神经,为视神经损伤的临床治疗提供了思路。但是,现阶段关于骨髓间充质干细胞的研究仅局限于动物实验水平,距离在人体应用尚有一段距离。此外,如何获得高纯度干细胞,如何解决移植后玻璃体混浊等并发症,尚需长时间、多中心的研究。
