小鼠FGF21基因克隆及his-mFGF21融合蛋白的诱导表达*
2019-06-10唐青蓝李红梅张礼林王玉丰颜礼完周君
唐青蓝, 李红梅, 张礼林, 王玉丰, 颜礼完, 周君
(1.海南省第三人民医院 检验科, 海南 三亚 572000; 2.贵州医科大学 生物化学与分子生物学教研室, 贵州 贵阳 550004)
成纤维细胞生长因子21(fibroblast growth factor 21,FGF21)作为FGF超家族的重要成员之一,是具有多效应的内分泌性生长因子。FGF21可以降低血糖、调节糖脂代谢[1],但具体作用机制仍未明确。近期研究显示,FGF21在肾脏疾病、高血压、冠心病、动脉粥样硬化、糖尿病心肌病、缺血或肥厚引起的多种心肌疾病中有重要作用[2-6]。FGF21作为一个重要物质代谢调节因子,不仅有明显的改善高血脂、高血糖和肥胖的作用,也能缓解动脉粥样硬化、冠心病等心血管疾病病情,亦可能直接参与疾病进程,是相关疾病预测、治疗因子[7]。本课题组前期研究发现动脉粥样硬化患者FGF21水平明显高于正常对照,且与氧化低密度脂蛋白(oxidized low-density lipoprotein,ox-LDL)呈正相关[8]。但目前,FGF21在心血管疾病中具体作用机制尚未研究清楚,仍是研究热点。因此,本研究拟将小鼠FGF21 基因进行克隆,将重组子pET-28a(+)-mFGF21进行诱导表达,并纯化出小鼠FGF21 融合蛋白,为进一步开展对FGF21作用机制的研究提供基础条件。
1 材料与方法
1.1 材料
pMD19-T-M重组质粒、大肠杆菌菌株BL21(DE3)、质粒pET-28a(+)、小鼠FGF21上下游引物由本实验室保存并提供,限制性核酸内切酶、Premix Taq试剂盒、T4 DNA 连接酶、琼脂糖凝胶-DNA纯化试剂盒、X-gal及IPTG购自宝生物工程有限公司,质粒DNA提取试剂盒购自OMEGA公司,咪唑、PMSF、Triton X-100、TRIS,HIS-Select Nickel Affinity Gel 购自sigma-aldrich公司,FGF-21 Antibody rabbit polyclonal IgG、Goat anti-rabbit IgG-HRP购自Santa Cruz Biotechnology公司。
1.2 方法
1.2.1小鼠FGF21基因克隆及pET-28a(+)-mFGF21原核表达载体的构建 以本实验室前期构建-20 ℃保存的带有小鼠FGF21的T载体pMD19-T-M溶液作为模板扩增小鼠FGF21基因片段,上游引物中带有BamHI酶切位点和2个保护性碱基,下游引物中带有XhoI酶切位点和2个保护性碱基;上游引物序列为5′-CGGGATCCGCATACCCCATCCCTGACT-3′,下游引物序列为5′-CCCTCGAGGGACGCATAGCTGGGGCT-3′,下划线分别为BamHI及XhoI酶切位点。扩增程序:94 ℃ 5 min,(94 ℃ 30 s、60 ℃ 30 s、72 ℃ 1 min)×30个循环,72 ℃ 10 min。将扩增产物进行电泳、割胶回收处理、BamHI和XhoI双酶切,再将其连接至双酶切处理的pET-28a(+)质粒上,获得pET-28a(+)-mFGF21表达载体,将其转化至Ecoli.BL21DE3感受态细胞。选择抗生素平板筛选出的单菌落(阳性转化子)进行过夜培养,提取质粒DNA用BamHI和XhoI进行双酶切后电泳检测、并送基因公司测序鉴定正确,pET28a(+)-mFGF21表达载体构建成功。
1.2.2融合蛋白his-mFGF21的原核表达 将筛选出的单个阳性克隆菌落放在50 mL含抗生素的LB液体培养基中,水浴箱中37 ℃ 180 r/min振荡培养24 h,再取0.2 μL菌液至含抗生素的LB液体培养基中振摇至 OD600=0.4,加入终浓度为0.2 mmol/L的IPTG,水浴箱中23 ℃ 120 r/min振荡培养4 h,收集1 mL菌液处理,SDS-PAGE电泳检测融合蛋白表达。
1.2.3融合蛋白his-mFGF21的纯化 留取100 mL体系诱导表达的菌体沉淀,以8 mL裂解液重悬菌体后加入 PMSF(0.1 mol/L),轻柔吹打,振荡20 min,超声破碎1 h(冰浴条件下进行),4 ℃条件下将破碎后的菌液12 000 r/min 离心20 min后收集上清。取少量超声破碎的上清与超声破碎的菌体沉淀进行SDS-PAGE电泳鉴定。将200 μL超声破碎后上清液加入400 μL平衡缓冲液(不含咪唑),颠倒混匀(轻柔)数次,离心弃上清,留样少许。1 mL预冷的清洗缓冲液(不含咪唑)清洗亲和凝胶(轻柔混合),离心弃上清并留样,重复此步骤3次。将清洗好的亲和凝胶与100 μL his洗脱缓冲液结合,旋转(轻柔)混匀1 min,离心后取上清留样,重复此步骤2次。对纯化后的蛋白液、留样保存的漂洗液以及洗脱缓冲液采用 SDS-PAGE电泳进行鉴定。
1.2.4Western Blot检测 取纯化后的his-mFGF21蛋白液先后进行SDS-PAGE凝胶电泳、蛋白条带转膜(至PVDF膜上)、封闭、一抗结合(兔源性FGF21多克隆一抗)、二抗结合(羊抗兔)、显色(ECL-Plus发光试剂)。
2 结果
2.1 小鼠FGF21基因克隆及pET-28a(+)-mFGF21原核表达载体的构建
将BamHI和XhoI双酶切的小鼠FGF21基因(大体系扩增回收)克隆至同样用BamHI和XhoI双酶切处理的pET-28a(+)质粒中,获得pET-28a(+)-mFGF21表达载体,将其转化至Ecoli.BL21DE3感受态细胞,于抗生素平板上筛选出阳性克隆(如图1),初步表明pET-28a(+)-mFGF21表达载体构建成功。筛选出的阳性克隆的菌落培养24 h后提取质粒,进行BamHI和XhoI双酶切,可见2条条带(如图2),与pET-28a(+)和小鼠FGF21(546 bp)位置一致。双酶切电泳显示正确的质粒DNA送上海生工生物科技公司测序鉴定,结果表明重组质粒pET-28a(+)-mFGF21 双向测序结果正确,与小鼠FGF21基因序列相符。
图1 pET-28a(+)-mFGF21原核表达载体筛选平板Fig.1 Plate screening of pET-28a(+)-mFGF21 prokaryotic expression vector

注:M1为100 bp DNA阶梯marker,M2为wide range 1 000 bp DNA阶梯marker;1、2为pET-28a(+)-mFGF21的双酶切产物图2 pET-28a(+)-mFGF21原核表达载体酶切分析Fig.2 The restriction endonuclease digestion analysis of pET-28a(+)-mFGF21 prokaryotic expression vector
2.2 融合蛋白his-mFGF21的原核表达
SDS-PAGE电泳显示在22 kD处出现明显目的蛋白条带,证明his-mFGF21诱导表达成功,见图3。
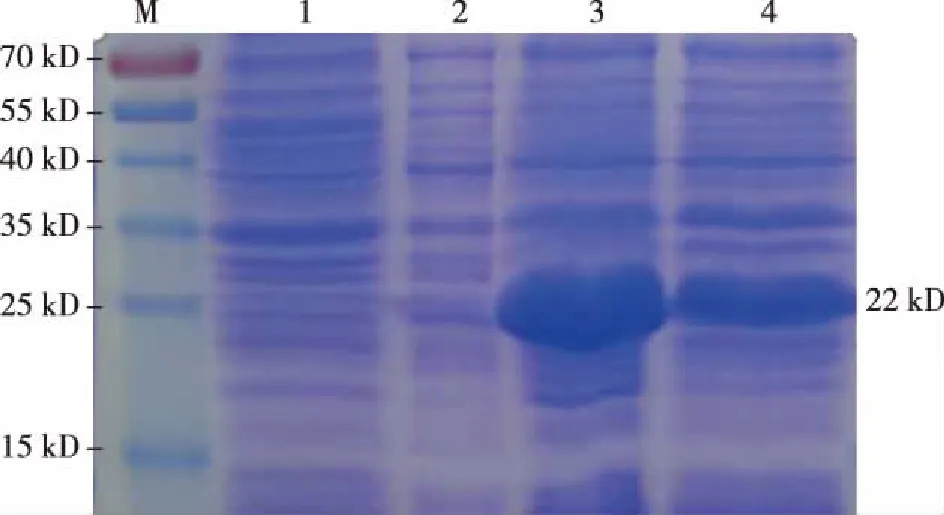
注:M为蛋白marker,1为BL21(DE3)菌株诱导表达作为阴性对照,2为pET-28a(+)-mFGF21的BL21DE3菌株未诱导,3、4为pET-28a(+)-mFGF21的BL21DE3菌株在0.2 mmol/L 浓度的IPTG诱导表达的蛋白产物图3 his-mFGF21融合蛋白诱导表达产物Fig.3 Induced expression product of his-mFGF21 fusion protein
2.3 融合蛋白his-mFGF21的纯化
取少量超声破碎的上清与超声破碎的菌体沉淀进行SDS-PAGE电泳,显示在22 kD处出现明显目的蛋白条带(如图4),证明经超声破碎菌体后的上清中存在大量融合蛋白his-mFGF21可溶性表达。对纯化后的his-mFGF21蛋白液、留样保存的漂洗液以及洗脱缓冲液采用 SDS-PAGE电泳,结果显示在22 kD处均有明显的目的蛋白(如图5),证明融合蛋白his-mFGF21纯化成功。

注:M为蛋白marker,1、2分别为诱导表达后超声破碎菌体后的上清液、沉淀液图4 融合蛋白his-mFGF21的可溶性分析Fig.4 Soluble analysis of fusion protein his-mFGF21
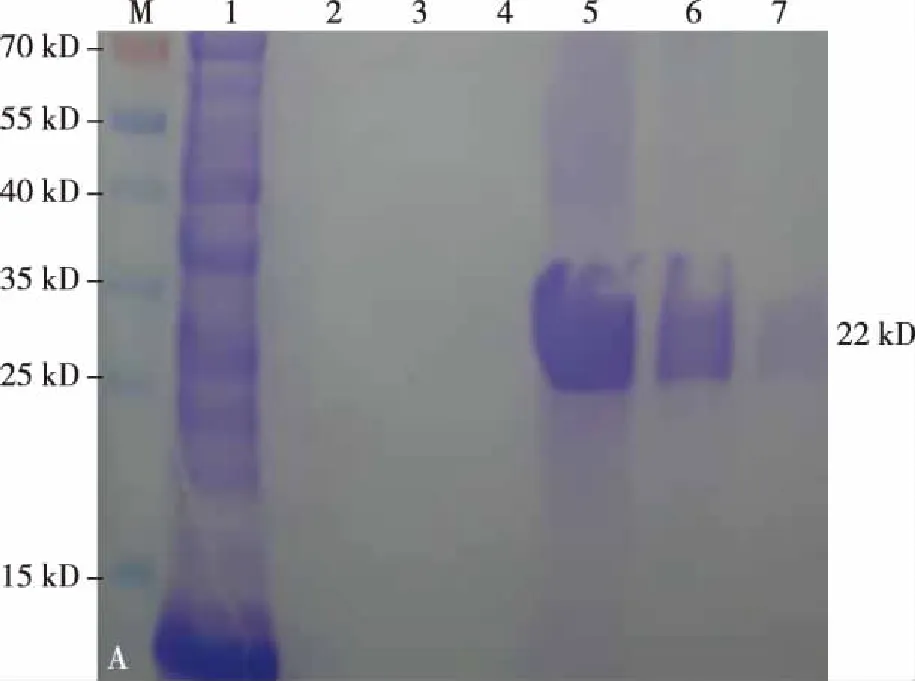
注:M为蛋白marker,1为超声破碎菌体的上清液结合凝胶离心后的蛋白溶液,2、3、4为融合蛋白溶液结合凝胶经第2次、第3次、第4次漂洗留取的漂洗液,5、6、7为第1次、第2次、第3次洗脱液洗脱的融合蛋白图5 纯化融合蛋白his-mFGF21检测Fig.5 Analysis of purified fusion protein his-mFGF21
2.4 Western Blot检测
取纯化后的his-mFGF21蛋白液进行SDS-PAGE凝胶电泳,采用免疫印迹法进行分析,显色后在22 kD左右有一特异性蛋白条带,如图6所示。

图6 Western Blot检测融合蛋白his-mFGF21Fig.6 Western Blot detection of fusion protein his-mFGF21
3 讨论
近年来,动脉粥样硬化发病率越来越高,已成为一种常见病,严重影响人类健康。大量证据表明,导致动脉粥样硬化的重要危险因素有高血糖、高脂血症、肥胖、高血压、吸烟、代谢紊乱、高纤维蛋白原血症、高半胱氨酸血症及慢性应激等[9]。此外,糖代谢异常是动脉粥样硬化的独立危险因素,动脉粥样硬化在T2DM 患者中的发生发展中与摄糖过多、胰岛素抵抗等有关[10-11]。除了糖代谢异常,脂质代谢紊乱、内皮细胞功能受损以及炎性反应等在动脉粥样硬化的病理过程中均起到很重要的作用[12]。
FGF21是2000年首次从小鼠胚胎组织中分离出来,小鼠FGF21由210个氨基酸组成,在多种组织中均有分布,主要表达在肝脏,少量表达在脂肪、性腺、骨骼肌、胰岛细胞、心脏[2,13]。在FGF家族中,其经典的家族成员可以通过肝素锚定直接与成纤维细胞生长因子受体(fibroblast growth factor receptors,FGFRs)结合,对细胞的分化与增殖进行调节。不同的是,FGF21、FGF19和FGF23这一亚家族无肝素锚定位点。FGF21在发挥代谢调节作用时,必须有βKlotho的协助,激活FGFR1后,形成FGF21/βKlotho/FGFR复合体后,FGFR发生二聚化、自身磷酸化,在下游多种分子作用下激活多种信号通路,启动Akt等多个信号系统共同发挥对代谢的调节作用[14]。研究发现,FGF21在不同状态下,作用不一,(1)在健康状态下发挥生理作用,不会对机体的正常代谢产生干扰;(2)在病理情况下发挥重要药理作用,FGF21在代谢异常的小鼠体内会促进解偶联蛋白1(uncoupling protein 1,UCP1)、葡萄糖转运蛋白1(glucose transporter protein 1,GLUT1)等的表达对糖、脂代谢进行调节;(3)当机体处于应激状态时,FGF21具有抵抗多种细胞凋亡的作用(如肝细胞、胰岛β细胞、心血管内皮细胞以及心肌细胞等)[15-18]。虽然FGF21在疾病初期发挥代偿作用,但随着疾病进展,特别是在代谢紊乱时可能有FGF21抵抗的存在,进而影响代谢综合征的发展[14]。有研究者认为,FGF21可能通过抵抗炎症反应、抗氧化应激作用、调节线粒体功能、调节热休克蛋白表达、调节心肌能量代谢和拮抗心肌细胞凋亡等机制进一步影响动脉粥样硬化等心血管疾病的发展过程[19-23]。
因FGF21是目前发现的FGFs家族中唯一无促有丝分裂活性作用的基因,当其作用于BalB/c 3T3、NIH 3T3和HMECS细胞后,均无促有丝分裂活性,故不存在致瘤的可能性,可以降低作为临床潜在药物的风险,因此具有活性的FGF21蛋白更是作为糖尿病的新型候选药物而备受关注[24]。
综上所述,FGF21 可能会成为糖尿病、代谢性疾病、心血管疾病以及肾脏疾病等的独立预测因子、生物标志物和治疗靶点[25-26]。本研究通过PCR 克隆将小鼠FGF21基因片段扩增后连接至pET-28a(+),对其重组子pET-28a(+)-mFGF21进行原核表达,经亲和层析后纯化,采用Western Blot进行鉴定证明成功获得了可溶性的小鼠FGF21的融合蛋白,且诱导表达效果理想。为进一步研究该融合蛋白的功能并应用于动脉粥样硬化及相关疾病的治疗作好了前期准备。
