镉对单环刺螠非特异性免疫及组织蓄积的影响
2019-06-10朱晓莹甘宏涛孟霄姚海洋徐国成1徐加涛刘统昊曹黎鑫许星鸿1
朱晓莹,甘宏涛,孟霄,姚海洋,徐国成1,,徐加涛,刘统昊,曹黎鑫,许星鸿1,,*
1. 江苏省海洋生物资源与环境重点实验室,淮海工学院,连云港 222005 2. 淮海工学院 海洋生命与水产学院,连云港 222005
重金属镉(Cd)是一种极易蓄积且半衰期长的有毒污染物,会对生物体的免疫和生殖系统造成损伤,还具有致癌、致畸等作用[1]。近年来随着工农业生产的发展,水环境中的Cd污染程度也日益严重,不但会影响水生生物的生理机能,还会通过食物链富集对人体健康构成威胁。单环刺螠(Urechisunicinctus)分布于黄、渤海泥沙岸潮间带及潮下带,其富含必需氨基酸、不饱和脂肪酸和微量元素,提取物有一定抗肿瘤和提高免疫力的作用,具有较高的经济价值和良好的开发利用前景[2]。目前对单环刺螠的研究主要集中于纤溶酶的分离纯化和溶栓作用,以及对硫化物的应激代谢等方面[3-4],而重金属对单环刺螠的毒性报道很少,仅见唐永政等[5]检测了3种重金属离子(Cu2+、Hg2+、Cd2+)对幼螠的急性毒性。本文研究了单环刺螠在不同质量浓度Cd胁迫下,其免疫相关指标及组织中Cd蓄积量的变化规律,旨在探讨Cd对单环刺螠的毒性效应,为养殖水质调控及海洋环境监测提供参考。
1 材料与方法(Materials and methods)
1.1 材料
实验用单环刺螠于2017年12月购自连云港市水产品市场,平均体长为(12.1±1.5) cm,平均体质量为(21.2±4.2) g,于实验室暂养7 d后进行实验。暂养条件为:盐度25,pH 8,水温(15±1) ℃,自然光照,连续充气,日投喂1次小球藻(Chlorellapacifica),藻液密度104mL-1,投喂量10 mL·L-1,实验所用海水均用曝气自来水和海水晶配制,经检测其Cd含量为0.001 mg·L-1,为实验用海水本底。选择大小相近、体表无损伤及活力强者用于实验。
1.2 实验设计
根据国家《渔业水质标准》(GB11607—1989)[6](Cd质量浓度≤0.005 mg·L-1)及海水中Cd通常的污染浓度[7],本实验Cd质量浓度设置为对照组0.005 mg·L-1、0.05 mg·L-1和0.5 mg·L-1,用氯化镉(分析纯,国药集团药业股份有限公司)配制的1 g·L-1原液调节各处理组Cd浓度。每组设3个平行,每个平行随机放40条单环刺螠,于50 cm×60 cm×60 cm养殖箱中饲养,养殖条件与暂养时相同,每日定时换水1次,每次换水50%,并维持各组氯化镉质量浓度。实验期间不喂食,以消除饵料的影响。于处理0、3、6、12、24、48、72和96 h,每组随机取3条单环刺螠,解剖取其血液,保留一部分全血用于测定血细胞密度,另一部分于4 ℃、12 000 r·min-1离心5 min,取上清液即血清,-80 ℃保存,用于测定免疫相关指标。于实验5、10、15 d,每组取3条单环刺螠,解剖取其肌肉和消化道,-80 ℃保存,用于检测组织中Cd蓄积量。
1.3 检测方法
免疫相关指标选用血细胞密度(density of hemocyte, DHC)、血清总蛋白含量,酚氧化酶(phenoloxidase, PO)、溶菌酶(lysozyme, LSZ)和超氧化物歧化酶(superoxide dismutase, SOD)活力,过氧化氢(H2O2)和丙二醛(malondialdehyde, MDA)含量。将抽取的一部分血液按1:1比例与柠檬酸葡萄糖(acid citrate dextrose, ACD)抗凝剂充分混匀,用血球计数板(上海市求精生化试剂仪器有限公司,规格为16×25格)计数,然后按照文献[8]计算血细胞密度。血清中总蛋白含量采用双缩脲试剂法,以牛血清蛋白为标准,用T6紫外分光光度计(北京普析通用仪器有限责任公司)于540 nm进行比色测定[9]。PO和LSZ活力分别采用Ashida[10]、Hultmark等[11]方法进行测定。SOD活力、过氧化氢(H2O2)和MDA含量分别参照南京建成生物工程研究所的H2O2和MDA测试盒说明进行测定。取肌肉和消化道2种组织经湿法消化(V(HNO3)∶V(HClO4)=2∶1),1% HNO3溶解,过滤,定容至25 mL,采用全谱直读电感耦合等离子体原子发射光谱仪(美国Thermo fisher iCAP 6300型,检出限为ppb级)测定Cd含量。
1.4 数据分析
实验数据以“平均数±标准差”表示,采用SPSS18.0软件进行单因子方差分析,LSD多重比较和Duncan检验,显著水平设为0.05。
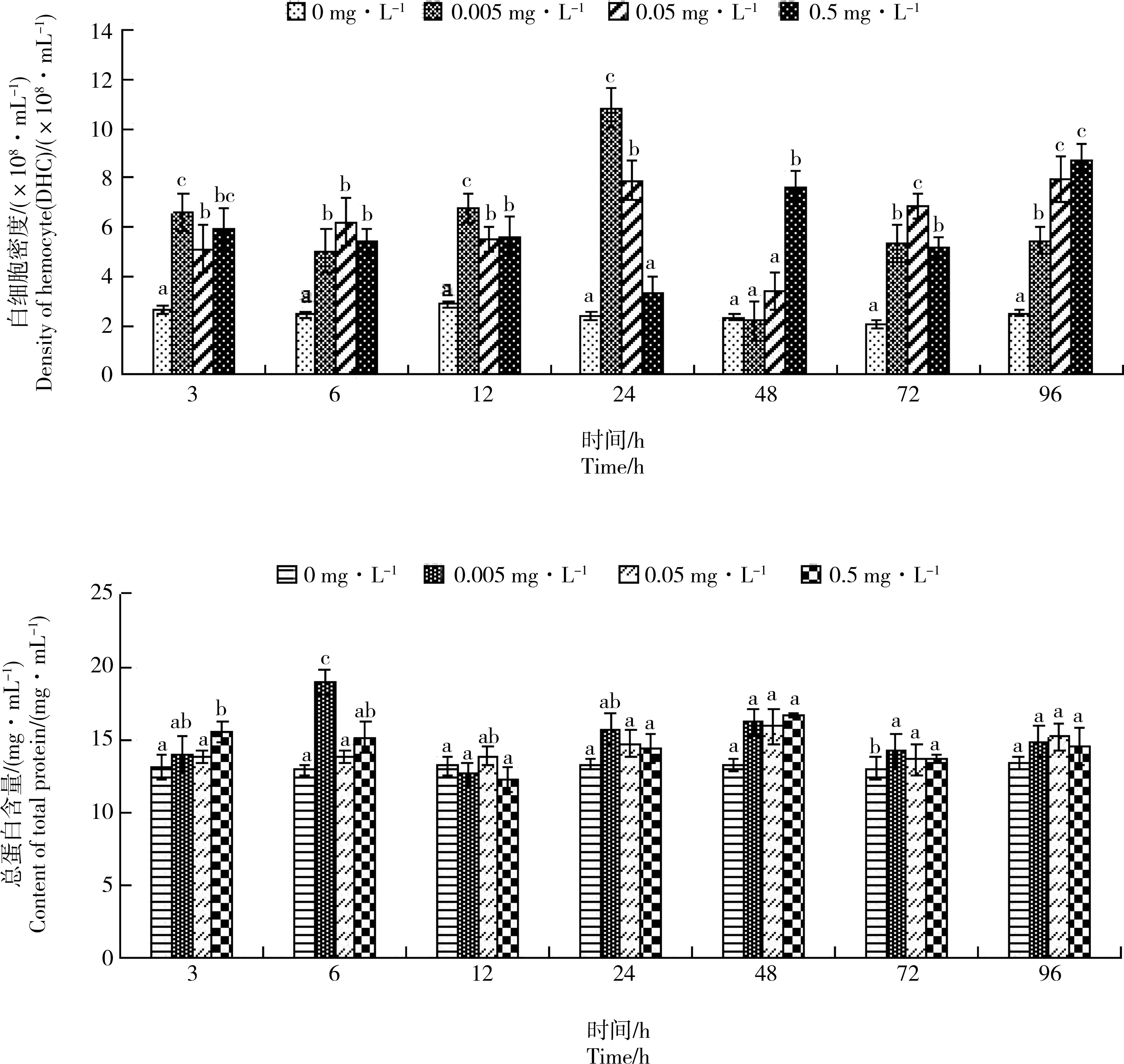
图1 Cd胁迫对单环刺螠血细胞密度(DHC)和血清总蛋白含量的影响注:上标不同小写字母的数值表示同一测试时间不同处理组间差异显著(P<0.05,余同)。Fig. 1 Effect of Cd stress on the density of hemocyte (DHC) and the total protein content in serum of Urechis unicinctusNote: The values of different lowercase letters in the superscript indicate that the differences between the groups are significant at the same test time (P<0.05, the same below).
2 结果(Results)
2.1 Cd胁迫对单环刺螠血细胞密度和血清总蛋白含量的影响
如图1所示,在Cd胁迫下,处理组血细胞密度(DHC)总体呈“先升后降再升”的趋势。处理3 h,处理组DHC均显著升高,以低浓度组DHC上升较快,在胁迫24 h时升至最大值。处理至96 h,处理组DHC均显著高于对照组(P<0.05),呈显著的时间-剂量-效应关系(P<0.05),而各实验组总蛋白含量变化不显著(P>0.05)。
2.2 Cd胁迫对单环刺螠血清中PO和LSZ活力的影响
从图2可以看出,各处理组PO活力总体呈先升后降的趋势。PO活力以较高胁迫浓度组(0.05 mg·L-1和0.5 mg·L-1)上升较快,于处理24 h且升高幅度较大。0.005 mg·L-1组于48 h达到最大值,随后逐渐下降。至处理96 h,0.05 mg·L-1和0.5 mg·L-1两组PO活力显著低于对照组和0.005 mg·L-1组(P<0.05);在实验期间,随胁迫时间延长,0.005 mg·L-1组PO活力没有明显时间-剂量-效应关系,而0.05 mg·L-1和0.5 mg·L-1两组PO活力在3~24 h内与胁迫时间和Cd质量浓度显著正相关(P<0.05),在24~96 h内为显著负相关(P<0.05)。
Cd胁迫下,LSZ活力呈先降后升再降的趋势。处理3 h,各处理组LSZ活力均出现显著下降,以较高胁迫浓度组(0.05 mg·L-1和0.5 mg·L-1)下降幅度较大,于处理6 h出现明显回升。随着胁迫时间延长,处理组LSZ活力在回升后又呈下降趋势。处理72 h后,各处理组LSZ活力均显著低于对照组(P<0.05),在实验期间,各处理组LSZ活力有波动,没有明显的时间-剂量-效应关系。
2.3 Cd胁迫对单环刺螠血清中SOD活力的影响
Cd胁迫对单环刺螠血清中SOD活力的影响如图3所示。随胁迫时间延长,各处理组SOD活力总体呈缓慢上升趋势,除处理3 h的0.005 mg·L-1组以外,其他各处理组SOD活力均高于对照组,且在实验期间,SOD活力与胁迫时间呈显著的时间-效应关系(P<0.05),而与Cd质量浓度没有显著的剂量-效应关系(P>0.05)。

图2 Cd胁迫对单环刺螠血清中酚氧化酶(PO)和溶菌酶(LSZ)活力的影响Fig. 2 Effect of cadmium stress on the activity of phenoloxidase (PO) and lysozyme (LSZ) in serum of Urechis unicinctus
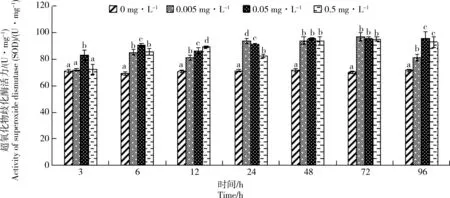
图3 Cd胁迫对单环刺螠血清中超氧化物歧化酶(SOD)活力的影响Fig. 3 Effect of cadmium stress on the activity of superoxide dismutase (SOD) in serum of Urechis unicinctus
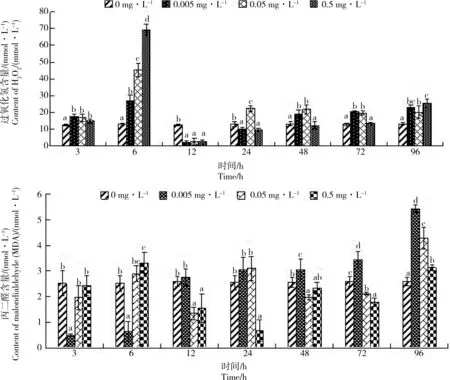
图4 Cd胁迫对单环刺螠血清中H2O2和丙二醛(MDA)含量的影响Fig. 4 Effect of cadmium stress on the content of H2O2 and malondialdehyde (MDA) in serum of Urechis unicinctus
2.4 Cd胁迫对单环刺螠血清中H2O2和MDA含量的影响
由图4可见,各处理组H2O2含量呈先升后降再升的趋势。H2O2含量于暴露6 h升到最大值,且存在显著的剂量-时间-效应关系;随后又快速下降,于12 h降至最低,均低于对照组,随后又逐渐上升。至96 h时,各处理组H2O2含量均高于对照组。Cd胁迫下,处理组MDA含量总体呈缓慢上升趋势,至96 h,各处理组MDA含量显著高于对照组(P<0.05),且在3~6 h内,MDA含量与胁迫时间和Cd质量浓度显著正相关(P<0.05),在72~96 h则显著负相关(P<0.05)。
2.5 Cd胁迫对单环刺螠组织蓄积的影响
如图5所示,随Cd暴露时间延长,各处理组单环刺螠体壁肌肉和消化道中Cd含量均呈上升趋势,且存在显著的剂量-浓度效应关系(P<0.05)。Cd在单环刺螠机体的蓄积具有组织特异性,消化道中的蓄积量显著多于体壁肌肉(P<0.05)。
3 讨论(Discussion)
3.1 Cd胁迫对单环刺螠非特异性免疫的影响
有研究表明环境变化会对血细胞数量产生显著影响,水生动物DHC常作为生物体免疫状态的衡量指标[12]。拟穴青蟹(Scyllaparamamo)在不同浓度(0.0025、0.05、0.075和0.1 mg·L-1) Cd胁迫后,短时间内DHC显著降低,表现出剂量-效应关系,胁迫至9 d后,较低浓度(0.0025和0.05 mg·L-1)处理组DHC恢复至对照组水平[13]。长臂虾(Palaemonelegans)经Cd暴露后8 h,其DHC显著下降,而后又逐渐升高[14]。本研究中,Cd胁迫96 h后,单环刺螠DHC各处理组均显著高于对照组,且存在一定的剂量-效应关系,与上述研究结果相近。表明生物体对Cd胁迫具有一定的适应性,在胁迫浓度较低时,对机体的毒害作用较小,较高胁迫浓度则会引起明显的应激反应,DHC显著变化,而且不同水生动物对Cd胁迫的响应存在差异。
Zahedi等[15]将波斯鲟(Acipenserpersicus)幼体暴露于0.68 mg·L-1的Cd中14 d,鱼体血清总蛋白含量无显著变化;将鲢鱼(Hypophthalmichthysmolitrix)置于0.01 mg·L-1的Cd中胁迫96 h,其血清总蛋白含量变化不明显[16],与本研究结果一致,表明Cd胁迫对机体血清总蛋白含量可能影响不大。
PO是水生无脊椎动物非特异性免疫防御系统中的重要成员[17]。秦圣娟等[18]报道,随着Cd浓度增大,长江华溪蟹(Sinopotamonyangtsekiense)血清中PO活力总体呈现先升后降的变化趋势,与本研究结果一致。表明PO对金属离子较为敏感,在机体受到环境中重金属离子的胁迫时,免疫系统中PO被诱导产生,以防御外界环境胁迫对机体的损伤。而在长时间的较高浓度Cd胁迫下,免疫机能受到影响,所以出现随暴露时间延长,PO活力逐渐下降的现象。

图5 Cd胁迫对单环刺螠肌肉和消化道中Cd蓄积量的影响Fig. 5 Effects of cadmium stress on the cadmium accumulation of the muscle and the digestive tract of Urechis unicinctus
LSZ是体液免疫中重要成分之一,Cd会和溶菌酶的活性位点直接结合,改变其结构和功能,且不同浓度的Cd与溶菌酶的结合能力不同,因而对酶活性也会有不同程度的影响[19]。李慧等[20]研究发现0.05和0.5 mg·L-1的Cd可引起鲤鱼(Cyprinuscarpio)血清中LSZ活力显著升高;王志和武二栓[21]研究表明鲤鱼血清中LSZ含量随Cd浓度增加而升高,且高浓度组显著高于对照组。本研究中,单环刺螠LSZ活力在Cd胁迫下总体呈先升后降的趋势,至胁迫72 h后,各处理组LSZ活力均显著低于对照组,表明Cd胁迫对单环刺螠的抗菌能力影响较大,不同生物体应对Cd胁迫的免疫机制亦不同。
3.2 Cd胁迫对单环刺螠抗氧化能力的影响

正常情况下,生物体内产生的H2O2等成分会被抗氧化系统中相关酶清除,维持机体正常的生命活动,而当机体受到环境因子胁迫时,其含量会发生变化。研究表明,Cd会抑制机体内抗氧化相关酶的活性,促使H2O2含量增加,诱发氧化损伤、细胞凋亡等过程[26]。Wang等[27]研究表明淡水蟹(Sinopotamonhenanense)在暴露于浓度为58 mg·L-1的Cd后,与对照组相比,鳃中H2O2含量在2~4 h显著增加,8 h后逐渐下降,处理24~48 h后再次增加。薛蓓等[28]发现脊尾白虾(Palaemoncarincauda)暴露于Cd后,0.005 mmol·L-1组在短时间内H2O2含量变化比其他处理组更明显,胁迫至24 h后,各实验组与对照组均不存在显著性差异。本研究中,各处理组H2O2含量于6 h时达到最大值,且差异显著;随后快速下降,于12 h降至最低,均低于对照组;96 h时,各处理组H2O2含量均高于对照组,且各处理组间差异不显著。表明单环刺螠在受到Cd短期胁迫后,其体内产生的大量H2O2得不到及时清除而积聚在体内,致使其含量迅速上升,Cd浓度越高,单环刺螠体内的H2O2含量相对越高;而随胁迫时间延长,各处理组的H2O2含量逐渐下降,是由于机体受到Cd胁迫后诱导体内的抗氧化系统产生相关酶,使体内过剩的H2O2被及时清除。
MDA是由自由基与生物膜中的脂类形成的过氧化产物,可通过MDA的含量反映膜脂过氧化程度及膜系统的受损程度。0.005 mmol·L-1浓度的Cd暴露后,脊尾白虾MDA含量快速上升,于9 h时达到最大值,且显著高于对照组及其他各处理组,随后又逐渐下降,而较低浓度(0.001和0.002 mmol·L-1)组MDA的含量变化则相对缓慢[28]。本研究中,0.005和0.05 mg·L-1浓度组MDA含量总体呈缓慢上升趋势,而0.5 mg·L-1浓度组则先升高后降低。这与上述研究结果相似。这可能是单环刺螠在短时间内受到较高浓度Cd胁迫后,机体内产生过多的自由基成分未及时清除而使脂质过氧化过程加剧,MDA含量增加;随胁迫时间的延长,单环刺螠体内诱导产生了抗氧化相关酶,清除了机体内过剩的自由基成分,MDA含量相应下降。
综上所述,Cd胁迫会刺激机体产生自由基和H2O2等成分,进入体内的Cd首先可能通过诱导合成大量非特异性免疫机制中的PO、LSZ等一些酶类以及金属硫蛋白基因的大量表达,进行结合进入体内多余的Cd2+,起到暂时解毒的作用,其次会诱导抗氧化机制中的SOD等抗氧化酶成分,用于清除体内过剩的氧自由基、H2O2等成分,H2O2含量则会快速下降;当胁迫时间过长时,体内进入过多的Cd,超出了免疫系统中的酶类可以结合的上限,多余的Cd会持续刺激机体产生大量氧自由基、H2O2等成分,与生物膜中的脂类形成的过氧化产物MDA,故MDA会持续增加。因此MDA含量可作为单环刺螠在Cd环境中长期胁迫后的免疫检测指标。
3.3 Cd胁迫对单环刺螠组织蓄积的影响
相关研究表明,水生生物对重金属Cd的蓄积具有组织特异性[29-30]。于淑池等[31]报道波纹巴非蛤(Paphiaundulata)于安全浓度下(0.02767 mg·L-1)下胁迫120 h,其体内Cd的蓄积量水平依次为内脏团>鳃>肌肉;Charan-Dixon等[32]用质量浓度分别为15 μg·L-1、765 μg·L-1的Cd胁迫海参(Australostichopusmollis),结果表明其呼吸肠中Cd的蓄积量高于体壁肌肉;张林宝等[25]研究表明菲律宾蛤仔肝胰腺与鳃的Cd蓄积量随Cd浓度与暴露时间的增加而增大。本实验中,单环刺螠用不同质量浓度(0.005、0.05和0.5 mg·L-1)的Cd胁迫5 d、10 d、15 d后,其消化道Cd的蓄积量显著高于肌肉,且呈现明显的浓度效应和时间效应,与上述报道的结果一致。这可能是因为单环刺螠不同组织对重金属的吸收、代谢及调节能力不同,可直接通过摄食经消化道吸收水体或残留在饵料中的重金属,因而消化道内Cd含量高于肌肉。
