反相液相色谱-电喷雾-离子阱-飞行时间质谱法定量分析N-非取代肝素/硫酸乙酰肝素
2019-06-10杜佳燕黄海月苏晓明
杜佳燕,黄海月,苏晓明,魏 峥
(1.福州大学化学学院,福建 福州 350002;2.福州大学化肥催化剂国家工程研究中心糖生化研究所,福建 福州 350002)
肝素(heparin, HP)和硫酸乙酰肝素(heparan sulfate, HS) 是带有负电荷的线性糖胺聚糖,参与了众多生物活动过程,如血管形成、血液凝固、细胞粘附及增生和肿瘤转移等[1-6]。它们的结构是影响糖胺聚糖与蛋白质结合的关键因素[7-9],它们与蛋白质的相互作用与其生物功能息息相关。肝素和硫酸乙酰肝素均由重复的二糖单元组成,二糖单元是由己糖醛酸(hexuronic acid, HexA)和葡萄糖胺(glucosamine, GlcN)以1-4糖苷键连接而成,含有较多的N-硫酸化葡萄糖胺(N-sulfated Glucosamine, GlcNS)、N-乙酰化葡萄糖胺(N-acetylated, GlcNAc)和较少的N-非取代葡萄糖胺(N-unsubstituted glucosamine, GlcNH3+)残基。其中,己糖醛酸以葡糖醛酸和艾杜糖醛酸两种差向异构体形式存在,具有C-2位氧硫酸化。葡萄糖胺上的修饰方式具有C-6位氧硫酸化、N位硫酸化、N位乙酰化以及罕见的N位非取代和C-3位氧硫酸化[10-11]。在肝素/硫酸乙酰肝素的生物合成途径中,葡糖醛酸和N-乙酰化葡萄糖胺首先以1-4糖苷键交替连接的方式合成无硫酸化的前体[12-14],该前体中的N-乙酰化葡萄糖胺残基在N-脱乙酰/N-磺基转移酶的作用下生成N-非取代葡萄糖胺中间体,然后该中间体发生N-硫酸化修饰,生成N-硫酸化葡萄糖胺。随后发生的修饰主要有葡糖醛酸的C-5位差向异构化与C-2位氧硫酸化,N-硫酸化葡萄糖胺的C-6位与C-3位氧硫酸化和N-乙酰化葡萄糖胺的C-6位氧硫酸化。多种修饰作用模式和不同修饰程度的组合,导致肝素/硫酸乙酰肝素的结构具有多样性且高度复杂。
在N-脱乙酰化和随后的N-硫酸化过程中,N-脱乙酰/N-磺基转移酶的活性受到限制,产生含量较低的N-非取代葡萄糖胺。在不同来源的生物体中,N-非取代葡萄糖胺的含量存在差异。除了在牛肾硫酸乙酰肝素中,N-非取代葡萄糖胺的含量高达12%[11]外,在其他硫酸乙酰肝素中其含量都普遍较低,通常占0.2%~4%[15-18]。虽然N-非取代葡萄糖胺在硫酸乙酰肝素中的含量较低,但其与一些重要的细胞生物学和病理生理学现象关系紧密[12,19,20-22]。 Hering等[3]研究表明,N-非取代葡萄糖胺残基可能影响到生物体对损伤组织的再生应答。在肿瘤发生和转移的相关研究领域中,N-非取代葡萄糖胺残基同样引起了极大关注。有报道[23]指出,乳腺癌细胞中存在含高浓度N-非取代葡萄糖胺残基的硫酸乙酰肝素,抑制了乙酰肝素酶的活性。利用人工化学合成含有N-非取代葡萄糖胺残基的四糖进行体外实验,发现可以通过抑制乙酰肝素酶的活性从而抑制乳腺癌细胞的转移。因此,通过建立和表征含N-非取代葡萄糖胺残基的糖库[24-26],可以为阐明含N-非取代葡萄糖胺残基的糖胺聚糖与蛋白质间的相互作用提供重要的体外实验来源。但由于其含量少,检测难度大,N-非取代葡萄糖胺残基的组分分析和结构表征仍然是一个难题。在天然的肝素/硫酸乙酰肝素或人工合成的衍生物中,构建N-非取代葡萄糖胺残基的分离和分析方法都具有极大挑战和重要意义,是更好地理解N-非取代葡萄糖胺残基生物功能的基础。
分析肝素和硫酸乙酰肝素的组分含量时,通常使用肝素裂解酶酶解产生12种肝素/硫酸乙酰肝素二糖,再对二糖进行分析测定。目前,分析肝素/硫酸乙酰肝素二糖的方法主要有高效液相色谱法[11]、毛细管电泳法[27]、凝胶色谱法[28]和液相色谱-质谱联用法等。其中,液相色谱-质谱联用法使用的液相色谱包括排阻色谱[20,29]、亲水作用色谱[30-31]和反相离子对色谱[32-34]等。另外,可利用2-氨基吖啶酮(2-aminoacridone, AMAC)与肝素/硫酸乙酰肝素二糖的还原胺化反应,结合反相液相色谱-质谱联用技术分析肝素/硫酸乙酰肝素二糖[35-38]。
本研究基于反相液相色谱-电喷雾-离子阱-飞行时间质谱法(RP-LC-ESI-IT-TOF MS),拟采用AMAC标记二糖,建立高分辨、高重现性的定性和定量体系来分析12种不同的肝素/硫酸乙酰肝素二糖,其中包括4种低含量的N-非取代二糖。希望能够更好地理解N-非取代葡萄糖胺残基的生理和病理作用。
1 实验部分
1.1 主要仪器与装置
液相色谱-电喷雾-离子阱-飞行时间质谱仪:日本岛津公司产品,配有LC-20AD 二元泵、DGU-20A3R 脱气装置、SIL-20AC 自动进样器、CBM-20A 基本通信模块、PDA 光敏检测器、CTO-20A 柱温箱、SPD-M20A 二极管阵列检测器;CT02-50SR型恒温真空冷冻浓缩仪:德国Christ公司产品;ODS-2 HYPERSIL C18色谱柱(5 μm×250 mm×4.6 mm):美国Thermo公司产品。
1.2 主要材料与试剂
肝素钠:中国国药集团化学试剂有限公司产品;12种肝素/硫酸类肝素标准二糖(ΔHexA(2S)-GlcNAc(6S)、ΔHexA-GlcNAc(6S)、ΔHexA(2S)-GlcNAc、ΔHexA-GlcNAc、ΔHexA(2S)-GlcNS(6S)、ΔHexA-GlcNS(6S)、ΔHexA(2S)-GlcNS、ΔHexA-GlcNS、ΔHexA(2S)-GlcNH3+(6S)、ΔHexA-GlcNH3+(6S)、ΔHexA(2S)-GlcNH3+、ΔHexA-GlcNH3+):英国Iduron公司产品;肝素裂解酶Ⅰ(肝素酶EC4.2.2.7)、肝素裂解酶Ⅱ(无EC号)、肝素裂解酶Ⅲ (肝素酶EC4.2.2.8):中国北京ADHOC公司产品;乙酸铵、2-氨基吖啶酮、氰基硼氢化钠、乙酸:美国Sigma-Aldrich公司产品;甲醇(色谱纯):美国J. T. Baker公司产品;其他试剂均为国产分析纯。
1.3 实验方法
1.3.1含N-非取代葡萄糖胺残基的肝素衍生物的制备 本实验选择3种含N-非取代葡萄糖胺残基的肝素衍生物,制备方法参照文献[26-27],简述如下:1) 将肝素钠溶液通过H型阳离子交换树脂,收集流出液,用吡啶中和后,冷冻干燥得肝素吡啶。将肝素吡啶溶于一定比例的二甲亚砜中,反应液透析后冷冻干燥得脱N-硫酸化肝素(2S,6S,NH3+-HP);2) 将肝素吡啶溶于一定比例的1-甲基-2吡咯烷酮中反应,用NaOH溶液调至pH 8~9后进行透析,反应液冷冻干燥得脱6,N-硫酸化肝素(2S,NH3+-HP);3)将脱6,N-硫酸化肝素(2S,NH3+-HP)溶于NaOH溶液中反应,用乙酸中和,透析后冷冻干燥得全脱2,6,N-硫酸化肝素(NH3+-HP)。
1.3.2肝素衍生物的肝素酶酶解 取20 μg脱2,6,N-硫酸化肝素溶于30 μL 0.1 mol/L的乙酸钠缓冲溶液(含0.1 mmol/L乙酸钙,pH 7.0)中,加入肝素裂解酶Ⅰ、肝素裂解酶Ⅱ和肝素裂解酶Ⅲ各5 mIU,于37 ℃酶解24 h,于100 ℃水浴2 min终止反应。以10 000 r/min离心10 min,取上清液,浓缩至干。脱6,N-硫酸化肝素和脱N-硫酸化肝素均采用上述步骤操作,得到浓缩干燥的酶解产物。
1.3.3肝素二糖的AMAC标记和标准溶液的配制 称取12种标准肝素/硫酸类肝素二糖各5 μg,混合均匀,加入10 μL 0.1 mol/L的AMAC溶液(AMAC溶解于乙酸-二甲亚砜(V/V,3∶17)),涡旋振荡20 min。在上述反应溶液中加入10 μL 1.0 mol/L的氰基硼氢化钠溶液,于45 ℃反应4 h[39]。最后,用50%二甲亚砜将上述AMAC标记的二糖混合物稀释,分别配制成浓度为20、22、25、30、40 mg/L的系列混合标准溶液,用于建立液相色谱-质谱分析的标准曲线。
肝素衍生物的AMAC标记:采用上述标准肝素/硫酸类肝素二糖的AMAC标记方法对肝素衍生物的干燥样品进行标记,最后用50%二甲亚砜将AMAC标记后的肝素衍生物混合液的浓度稀释到0.4 mg/L,用于后续的液相色谱-质谱分析。
1.3.4RP-LC-ESI-IT-TOF MS分析 色谱条件:ODS-2 HYPERSIL C18色谱柱(5 μm×250 mm×4.6 mm);流动相:A 为乙酸铵溶液(20、40、60、80 mmol/L,pH 5.6),B为甲醇;线性梯度洗脱程序:0~100 min(2%~20%B),100~120 min(20%~50%B);流速0.3 mL/min;柱温45 ℃;进样量10 μL。
质谱条件:电喷雾离子源(ESI)负离子模式;喷雾电压-3.5 kV;雾化气(氮气)流速1.50 mL/min;质量扫描范围m/z200~1 000;检测器电压1.8 kV;加热模块(BH)和曲形脱溶剂管(CDL)温度200 ℃。
标准曲线的建立:测定上述AMAC标记后的肝素/硫酸类肝素二糖混合物的系列混合标准溶液,以AMAC标记后各二糖的母离子响应峰面积(y)对进样的肝素/硫酸类肝素二糖质量(x)绘制标准曲线。
2 结果与讨论
2.1 分离AMAC标记的肝素/硫酸类肝素二糖的RPLC-MS-IT TOF方法
据文献报道,Acquity UPLC BEH C18柱[35]和ODS-2 HYPERSIL C18柱[38]已经成功用于定量分析heparin/HS中含量较高的N-取代二糖。Galeotti等[37]和Antia等[38]建立了分析12种肝素/硫酸类肝素二糖的方法,但由于N-非取代二糖与其他二糖的保留时间过于接近,该方法无法实现12种肝素/硫酸类肝素二糖的基线分离。
12种AMAC标记的肝素/硫酸类肝素标准二糖的详细信息列于表1。本研究选择多种反向柱,分别对其进行分离分析,结果表明,使用ODS-2 HYPERSIL C18柱分析二糖时,既能够对8种常规二糖(N-硫酸化二糖和N-乙酰化二糖)实现基线分离,也可以对另外4种N-非取代二糖达到基线分离。因此选择ODS-2 HYPERSIL C18柱进行下一步实验。

表1 肝素/硫酸类肝素二糖的结构和AMAC标记后的相对分子质量Table 1 Structures of heparin/HS disaccharides and relative molecular mass of AMAC-labeled disaccharides
首先,分别使用20、40、60和80 mmol/L的乙酸铵溶液(pH 5.6)作为分离检测的流动相体系,考察乙酸铵浓度对12种肝素/硫酸类肝素二糖分离效率的影响,结果示于图1。结果表明,当乙酸铵浓度为20 mmol/L时,ΔHexA(2S)-GlcNH3+(6S)和ΔHexA(2S)-GlcNAc(6S)、ΔHexA-GlcNH3+(6S)和ΔHexA-GlcNAc(6S)、ΔHexA(2S)-GlcNH3+和ΔHexA(2S)-GlcNAc这3对含有相同亚硫酸根个数的二糖在提取离子流色谱图中的出峰位置基本一致,糖峰重叠,无法分开。当乙酸铵浓度为40 mmol/L时,12种二糖都能实现基线分离,且峰形较窄,分离效果良好。与图1a相比,其保留时间明显增加。在N-硫酸化二糖中,首先被洗脱出来的二糖为ΔHexA(2S)-GlcNS(6S),然后为含有2个亚硫酸根的ΔHexA-GlcNS(6S)与ΔHexA(2S)-GlcNS,最后为ΔHexA-GlcNS。这可能是因为ΔHexA(2S)-GlcNS(6S)的疏水性最弱[38]。同样,在N-乙酰化和N-非取代二糖中,首先被洗脱出来的分别是ΔHexA(2S)-GlcNAc(6S)和ΔHexA(2S)-GlcNH3+(6S)。当流动相A中乙酸铵溶液浓度进一步提高时,分离效果和保留时间几乎不受影响(图1c和1d)。在质谱分析过程中,使用的流动相盐浓度越低,对质谱的损伤越小。因此,在保证12种肝素/硫酸类肝素二糖具有良好分离效果的情况下,选择40 mmol/L作为乙酸铵的最佳分离浓度,尽可能降低对仪器的损伤。
基于该分离方法实现了12种二糖的基线分离,不仅可以在液相色谱-质谱联用中使用各二糖各自的m/z分离和分析AMAC标记的肝素/硫酸类肝素二糖,还可以在常规液相色谱中利用二糖特征的紫外吸收检测或AMAC的荧光吸收检测完成定性分析。

注:图a、b、c、d中流动相A中乙酸铵的浓度分别为20、40、60和80 mmol/L;1.ΔHexA(2S)-GlcNS(6S);2.ΔHexA-GlcNS(6S);3.ΔHexA(2S)-GlcNS;6.ΔHexA(2S)-GlcNAc(6S);7.ΔHexA-GlcNH3+(6S);8.ΔHexA-GlcNAc(6S);9.ΔHexA(2S)-GlcNH3+;10.ΔHexA(2S)-GlcNAc;11.ΔHexA-GlcNH3+;12.ΔHexA-GlcNAc;含有2个或3个亚硫酸基团的二糖峰下有重叠峰,为质谱离子源上的亚硫酸根丢失 图1 乙酸铵浓度对肝素/硫酸类肝素二糖在色谱分离中的影响Fig.1 Influence of the concentration of ammonium acetate on the LC separation of heparin/HS disaccharides
检测器电压、加热模块和曲形脱溶剂管温度在AMAC标记的肝素/硫酸类肝素二糖的检测灵敏度上也起着关键性作用。因此,实验对这些参数进行了系列调控。结果表明,检测电压过低会导致二糖的灵敏度下降。当电压为1.6 kV时,无法检测到ΔHexA(2S)-GlcNS(6S)二糖;当电压为1.7 kV时,ΔHexA(2S)-GlcNS(6S)的检测灵敏度只有电压为1.8 kV时的8%。经实验优化,选择1.8 kV为最佳检测电压。此外,加热模块和曲形脱溶剂管温度升高,二糖的检测灵敏度也会提高。当温度从100 ℃提高至200 ℃时,二糖在质谱中的检测灵敏度提高了81%~100%。因此,在后续分析AMAC标记的肝素/硫酸类肝素二糖的实验中,选择检测电压为1.8 kV,加热模块和曲形脱溶剂管的温度为200 ℃。
上述质谱分析中,均采用负离子模式,每种N-非取代二糖的质谱图示于图2。由图2可见,ΔHexA-GlcNH3+二糖产生碎片离子m/z530.18;ΔHexA(2S)-GlcNH3+和ΔHexA-GlcNH3+(6S)属于同分异构体,均出现了碎片离子m/z610.13;ΔHexA(2S)-GlcNH3+(6S)产生了碎片离子m/z690.08,在m/z610.130处的小峰可能是含有单个亚硫酸根的N-非取代二糖(ΔHexA(2S)-GlcNH3+或ΔHexA-GlcNH3+(6S)),这是由于ΔHexA(2S)-GlcNH3+(6S)在MS离子源中脱掉1个亚硫酸根所致。

注:a.ΔHexA-GlcNH3+;b.ΔHexA(2S)-GlcNH3+;c.ΔHexA-GlcNH3+(6S);d.ΔHexA(2S)-GlcNH3+(6S);这些二糖分别对应图1b中的11、9、7、5二糖峰图2 AMAC标记的N-非取代硫酸类肝素二糖的质谱图Fig.2 Mass spectra of AMAC-labeled N-unsubstituted HS disaccharides
2.2 肝素/硫酸类肝素标准二糖的定量分析
每个二糖在质谱中具有不同的离子化效率,含有2个或3个亚硫酸根的二糖,在MS离子源中会丢失亚硫酸根。因此,为了校正每个二糖的离子化效率和在质谱离子源上由亚硫酸根丢失引起的质量偏差,采用2.1节中优化的RP-LC-ESI-IT-TOF MS分析方法对AMAC标记后的肝素/硫酸类肝素二糖混合物的系列混合标准溶液进行分析。以AMAC标记后的肝素/硫酸类肝素二糖各自的母离子响应峰面积(y)对相应的质量(x,200~400 ng)做线性回归,标准曲线示于图3,线性方程和相关系数列于表2。从表2的相关系数R2可以发现,除ΔHexA-GlcNS(6S)、ΔHexA(2S)-GlcNS和ΔHexA-GlcNH3+的R2为0.98以外,其余二糖的R2均不小于0.99,呈现良好的线性关系。以10倍信噪比S/N确定定量限,ΔHexA(2S)-GlcNS(6S)的定量限为170 ng,ΔHexA(2S)-GlcNH3+和ΔHexA-GlcNH3+的定量限为50 ng,其余二糖的定量限均小于50 ng。

注:a.N-硫酸化二糖;b.N-乙酰化二糖;c.N-非取代二糖;各二糖序号标识同图1图3 AMAC标记的12种二糖的标准曲线Fig.3 Curves of 12 AMAC-labeled disaccharides

肝素/硫酸类肝素二糖Heparin/Heparansulfate disaccharides线性方程Linearequations相关系数Correlationcoefficients(R2)ΔHexA(2S)-GlcNS(6S)y=0.031x-4.9970.990ΔHexA-GlcNS(6S)y=0.322x+1.7420.983ΔHexA(2S)-GlcNSy=0.352x-9.4850.986ΔHexA-GlcNSy=0.750x-17.6580.992ΔHexA(2S)-GlcNAc(6S)y=0.192x-6.5390.992ΔHexA-GlcNAc(6S)y=1.008x-28.9200.990ΔHexA(2S)-GlcNAcy=1.654x-144.1520.992ΔHex-GlcNAcy=2.715x-178.1060.993ΔHexA(2S)-GlcNH3+(6S)y=0.072x-9.5490.999ΔHexA-GlcNH3+(6S)y=0.160x-7.2670.998ΔHexA(2S)-GlcNH3+y=0.108x-8.0270.997ΔHexA-GlcNH3+y=0.219x-7.7170.983
为评估该方法的准确度和精密度,采用已知组分的AMAC标记的二糖混合物进行验证。结合各二糖的线性方程,通过3组平行实验重复测量得到各二糖的含量,列于表3。结果表明,利用本方法得到的混合物中每种二糖的组分含量与实际组分含量基本一致。因此,对含有N-非取代二糖的肝素/硫酸类肝素二糖组分进行定性和相对定量分析时,采用AMAC标记与RPLC-MS-IT-TOF MS相结合的方法具有高分辨、高重现性。
2.3 肝素衍生物样品的二糖分析
含N-非取代葡萄糖胺残基的硫酸类肝素具有多种生化功能,特别是其抗肿瘤活性的研究越来越受到关注[23]。因此,在天然的肝素/硫酸类肝素或人工合成的衍生物中,定性与定量检测N-非取代二糖均具有重要意义。本实验室已制备出多种N-非取代肝素衍生物,选择脱N-硫酸化肝素(2S,6S,NH3+-HP)、脱6,N-硫酸化肝素(2S,NH3+-HP)和全脱2,6,N-硫酸化肝素(NH3+-HP)作为测试样品,采用本研究建立的分析方法对以上3种测试样品的N-非取代二糖组分进行定性和相对定量分析。每种N-非取代肝素衍生物均取两份进行平行实验,用肝素裂解酶Ⅰ、Ⅱ和Ⅲ的混合物完全酶解后进行AMAC标记,然后进行RPLC-MS-IT-TOF MS分析。三种N-非取代肝素衍生物的提取离子流色谱图示于图4。通过表2的线性方程计算得到样品中每个二糖的组分含量,列于表4。

表3 已知组分的AMAC标记的二糖混合物的相对定量分析Table 3 Relative quantification analysis of AMAC-labeled disaccharide mixtures containing known composition of disaccharides
市售肝素样品中只含有4种N-硫酸化二糖和4种N-乙酰化二糖。在本实验选取的3种N-非取代肝素衍生物中,检测到4种N-乙酰化二糖(ΔHexA(2S)-GlcNAc(6S)、ΔHexA-GlcNAc(6S)、ΔHexA(2S)-GlcNAc和ΔHexA-GlcNAc和4种N-非取代二糖(ΔHexA(2S)-GlcNH3+(6S)、ΔHexA-GlcNH3+(6S)、ΔHexA(2S)-GlcNH3+和ΔHexA-GlcNH3+),但是没有检测到 ΔHexA(2S)-GlcNS(6S)、ΔHexA-GlcNS(6S)、ΔHexA(2S)-GlcNS和ΔHexA-GlcNS这几种N-硫酸化二糖。表明利用各种脱硫酸化反应已成功将N-硫酸化基团转化为N-非取代基团。

注:a.全脱2,6,N-硫酸化肝素(NH3+-HP);b.脱6,N-硫酸化肝素(2S,NH3+-HP);c.脱N-硫酸化肝素(2S,6S,NH3+-HP) ;二糖序号标识同图1图4 AMAC标记的N-非取代肝素衍生物二糖的提取离子流色谱图Fig.4 Extracted ion chromatograms of AMAC-labeled disaccharides of N-unsubstituted heparin-derivative
在脱N-硫酸化肝素(2S,6S,NH3+-HP)中含量最丰富的二糖为ΔHexA(2S)-GlcNH3+(6S),占二糖总量的39.70%;其余3种N-非取代二糖ΔHexA-GlcNH3+(6S)、ΔHexA(2S)-GlcNH3+和ΔHexA-GlcNH3+的组分含量分别为14.91%、9.98%和3.80%。4种N-非取代二糖的组分差异较大。脱6,N-硫酸化肝素(2S,NH3+-HP)中ΔHexA(2S)-GlcNH3+占总糖量的41.90%,ΔHexA-GlcNH3+为19.28%,ΔHexA-GlcNH3+(6S)为6.24%,没有检测到ΔHexA(2S)-GlcNH3+(6S)。全脱2,6,N-硫酸化肝素(NH3+-HP)中最丰富的二糖是ΔHexA-GlcNH3+,占二糖总量的42.50%。脱N-硫酸化肝素(2S,6S,NH3+-HP)、脱6,N-硫酸化肝素(2S,NH3+-HP)和全脱2,6,N-硫酸化肝素(NH3+-HP)中N-非取代二糖的总产率分别高达60.51%、67.43%和68.39%。
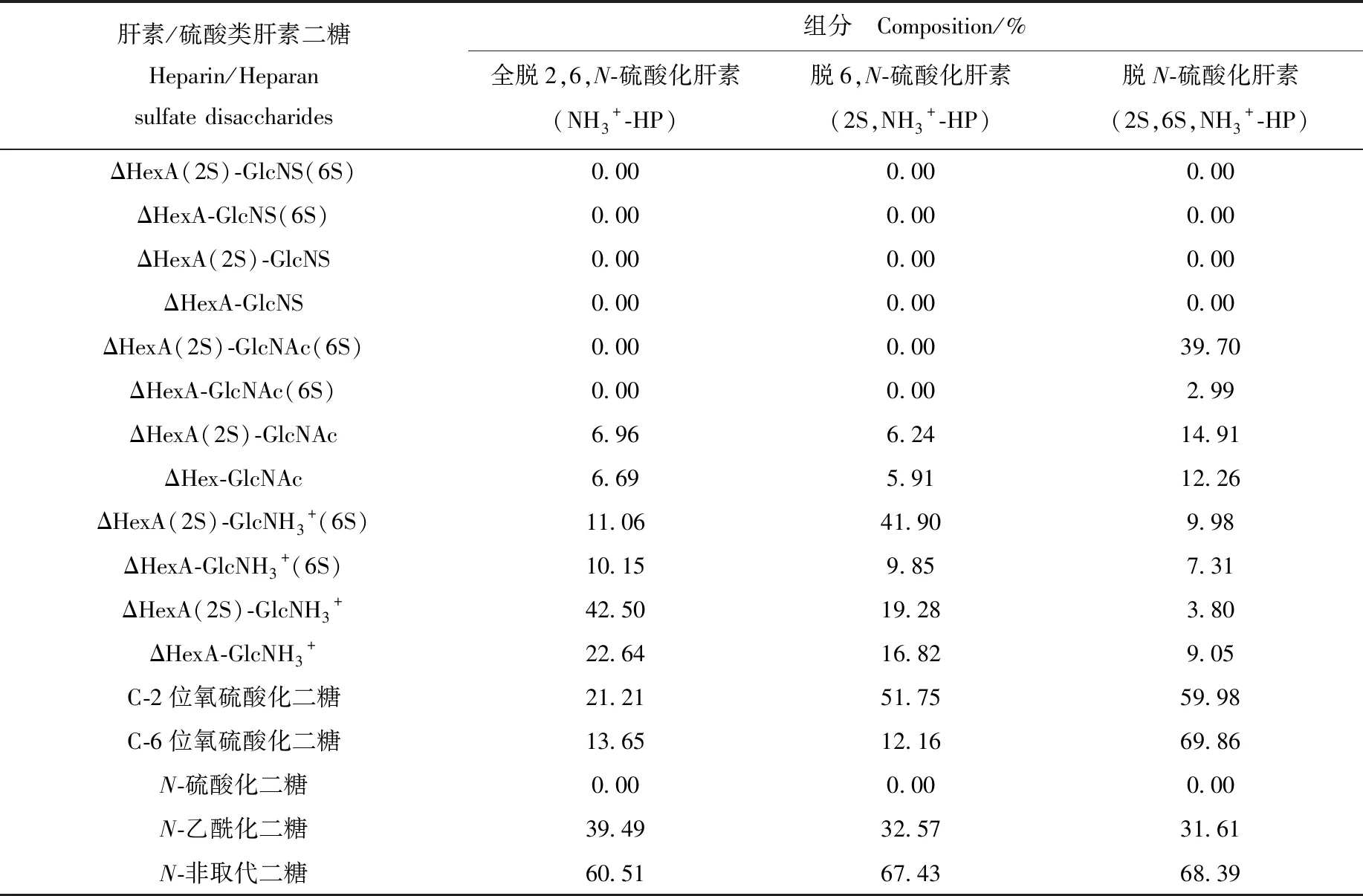
表4 3种N-非取代肝素衍生物的二糖组分分析Table 4 Disaccharide composition analysis of 3 N-unsubstituted heparin-derivative
以上结果表明,该方法适用于分析N-非取代二糖存在较大差异的人工合成的肝素衍生物。
3 结论
本研究将AMAC标记与RPLC-MS-IT-TOF MS结合,为肝素/硫酸类肝素二糖分析提供了良好的分离和相对定量效果,能够实现在同一系统内分离和分析12种肝素/硫酸类肝素二糖,尤其适用于分析少量N-非取代二糖。在肝素衍生物中,不同的N-非取代二糖的含量明显不同。该方法可以定性、定量分析生物样品中含有的N-非取代葡萄糖胺的二糖,为进一步研究N-非取代葡萄糖胺的结构与功能提供了可行的检测方法,有助于更好地理解N-非取代葡萄糖胺残基在人类健康与疾病管理中的重要作用。
