不同处理方式对土壤酶活性的影响
2019-06-07刘宇彤霍璐阳李志国刘晴董爱荣
刘宇彤 霍璐阳 李志国 刘晴 董爱荣

摘要:本文分别采用靛酚蓝比色法、3.5-二硝基水杨酸法、高锰酸钾滴定的方法,探究在土壤中种植大豆、加入粘质沙雷氏菌和咪唑乙烟酸及三者相互作用对土壤脲酶、蔗糖酶、过氧化氢酶活性的影响。结果表明:在土壤中种植大豆后,土壤脲酶、蔗糖酶和过氧化氢酶活性在培养10~30 d中均呈现激活趋势;在土壤中加入粘质沙雷氏菌,5~20 d中,土壤脲酶、蔗糖酶活性均呈现激活趋势,粘质沙雷氏菌使土壤过氧化氢酶活性显著增加;在土壤中加入100 mg/kg浓度的咪唑乙烟酸,土壤脲酶呈现恢复—抑制的趋势,土壤蔗糖酶活性在10 d时开始激活,30 d时呈现抑制状态,过氧化氢酶活性在10 d和30 d时均有激活趋势;在土壤中种植大豆、加入粘质沙雷氏菌,再加入100 mg/kg的咪唑乙烟酸,土壤脲酶呈现抑制—恢复—抑制的趋势,土壤蔗糖酶活性呈现激活—恢复—抑制—激活的趋势,土壤过氧化氢酶活性呈现抑制—激活—抑制的趋势。综上所述,说明不同处理方式对土壤脲酶、蔗糖酶和过氧化氢酶活性产生的变化显著。
关键词:大豆; 粘质沙雷氏菌; 咪唑乙烟酸; 脲酶; 蔗糖酶; 过氧化氢酶
中圖分类号:S158.4文献标识码:A文章编号:1006-8023(2019)02-0021-06
Effects of Different Treatments on Soil Enzyme Activity
LIU Yutong, HUO Luyang, LI Zhiguo, LIU Qing, DONG Airong
(College of Forestry, Northeast Forestry University, Harbin 150040)
Abstract:In order to explore the effects of adding soybean, serratia marcescens and imidazolidinic acid on the soil urease, sucrase and catalase activities, the indophenol blue colorimetric method and 3.5-dinitrogen were used respectively. The results showed that the soil urease, sucrase and catalase activities showed activating trend in the culture for 10 ~ 30 d after planting soybean in the soil. Serratia marcescens was added to the soil, after 5 ~ 20 d, soil urease and sucrase activities showed activating trend, which meant that serratia marcescens significantly increased soil catalase activity. Adding 100 mg/kg imidazolidinic acid to soil, soil urease showed recovery-suppression trend, soil sucrose enzyme activity began to activate at 10 d, and inhibited at 30 d. Catalase activity was activated at 10 d and 30 d. Soy was planted in soil, added with serratia marcescens and 100 mg/kg imidazolium acid, soil urease showed a trend of inhibition-recovery-inhibition, the soil invertase activity showed a trend of activation-recovery-inhibition-activation, and soil catalase activity showed a trend of inhibition-activation-suppression. In summary, the changes in soil urease, sucrase and catalase activities were significantly different for different treatments.
Keywords:Serratia marcescens; imidazolium; urease; sucrase; catalase
0引言
化学农药多是有害物质,长期持续使用化学农药,会对生物和环境造成危害,而且由于耐药性的产生,防治效果逐渐减弱,农药的残留也给生态环境带来了许多负面影响。咪唑乙烟酸是咪唑啉酮类除草剂,由于其持效期长,所以在土壤中的残留会对下茬敏感作物产生药害,严重影响种植业结构的调整。
土壤酶是土壤中植物、动物和微生物活动的产物,是数量极微而作用极大的土壤组成部分,在物质转化、能量代谢和污染土壤修复等过程中发挥着重要作用 [1]。土壤酶在土壤中无处不在,以稳定蛋白质的形态存在于土壤中,具有生物催化能力 [2-3]。土壤微生物所引起的各种生物化学过程,全部是借助于它们所产生的酶来实现的。因此,土壤酶的活性,可作为判断土壤生物化学过程强度及评价土壤肥力指标之一 [4]。不仅能反应土壤的理化性质,还是土壤生物活性的重要体现。土壤脲酶的作用很专一,土壤中尿素被其水解,生成氨、二氧化碳和水。土壤蔗糖酶可水解蔗糖,反映土壤有机碳转化能力 [5],与土壤中有机质、氮、磷含量,微生物数量及土壤呼吸强度有关,土壤蔗糖酶的作用直接关系到作物的生长 [6]。土壤过氧化氢酶是生物呼吸、生物代谢过程,以及土壤动物、植物根系分泌及残体分解中的重要酶类,过氧化氢酶主要分解土壤中的过氧化氢,降低土壤中过度累积的过氧化氢对植物根系的危害 [7],与土壤性质关系密切,是较好的土壤微生态环境指示因子 [8],其活性可表示土壤氧化过程的强度,并能有效防止土壤及生物体在新陈代谢过程中产生的过氧化氢所造成的毒害 [9]。
土壤酶学特征已作为一种潜在的指标体系指示有关土壤质量 [10]。近年来,随着土壤酶活性研究方法及技术的不断更新,加之与其它学科的交叉与整合,不少学者发现,土壤酶具有评价土壤肥力 [11]、诊断土壤污染 [12]、评价土壤质量 [13]、培肥土壤 [14]及防治植物病虫害 [15]等方面的功能。本文分别以土壤脲酶、蔗糖酶和过氧化氢酶为指标,设计盆栽试验,通过土壤中分别添加粘质沙雷氏菌(高效降解菌)、不同浓度的咪唑乙烟酸、种植大豆和三者互相作用,明确单因子及三者互相作用对土壤酶活性的影响,进一步揭示在种植大豆的土壤中加入粘质沙雷氏菌对咪唑乙烟酸的降解作用及对土壤酶活性的影响,旨在为粘质沙雷氏菌修复农药污染土壤的研究提供理论依据。
1材料与方法
1.1试验材料
盆栽试验土壤为 m 草炭∶ m 沙子∶ m 土 = 5∶3∶2的比例進行混合所得。大豆品种是黑农48。菌种是试验前期驯化得到的高效降解菌株粘质沙雷氏菌( Serratia marcescens )。
培养细菌的培养基采用牛肉膏蛋白胨培养基:牛肉膏3 g,蛋白胨10 g,氯化钠5 g,琼脂20 g, 蒸馏水1 000 mL,pH = 7.5~7.6。
1.2盆栽试验
以不种植大豆、不加粘质沙雷氏菌及咪唑乙烟酸的盆栽试验组为对照组CK;试验组A1,选择籽粒饱满、均匀、无病虫的大豆种子,每盆摆15播粒,覆土2 cm,放在盆栽内自然生长;试验组A2,将粘质沙雷氏菌接种于牛肉膏蛋白胨平板中,放入培养箱,30 ℃、黑暗条件下培养48 h,挑取菌株转入富集培养基中,160 r/min,30 ℃,摇培48 h,将菌液均匀地混入试验用土壤中;试验组A3,在试验用土壤中加入5%咪唑乙烟酸水剂,制成咪唑乙烟酸质量分数为100 mg/kg的污染土。试验组A4,按照上述试验组中大豆、粘质沙雷氏菌和咪唑乙烟酸的规格,将大豆种植于试验用土中,再将粘质沙雷氏菌和咪唑乙烟酸混入试验用土中。五组试验组在处理后5、10、20、30、40 d分别用五点法取土样,风干,过10目筛,放入冰箱4 ℃保存待用,具体情况见表1。
1.3酶活性的测定
土壤脲酶的测定采用靛酚比色法 [16]。脲酶活性以24 h后1 g土壤中含NH3-N的毫克数表示:
y 1 = 0.038 4 x 1 + 0.003 9。
R 1 2 = 0.997 9。
式中: y 1为吸光值; x 1为氮工作液浓度; R 1 2为相关系数。蔗糖酶活性测定采用3.5-二硝基水杨酸法 [17]。脲酶活性以24 h后1 g土壤中含葡萄糖的毫克数表示:
y 2 = 0.073 5 x 2 + 0.008 6。
R 2 2 = 0.999 2。
式中: y 2为吸光值; x 2为葡萄糖含量,mg; R22为相关系数。
过氧化氢酶活性检测采用高锰酸钾滴定法 [18]:
E=(v-vs) c×(51/v0)×(17/w)。
式中: E过氧化氢酶活性;v为v0体积空白溶液所消耗的高锰酸钾体积;vs 为v0体积样品溶液所消耗的高锰酸钾体积;c为高锰酸钾的浓度;w为土壤重量。
土壤酶活性的抑制率(激活率)计算公式为:
抑制率或激活率(%)= [( B-A)/A ]×100。
式中: A为空白对照的土壤酶活性;B 为不同处理所得的土壤酶活性。结果为正值时表示激活率,为负值时表示抑制率。
1.4数据分析
用Excel2010对数据进行计算和绘图;运用SPSS16.0软件进行差异性分析,并采用邓肯方法进行显著性差异分析( P< 0.05);图中数据为平均值±标准差。
2结果与分析
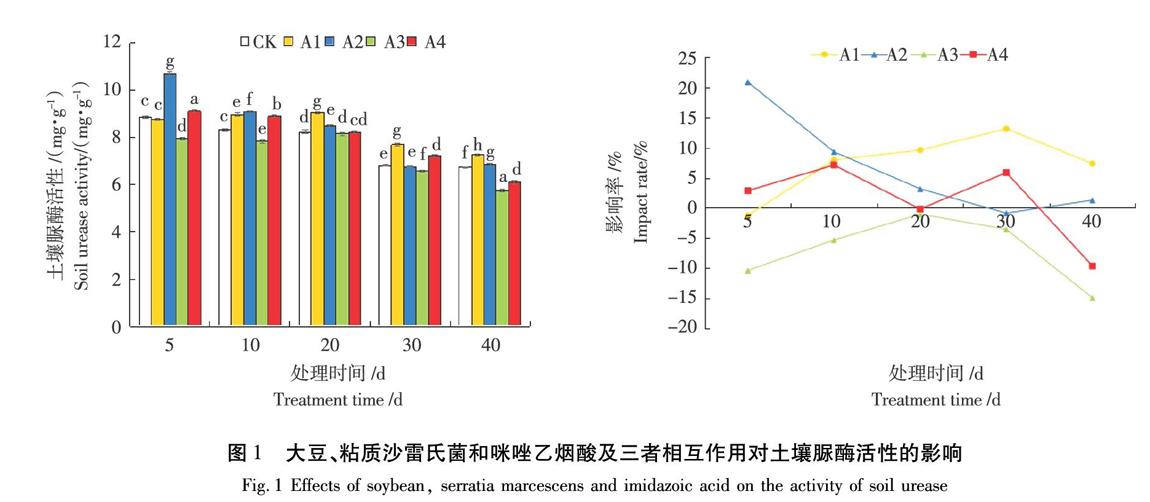
2.1大豆、粘质沙雷氏菌和咪唑乙烟酸及三者相互作用对土壤脲酶活性的影响
由图1可知,在土壤中种植大豆后,土壤脲酶活性基本呈现出激活的趋势,土壤脲酶活性5 d时略低于水平对照,抑制率仅为1.27%;10 d时开始上升,脲酶活性最高达9.03 mg/g,激活率最高达13.11%;30 d后,激活率逐渐下降,但土壤脲酶活性仍高于水平对照。在土壤中加入粘质沙雷氏菌后,土壤脲酶活性呈现出激活—恢复—激活的趋势,土壤脲酶活性5 d时开始上升,脲酶活性最高达10.71 mg/g,激活率最高达20.87%;20 d时,激活率逐渐下降,但土壤脲酶活性仍高于水平对照;30d时恢复对照水平;40 d又有激活趋势,但激活率不高,仅1.29%。在土壤中加入100 mg/kg的咪唑乙烟酸后,土壤脲酶活性基本呈现激活—抑制的趋势,土壤脲酶活性5 d时开始下降,10 d时开始抑制;30 d时抑制率最高达17.82%。在土壤中种植大豆、加入粘质沙雷氏菌,再加入100 mg/kg的咪唑乙烟酸后,土壤脲酶基本呈现抑制—恢复—抑制的趋势,5 d时土壤脲酶活性被显著抑制;10d时恢复到对照水平;20 d后脲酶活性一直被抑制,直到实验结束,脲酶活性最低达7.94 mg/g,抑制率最高达到10.39%。
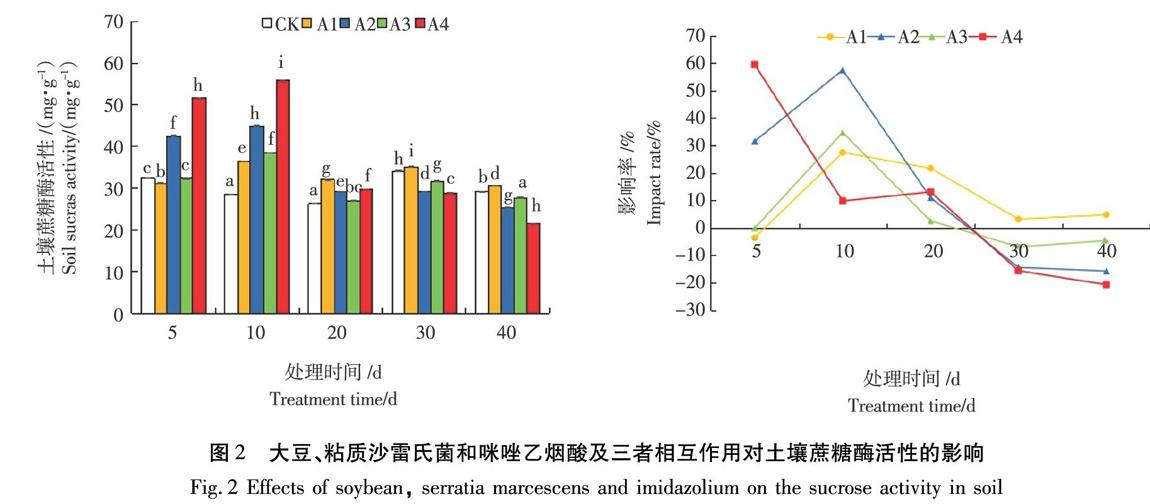
2.2大豆、粘质沙雷氏菌和咪唑乙烟酸及三者相互作用对土壤蔗糖酶活性的影响
由图2可知,在土壤中种植大豆后,土壤蔗糖酶活性呈现出抑制—激活的趋势,土壤蔗糖酶活性5 d时低于水平对照,抑制率为3.6%;10 d时,蔗糖酶活性达到最高为36.34 mg/kg,激活率最高达27.4%;20~40 d时,激活率逐渐下降,但土壤蔗糖酶活性仍高于水平对照。在土壤中加入粘质沙雷氏菌后,土壤蔗糖酶活性呈现出激活—抑制—激活的趋势,且均与对照CK的蔗糖酶活性差异性显著( P <0.05)。在培养期间,5 d时,土壤蔗糖酶活性显著升高;10 d时土壤蔗糖酶活性最高达44.94 mg/kg,激活率达57.45%;20~30 d时逐渐恢复对照后,土壤蔗糖酶活性开始被抑制,蔗糖酶活性最低达29.18 mg/kg,抑制率最高达14.42%;40 d时,又出现激活趋势,激活率达24.89%。在土壤中加入100 mg/kg的咪唑乙烟酸后,土壤蔗糖酶活性呈现激活—恢复—抑制的趋势,10 d时开始激活,活性最高达38.41 mg/kg,激活率最高达34.69%;20 d时恢复水平对照;30 d开始抑制,抑制率最高达6.93%。在土壤中种植大豆、加入粘质沙雷氏菌,再加入100 mg/kg的咪唑乙烟酸后,土壤蔗糖酶活性呈现激活—抑制—激活的趋势,土壤蔗糖酶活性10 d时蔗糖酶活性最高为55.84 mg/kg,激活率达95.78%;20 d时,依然处于激活状态;从30 d 开始,土壤蔗糖酶活性被显著抑制,蔗糖酶活性最低达21.52 mg/kg,抑制率最高达20.73%。
2.3大豆、粘质沙雷氏菌和咪唑乙烟酸及三者相互作用对土壤过氧化氢酶活性的影响
由图3可知,在土壤中种植大豆后,土壤过氧化氢酶活性呈现出激活—抑制的趋势,土壤过氧化氢酶活性5 d时开始上升,直到30 d,一直高于水平对照,活性最高达2.57 mg/g,激活率最高达34.09%;30 d后,激活率逐渐下降,直至达到抑制状态;40 d时,抑制率达30%。在土壤中加入粘质沙雷氏菌后,过氧化氢酶活性一直呈现激活状态,且均与对照组CK差异性显著(P < 0.05),土壤过氧化氢酶活性5d时开始上升;20 d时土壤过氧化氢酶活性最高为2.27 mg/g,激活率达36.00%;直到40 d時才逐渐恢复至水平对照。在土壤中加入100 mg/kg的咪唑乙烟酸后,土壤过氧化氢酶活性呈现出抑制—激活—抑制的趋势,10~30 d一直处于激活状态,活性最高达2.27 mg/g,激活率最高达43.59%;40 d时处于抑制状态,抑制率达8%。在土壤中种植大豆、加入粘质沙雷氏菌,再加入100 mg/kg的咪唑乙烟酸后,土壤过氧化氢酶活性呈现抑制—激活—抑制的趋势,在5 d时土壤过氧化氢酶活性最低为2.07 mg/g,抑制率最高达10.14%;10 d后土壤过氧化氢酶活性开始被激活,10 d时脲酶活性最高达2.07 mg/g,激活率最高达40.91%。40 d后土壤过氧化氢酶活性开始下降,酶活性最低达1.47 mg/g,抑制率激活最高达12.00%。
3讨论
许多研究表明,土壤酶活性随季节变化有明显规律,不同性质的酶类有些许区别,但均是冬季活性最低,春季上升,夏秋季活性较高 [19]。本实验研究是在夏季大棚内进行,检测了不同试验组土壤中相关酶活性的变化。结果表明在土壤中分别种植大豆、添加粘质沙雷氏菌和咪唑乙烟酸以及三者共同作用后的土壤脲酶、蔗糖酶和过氧化氢酶活性随着种植时间的增长呈现出其独有的规律性的变化。
本研究表明,在土壤中种植大豆后,土壤脲酶活性基本呈现激活的趋势;土壤蔗糖酶活性呈现出抑制—激活的趋势;土壤过氧化氢酶活性呈现出激活—抑制的趋势。在土壤中加入粘质沙雷氏菌后,土壤脲酶活性呈现出激活—恢复—激活的趋势;土壤蔗糖酶活性呈现出激活—抑制—激活的趋势,且均与对照CK的蔗糖酶活性差异性显著( P <0.05);过氧化氢酶活性一直呈现激活状态,且均与对照组CK差异性显著( P <0.05)。在土壤中加入100 mg/kg的咪唑乙烟酸土壤脲酶活性基本呈现激活—抑制的趋势,蔗糖酶活性呈现激活—恢复—抑制的趋势;土壤过氧化氢酶活性呈现出抑制—激活—抑制的趋势。在土壤中种植大豆、加入粘质沙雷氏菌,再加入100 mg/kg的咪唑乙烟酸,土壤脲酶基本呈现抑制—恢复—抑制的趋势;土壤蔗糖酶活性呈现激活—抑制—激活的趋势;土壤过氧化氢酶活性呈现抑制—激活—抑制的趋势。
以粘质沙雷氏菌为降解菌,在培养期间各组与对照组均有显著性差异。对照组土壤脲酶的活性比在土壤中加入咪唑乙烟酸的脲酶活性高,说明咪唑乙烟酸对脲酶在一定程度上有抑制作用。脲酶活性是表征土壤供氮能力的重要指标。在土壤中加入降解菌后,脲酶活性升高,土壤氮素水平升高,这可能是由于土壤中微生物死亡,细胞中的脲酶被释放到土壤中,增强了土壤脲酶的活性 [20]。蔗糖作为降解菌的最适碳源之一,土壤蔗糖酶活性可以反映降解菌对碳源的吸收状况,再结合过氧化氢酶活性的分析可知:以粘质沙雷氏菌为降解菌的试验组A4中蔗糖酶和过氧化氢酶活性在10 d和20 d时呈激活状态,酶活性达到峰值,此时粘质沙雷氏菌作为主要的碳源之一,在30 d时逐渐恢复平衡并开始降低,可能是粘质沙雷氏菌对碳源的需求开始降低,此时可能即将完成营养生长阶段。以真菌为降解菌,土壤蔗糖酶和过氧化氢酶活性开始呈激活趋势,当降解菌对碳源需求减弱时,激活趋势逐渐减弱。
【参考文献】
[1]张莉莉,陈利军,刘桂芬,等.污染土壤的酶学修复研究进展[J].应用生态学报,2003,14(12):2342-2346.
ZHANG L L, CHEN L J, LIU G F, et al. Advance in enzymological remediation of polluted soils[J]. Chinese Journal of Applied Ecology, 2003, 14(12):2342-2346.
[2]高彦波,翟鹏辉,谭德远.土壤酶活性与土壤肥力的关系研究进展[J].安徽农业科学,2015,43(6):100-101.
GAO Y B, ZHAI P H, TAN D Y. Research progress of relationship between soil enzyme activity and soil fertility[J]. Journal of Anhui Agricultural Sciences, 2015,43(6):100-101.
[3]BANERJEE S, BORA S, THRALL P H, et al. Soil C and N as causal factors of spatial variation in extracellular enzyme activity across grassland-woodland ecotones[J]. Applied Soil Ecology, 2016, 105:1-8.
[4]李军辉,夏清,杨珍平,等.基施氮肥形态及用量对小麦根际土壤脲酶活性垂直分布的影响[J].山西农业科学,2018,46(11):1852-1858.
LI J H, XIA Q, YANG Z P, et al. Effects of different kinds of basal application slow-release fertilizers and dosages on vertical distribution of urease activity in wheat rhizosphere soil[J]. Journal of Shanxi Agricultural Sciences, 2018, 46(11):1852- 1858.
[5]范昆,王开运,王东,等.1,3-二氯丙烯对土壤脲酶和蔗糖酶活性的影响[J].农药学学报,2006,8(2):139-142.
FAN K, WANG K Y, WANG D, et al. The effect of 1, 3-dichloropropene on activities of soil urease and invertase[J]. Chinese Journal of Pesticide Science, 2006, 8(2):139 -142.
[6]曹慧,孙辉,杨浩,等.土壤酶活性及其对土壤质量的指示研究进展[J].应用与环境生物学报.2003,9(1):105-109.
CAO H, SUN H, YANG H, et al. A review soil enzyme activity and its indication for soil quality[J]. Chinese Journal of Applied Environmental Biology, 2003, 9(1):105-109.
[7]王建,卢超超,芦珊珊,等.蔬菜大棚土壤过氧化氢酶活性及与养分关系研究[J].甘肃科学学报,2018,30(2):45-46.
WANG J, LU C C, LU S S, et al. Study on the relationship between soil catalase activity and nutrient in vegetable greenhouse[J]. Journal of Gansu Sciences, 2018, 30(2):45-46.
[8]ZIMMERMANN S, FREY B. Soil respiration and microbial properties in an acid forest soil: effects of wood ash[J]. Soil Bio1ogy and Biochemistry, 2002, 34(11):1727-1737.
[9]黄永洪,花慧,等.猪肝过氧化氢酶提取条件的研究[J].生物技术通讯,2005,16(1):40-42.
HUANG Y H, HUA H, et al. Study on extraction of catalase from pig liver[J]. Letters in Biotechnology, 2005, 16(1): 40- 42.
[10]劉善江,夏雪,陈桂梅,等.土壤酶的研究进展[J].中国农学通报,2011,27(21):1-7.
LIU S J, XIA X, CHEN G M, et al. Study progress on functions and affecting factors of soil enzymes[J]. Chinese Agricultural Science Bulletin, 2011, 27(21):1-7.
[11]陈少杰,邓恩.桉林地土壤酶活性与土壤养分关系研究[J].安徽农学通报,2009,15(15):171-172.
CHEN S J, DENG E. Study on the relationship between soil enzyme activity and soil nutrients of eucalyptus[J]. Auhui Agricultural Science Bulletin, 2009, 15(15):171-172.
[12]孙彩霞,陈利军,武志杰.Bt杀虫晶体蛋白的土壤残留及其对土壤磷酸酶活性的影响[J].土壤学报,2004,41(5): 454-458.
SUN C X, CHEN L J, WU Z J. Soil residuals of Bt insecticidal crystal protein and their effects on soil phosphatase activity[J]. Acta Pedologica Sinica, 2004, 41(5): 454-458.
[13]毕淑芹,张丽娟,贺晓敏,等.坡地土壤酶流失规律初探[J].农业资源与环境科学,2006,22(7):500-503.
BI S Q, ZHANG L J, HE X M, et al. Primary research on soil enzymes runoff rules from sloping field[J]. Chinese Agricultural Science Bulletin, 2006, 22 (7):500-503.
[14]郑银侠,马飞明,曹万虎,等.有机生物肥料对冬小麦生长及产量影响的研究[J].陕西农业科学,2006,52(1) :22-23.
ZHENG Y X, MA F M, CAO W H, et al. Effect of organic bio-fertilizer on growth and yield of winter wheat[J]. Shanxi Agricultural Sciences, 2006,52(1):22-23.
[15]杨万勤,王开运.森林土壤酶的研究进展[J].林业科学,2004,40(2):152-159.
YANG W Q, WANG K Y. Advances in forest soil enzymology[J]. Scientia Silvae Sinicae, 2004, 40(2): 152-159.
[16]关松荫.土壤酶与土壤肥力[J].土壤通报,1980,11(6):40-41.
GUAN S Y. Soil enzymes and soil fertility[J]. Chinese Journal of Soil Science, 1980, 11(6):40-41.
[17]关松荫.土壤酶及其研究法[M].北京:农业出版社,1986.
GUAN S Y. Soil enzymes and its methodology[M]. Beijing: Agricultural Press, 1986.
[18]周礼恺.土壤酶学[M].北京:科学出版社,1987.
ZHOU L K. Soil enzymology[M]. Beijing: Science Press, 1987.
[19]姚健,王让会,赵建萍,等.精河沙区土壤酶分布特征及其对土壤理化性状的响应[J].湖北农业科学, 2015, (18):4435-4440 .
YAO J, WANG R H, ZHAO J P, et al. The distribution characteristics of soil enzyme and its response to physicochemical properties of soil in the dessert area of Jinghe[J]. Hubei Agricultural Science, 2015(18):4435-4440.
[20]徐欣,王曉军,谢洪宝,等.秸秆腐解对不同氮肥水平土壤脲酶活性的影响[J].中国农学通报,2018,34(34):99-102.
YAO X, XIE X J, XIE H B, et al. Effects of straw decomposition on soil urease activity at different nitrogen fertilizer levels[J]. Chinese Agricultural Science Bulletin, 2018, 34(34):99-102.
