血清抗缪勒氏管激素分析在多囊卵巢综合征中的临床应用研究
2019-06-04张秋敏
张秋敏
深圳市坪山区人民医院,广东深圳 518118
多囊卵巢综合征(polycystic ovary syndrome,PCOS)是常见的内分泌紊乱综合征,以慢性无排卵、卵巢多囊性改变、高雄激素改变为特征,育龄妇女多发[1]。研究发现血清AMH(抗缪勒氏管激素)的水平与窦卵泡计数(AFC,antral follicle count)间有强相关性,患者显著特征之一为AFC 增加,每个卵泡的AMH 表达量也升高[2]。为了进一步研究AMH 在PCOS 中的临床应用,特选取我院100 例PCOS 患者进行研究,现报道如下。
1 资料与方法
1.1 一般资料
选取我院2017年3月~2018年3月收治的PCOS 各年龄段患者100 例作为观察组,患者年龄25~40 岁,平均(32.2±5.3)岁。入选标准采用2003年鹿特丹诊断标准[3]:(1)偶发排卵和(或)无排卵;(2)临床和(或)生化指标提示高雄激素血症,并排除先天性肾上腺增生、分泌雄激素肿瘤、Cushing(库欣)综合征等其他可能病因;(3)卵巢多囊性改变(ovarian polycystic changes ,PCO):B超检查提示至少一侧卵巢有≥12 个直径2~9mm卵泡,和(或)卵巢体积增大>10mL,符合其中两项者诊断为PCOS,排除甲状腺功能紊乱、高催乳素血症、先天性肾上腺增生症患者。选取100 例健康受检者作为对照组,患者年龄24~39 岁,平均(31.0±5.1)岁。两组患者年龄等一般资料比较差异无统计学意义(P>0.05),所有受检者均自愿参与此次研究并签署知情同意书。
表1 两组患者各项指标比较(±s)
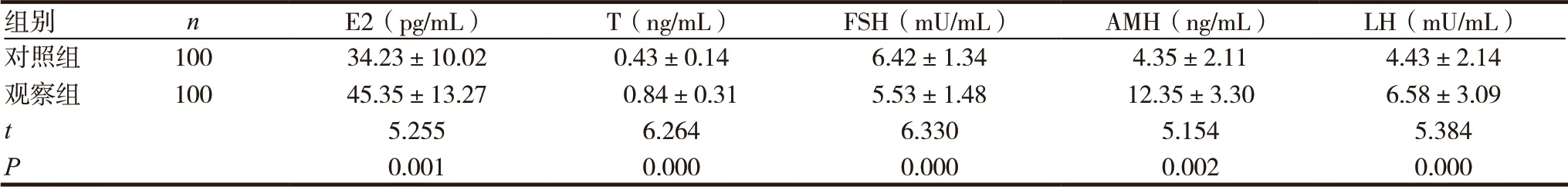
表1 两组患者各项指标比较(±s)
组别 n E2(pg/mL) T(ng/mL) FSH(mU/mL) AMH(ng/mL) LH(mU/mL)对照组 100 34.23±10.02 0.43±0.14 6.42±1.34 4.35±2.11 4.43±2.14观察组 100 45.35±13.27 0.84±0.31 5.53±1.48 12.35±3.30 6.58±3.09 t 5.255 6.264 6.330 5.154 5.384 P 0.001 0.000 0.000 0.002 0.000
1.2 方法
患者抽血前应该安静休息,月经周期第2~5天晨起空腹采血(患者闭经期抽血时间随意),3000r/min 离心10min 取血清-20℃低温保存,测试仪器为Beckman Coulter UniCel DXI800 化学发光分析仪,采用酶联免疫配套试剂。从冰箱中取出AMH试剂盒后平衡至室温,打开铝箔袋包装,取出需要数量的试剂船后将其余的试剂船及干燥剂硅胶装入密封袋内,排除空气密封后2~8℃保存。在校准品1-2 和质控物中各加入1.0mL 去离子水,溶解10 分钟,轻轻涡旋震荡混匀备用。检查位置4 中的底物,应为无色,否则应弃掉该试剂船。分别在每个试剂船的位置1 中加85μL 待测血清,或者加入85μL 校准品或质控物。每更换一个批号的试剂,应重新进行校准。放置试剂船到仪器中,按照使用说明书进行校准(若有必要)和检测。本研究采用AMH -ELISA 测定试剂盒,选购获得国家食品药品监督管理局注册登记的AMH 测定商品试剂盒,以保证检测结果的准确可靠。
若治疗后8 周内卵巢无排卵患者,给予50~100mg 氯米芬(cC)或rFSH 治疗,用药1~3个周期后出现排卵,则认为治疗有效,疗效欠佳,为卵巢低反应性;若治疗后不管使用cC 与否卵巢均不能获得排卵,则认为治疗失败,无疗效,为卵巢无反应性,将低反应性和无反应性患者作为观察组1。
若治疗后8 周内卵巢有排卵,则认为治疗有效,为卵巢高反应性,这些患者为观察组2。
1.3 观察指标
分析两组患者雌二醇(E2)、睾酮(T)、卵泡刺激素(FSH)、抗缪勒氏管激素(AMH)、黄体生成素(LH)以及GLU(空腹血糖)、FINS(空腹胰岛素)、HOMA-IR(homeostasis model assessment of insulin resistance),抗胰岛素性稳态模式评估法。
1.4 统计学方法
应用SPSS19.0 统计软件进行分析,ROC 曲线分析用于AMH 诊断性能的评价,用()表示计量资料,采用t和F检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 治疗前两组患者各项指标比较
观察组患者卵泡刺激素水平明显低于对照组,雌二醇、睾酮、抗缪勒氏管激素、黄体生成素水平明显高于对照组,差异有统计学意义(P<0.05),见表1。
2.2 两组患者糖代谢指标比较
试验组患者空腹血糖、空腹胰岛素、HOMA-IR 明显高于对照组,差异有统计学意义(P<0.05),见表2。
表2 两组患者糖代谢指标比较(±s)
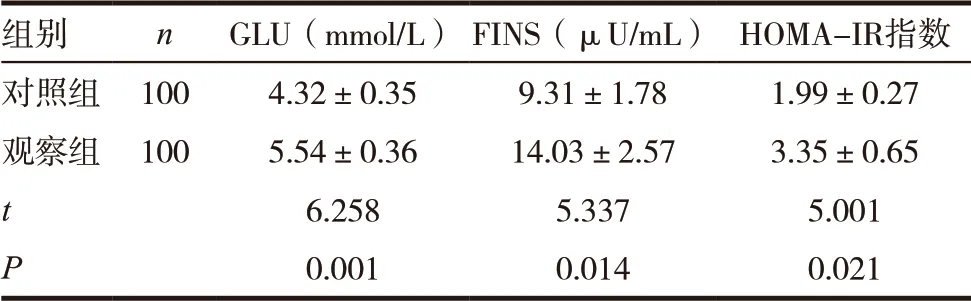
表2 两组患者糖代谢指标比较(±s)
组别 n GLU(mmol/L) FINS(μU/mL) HOMA-IR指数对照组 100 4.32±0.35 9.31±1.78 1.99±0.27观察组 100 5.54±0.36 14.03±2.57 3.35±0.65 t 6.258 5.337 5.001 P 0.001 0.014 0.021
2.3 治疗后两组患者AMH指标比较
观察组2 患者AMH 明显低于观察组1 患者,差异有统计学意义(P<0.05),见表3。
表3 治疗后两组患者AMH指标比较(±s,ng/mL)

表3 治疗后两组患者AMH指标比较(±s,ng/mL)
注:与观察组1 比较,△P <0.05
组别 n AMH对照组 100 4.35±2.11观察组1 20 10.23±2.98观察组2 80 5.08±1.91△F 7.662 P 0.001
3 讨论
PCOS 是常见的妇科内分泌疾病,育龄妇女多见且高度多样化,对女性生殖健康造成严重影响[4]。PCOS 患者不孕的主要原因是小窦状卵泡过多、卵泡募集异常、优势卵泡选择障碍、小卵泡发育障碍等导致的不排卵,反复促排卵失败的助孕成功的关键则是减少卵巢过度刺激、获得适当数量的优质卵子[5]。PCOS 患者血清AMH 水平与代谢紊乱、内分泌间的关系成为研究的特点,多于糖代谢、激素代谢、慢性炎症基因、肥胖基因等有关,干预患者激素代谢对于PCOS 治疗有总要意义[6]。AMH 是糖蛋白激素,主要的作用为降低生长卵泡对FSH 的敏感性、抑制原始细胞的募集、调控卵泡的正常发育[7]。血清AMH 的水平与AFC(窦卵泡计数)间有较强的相关性,PCOS 患者中最显著的内分泌特征之一就是窦卵泡数量的增加,PCOS 患者血清AMH 的水平通常是非PCOS 者的2~4 倍,并且每个卵泡的AMH 表达量也明显增高[8]。AMH 在女性仅由卵巢分泌,由窦前卵泡和小窦卵泡产生,是生长和分化因子超家族中转化生长因子-β 家族(TGF-β)中的成员,是目前外周血中能检测到的最早的卵泡产生的物质[9]。
国内外研究发现AMH 在PCOS 治疗后有变化,AMH 在自然月经周期各阶段均无明显波动不受月经周期和药物等的影响,可以任意时间检测[10-11]。本研究通过试验得出结果:观察组患者卵泡刺激素水平明显低于对照组,雌二醇、睾酮、抗缪勒氏管激素、黄体生成素水平明显高于对照组,试验组患者空腹血糖、空腹胰岛素、HOMA-IR 明显高于对照组,观察组2 患者AMH 明显低于观察组1 患者,差异有统计学意义(P<0.05)。PCOS 患者内分泌失调,过量的雄激素在外周组织转化为雌酮,抑制卵泡发育同时雌酮反馈导致FSH 减少,从而导致LH 升高,并且卵泡失去周期性、对LH 更为敏感,优势卵泡选择受阻,发生跑路安障碍、多滤泡卵巢等[12-13]。而窦前卵泡产生的AMH 增加后会降低卵泡对FSH 的敏感性,从而加剧窦卵泡的聚集,因此AMH 浓度可作为准确反映卵巢窦卵泡数目的替代指标[14]。此次试验结果也进一步证实,PCOS 治疗有效的患者AMH 明显下降。AMH 正常界值定为60pmol/L,不同研究中由于人群不同或不同亚型PCOS 病例混合导致AMH 诊断的界值也不同,不同类型的PCOS 患者AMH 水平差异较大。有研究显示AMH 水平随着PCOS 患者年龄的增长而降低,其降低速度慢于健康的女性,成负相关性,但是PCOS 患者血清AMH 水平与年龄并没有统计学意义上的负相关性,因此此次研究患者均为20~40 岁的患者[15-16]。
综上所述,血清AMH在PCOS 患者中明显升高,较LH、E2、T、FINS 等具有更为稳定、方便的特点,在PCOS 诊断中具有重要价值,给予相应的早治疗措施后能够进一步提高治疗的效果,值得临床推广使用,但是AMH 与睾酮的代谢以及是否相互调节等问题还需要更进一步的探讨。
