HepaRG和HepG2细胞聚球体的生长形态、细胞色素P450酶和白蛋白表达及对药物肝毒性敏感性的比较
2019-06-03孟镇锴李晓旭瞿文生吴纯启李云峰王全军
孟镇锴,李晓旭,2,瞿文生,吴纯启,钟 武,李云峰,王全军
(1.军事科学院军事医学研究院毒物药物研究所,抗毒药物与毒理学国家重点实验室,国家北京药物安全评价研究中心,北京 100850;2.聊城大学药学院,山东 聊城 252000)
肝脏是人体最大的代谢转化器官,担负多种重要生理功能,对人类健康至关重要。药物诱导性肝损伤(drug induced liver injury,DILI)是导致药物研发失败和退市的最常见原因[1],其预测难度大,危害性强,影响深远。有研究显示,我国人群DILI年发生率为每10万人中23.8人,远高于西方国家[2]。随着“安全、有效、质量可控”的制药原则逐步深入人心,药物安全性问题备受关注,DILI的研究及预测更受到毒理学界的高度重视。细胞色素P450(cytochrome P450,CYP450)酶广泛存在于肝微粒体中,是最为重要的药物代谢Ⅰ相酶系,其功能与DILI的发生密切相关,在药物肝毒性评价研究中意义重大。得益于现代化工和制药技术的进步,人们合成开发新化合物的种类和数量越来越多,速度越来越快,对体外化合物肝毒性筛选检测模型提出了更高要求。寻找并构建更加敏感、高效的体外肝细胞模型以满足大量化合物更高的检测筛选需求,一直以来是毒理学领域重要的研究内容。
常规的体外肝细胞模型较多采用2D 培养,但存在细胞间联系少、功能表达不充分、培养时间短和性状保持难等问题,参考价值有限。近年研究表明,体外3D 培养状态下的肝细胞聚球体模型可很好地模拟细胞间物质交换与信息传递,蛋白表达和肝功能表现更加突出[3-5],可长期培养并实现重复给药,反复染毒,使药物毒性暴露更加充分,检测敏感度更高[6]。
原代人肝细胞(primary human hepatocytes,PHH)作为体外药物肝毒性评价的金标准在药物筛选中最具参考价值,但其来源紧缺,体外增殖能力差,性状维持难,存在个体差异,限制了其普及和应用[7]。HepG2细胞来源于人肝癌组织,科研应用时间久,但参考价值有限;HepaRG 细胞为人肝祖细胞,来源于慢性丙肝患者肝组织,体外可不断增殖,具有肝样-胆管样细胞双向分化性,肝细胞功能表达良好且来源广泛,极具应用优势[6]。有研究显示,对2D 培养状态下的PHH,HepaRG和HepG2细胞进行比较,HepaRG 细胞CYP450 酶等多种功能蛋白表达显著高于HepG2细胞,与PHH较为接近[8]。亦有文献报道,3D 培养状态下的HepaRG 和HepG2细胞聚球体,其多种功能蛋白的表达水平明显高于自身2D 模型,对药物的肝毒性更加敏感[4,9-10]。然而,针对此2种细胞3D聚球体模型的对比研究报道较少。本研究应用HepaRG和HepG2细胞体外3D 聚球体模型,比较二者在生长形态、功能蛋白表达和对药物肝毒性敏感性方面的差异,以期为体外肝细胞模型的选择提供参考和依据。
1 材料与方法
1.1 细胞、药品、试剂和主要仪器
HepaRG细胞和HepG2细胞均购自美国Millipore细胞库。低吸附96孔板购自美国Corning公司;无酚红Williams'E培养基(简称完全培养基,含胎牛血清10%,L-谷氨酰胺4 mmol·L-1,青霉素100 kU·L-1,链霉素100 mg·L-1)(批号2000888),胎牛血清(批号1795588)和L-谷氨酰胺(批号1951049)均购自美国Gibco公司;Trizol总RNA提取剂(货号DP405-02)购自北京天根生化科技有限公司;逆转录试剂盒(货号RR047B)购自日本TaKaRa公司;小鼠抗人CYP1A2单克隆抗体(货号ab22717),兔抗人CYP2B6多克隆抗体(货号ab69652),兔抗人CYP2C9单克隆抗体(货号ab150364),兔抗人CYP2C19 单克隆抗体(货号ab185213),兔抗人CYP2E1 多克隆抗体(货号ab28146),兔抗人CYP3A4多克隆抗体(货号ab155029),兔抗人白蛋白多克隆抗体(货号ab106582)和辣根过氧化物酶(HRP)标记兔抗鸡IgY(货号ab6753)均购自美国Abcam公司;CY3标记山羊抗小鼠IgG(货号gb21301)和山羊抗兔IgG(二抗)(货号gb21303)购自武汉谷歌生物科技公司;硫胺素(thiamine,货号25332),非阿尿苷(fialuridine,货号15867),对乙酰氨基酚(acetaminophen,货号10024),苯溴马隆(benzbromarone,货号19768),异烟肼(isoniazid,货号20378),奈法唑酮(nefazodone,货号10012642)和环磷酰胺(cyclophosphamide,货号13849)均购自美国Cayman公司;CCK-8试剂盒(货号NG639)购自日本同仁公司。
IC1000 型电子细胞计数仪购自上海睿钰生物科技公司;3-18K型高速冷冻离心机购自美国Sigma公司;VICTOR3-1420 型多功能酶标仪购自美国Perkin Elmer 公司;ABI7500型荧光定量PCR仪购自美国Thermo Fisher Scientific 公司;Tanon1600型凝胶成像系统购自上海天能科技有限公司;ECLIPSE C1 型正置荧光显微镜购自日本尼康公司。
1.2 HepaRG和HepG2细胞聚球体的培养和形态观察
复苏HepaRG和HepG2细胞,常规培养于完全培养基,37℃,5%CO2及饱和湿度培养箱中培养并隔天换液。细胞处于对数生长期时,以每孔100 个细胞的密度将2 种细胞分别接种于低吸附96 孔板中,每孔加完全培养基100 μL,接种后100×g离心5 min促进细胞向中心区域聚集,静置2 min后转移至培养箱中,采取不添加二甲亚砜和糖皮质激素等诱导剂的方式进行培养,隔天用完全培养基半换液。于接种后第3,7,14和21天进行观察,在40倍光学显微镜下拍摄HepaRG和HepG2细胞聚球体形态,并采用photoshop软件测量其直径。
1.3 实时荧光PCR法检测HepaRG和HepG2细胞聚球体CYP450酶和白蛋白mRNA表达水平
收集接种后第7,14和21天的HepaRG 和HepG2细胞聚球体,用PBS 清洗3 次,加入Trizol试剂提取总RNA,按照逆转录试剂盒说明书进行cDNA逆转录。引物由北京Invitrogen公司合成,序列见表1,内参为18SrRNA。实时荧光PCR反应程序:95 ℃,30 s;40 个循环收集荧光(95℃,10 s;60℃,50 s);建立PCR 产物溶解曲线,扩增结束后进行如下设置(95℃,10 s;60℃30 s;95℃15 s),最后从60℃缓慢加热至99℃。采用2-△△Ct法计算各样品目的基因mRNA 表达水平,并以接种后第7天HepG2 细胞聚球体样品中各目的基因mRNA 表达量作为基础对照值,比较其他样品目的基因mRNA的相对表达倍数。

Tab.1 Primer sequences for quantitative real-time PCR(qRT-PCR)
1.4 免疫荧光法检测HepaRG和HepG2细胞聚球体CYP450酶蛋白表达水平
接种后第10天,收集足量聚球体样品,4%多聚甲醛固定20 min 后清洗,制作石蜡切片,并脱蜡至水。以10%牛血清白蛋白室温封闭30 min,加入一抗(用PBS缓冲液1∶100稀释),放入湿盒,4℃孵育过夜。置脱色摇床上用PBS 晃动洗涤3 次,每次5 min,加入二抗(以TBST缓冲液1∶300稀释)避光室温孵育1 h,置脱色摇床上用PBS 晃动洗涤3 次后,以4‘,6-二脒基-2-苯基吲哚染核10 min,PBS清洗3次后用抗荧光淬灭剂封片。于荧光显微镜下观察各蛋白荧光显色并拍照,用Image J 软件对荧光信号的平均荧光强度(mean fluorescence intensity,MFI)进行检测和统计分析。
1.5 Western蛋白印迹法检测HepaRG和HepG2细胞聚球体白蛋白蛋白表达水平
接种后第10 天,收集足量聚球体样本,加入裂解液,冰上裂解20 min 并振荡,离心收集上清。按4∶1 比例加入上样缓冲液,沸水浴变性15 min,-20℃保存。配制SDS-PAGE的12%分离胶和5%浓缩胶,上样并电泳。半干法PVDF 转膜,加5%脱脂牛奶室温下脱色摇床封闭1 h。加入一抗(1∶1000)4℃孵育过夜,置于脱色摇床上TBST 晃动洗涤3 次,每次5 min。加入二抗(1∶3000)室温下孵育30 min并清洗3次。于暗室内进行曝光、显影和定影处理后扫描图像,用Image J 软件进行积分吸光度分析。
1.6 CCK-8法检测单次或重复给药HepaRG和HepG2聚球体细胞存活率
包括阴性对照药物硫氨素等7种药物均以完全培养基配制,其中硫胺素、非阿尿苷、对乙酰氨基酚、苯溴马隆、异烟肼和奈法唑酮的终浓度为0.01,0.1,1,10,20和40 mmol·L-1;环磷酰胺的终浓度为0.01,0.1,1,5,10和20 mmol·L-1,分别以单次和重复给药的方式对2种细胞聚球体进行细胞毒性实验。
单次给药:接种后第10 天,将原培养液更换为含不同浓度药物的完全培养基,每孔100 μL,置于37℃,5%CO2及饱和湿度培养箱孵育24 h。而后吸去药液,以不含药的完全培养基清洗换液3 次,彻底去除残留药液。每孔加入CCK-8 试剂10 μL,继续孵育4 h 后用多功能酶标仪在450 nm 波长下检测吸光度(A450nm)值。
重复给药:接种后第10,12 和14 天,分别重复单次给药过程(共重复给药3次),末次清洗换液去除药物后,每孔加入CCK-8 试剂10 μL,孵育4 h 后用多功能酶标仪在450 nm波长下检测A450nm值。
细胞存活抑制率(%)=(对照孔A450nm-实验孔A450nm)/对照孔A450nm×100%。用GraphPad 7 软件绘制不同给药方式下各药物对2种细胞聚球体的细胞存活抑制率曲线,并计算IC50值,以评价2种细胞聚球体对药物体外肝毒性的敏感性。
1.7 统计学分析
实验结果数据以±s表示,使用SPSS19.0 进行统计学分析。2 种细胞聚球体平均直径测量结果和实时荧光PCR 检测结果数据采用两因素重复测量方差分析进行组间比较,免疫荧光和Western蛋白印迹实验结果数据采用独立样本t检验进行两组间比较,P<0.05认为差异具有统计学意义。
2 结果
2.1 HepaRG和HepG2细胞聚球体生长规律和形态变化
聚球体镜下形态见图1A,平均直径变化见图1B。随着培养时间的延长,2 种细胞聚球体平均直径均逐步增大。接种后第3 天,HepaRG和HepG2细胞均可稳定聚合成球形结构,二者平均直径无明显差异。第7和14天时,二者均能保持较为规则致密的球形结构,HepG2细胞聚球体体积增长幅度较明显,其平均直径均显著大于HepaRG细胞聚球体(P<0.01)。第21 天时,HepG2细胞聚球体体积小幅增长,细胞间黏附作用下降,球体形态疏松膨大,有明显崩解碎裂倾向;而HepaRG 细胞聚球体有部分组织碎屑,但整体形态保持较为紧致,平均直径显著<HepG2细胞聚球体(P<0.01)。

Fig.1 Morphology(A)and average diameters(B)of HepaRG and HepG2 spheroids.HepaRG and HepG2 cells were seeded at 100 cells per well and all spheroids were monitored on the 3rd day(D3),D7,D14and D21 after cell inoculation.±s,n=4.**P<0.01,compared with HepG2 group at the same time.
2.2 HepaRG和HepG2细胞聚球体CYP450酶mRNA表达水平
实时荧光PCR检测结果(图2)表明,2种细胞聚球体除第14天CYP2B6mRNA 表达不具统计学意义外,在3 个检测时间点中HepaRG 细胞聚球体CYP1A2,CYP2B6,CYP2C9,CYP2C19,CYP2E1和CYP3A4mRNA 表达水平均明显高于同期HepG2 细胞聚球体(P<0.05,P<0.01);HepaRG 细胞聚球体CYP1A2和CYP2C9mRNA 表达水平在第7 天达峰值,与HepG2 细胞聚球体差异显著(P<0.01),分别为基础对照值(第7天的HepG2细胞聚球体mRNA表达量)的261.7和277.1倍;CYP2B6,CYP2C19和CYP2E1mRNA表达在第7和14天表达水平显著高于同期HepG2 细胞聚球体(P<0.01),表达峰值分别为基础对照值的55.7,9.9 和44.3倍;CYP3A4mRNA表达于第14 天达峰值,高于HepG2 细胞聚球体(P<0.01),为基础对照值的280.7倍。
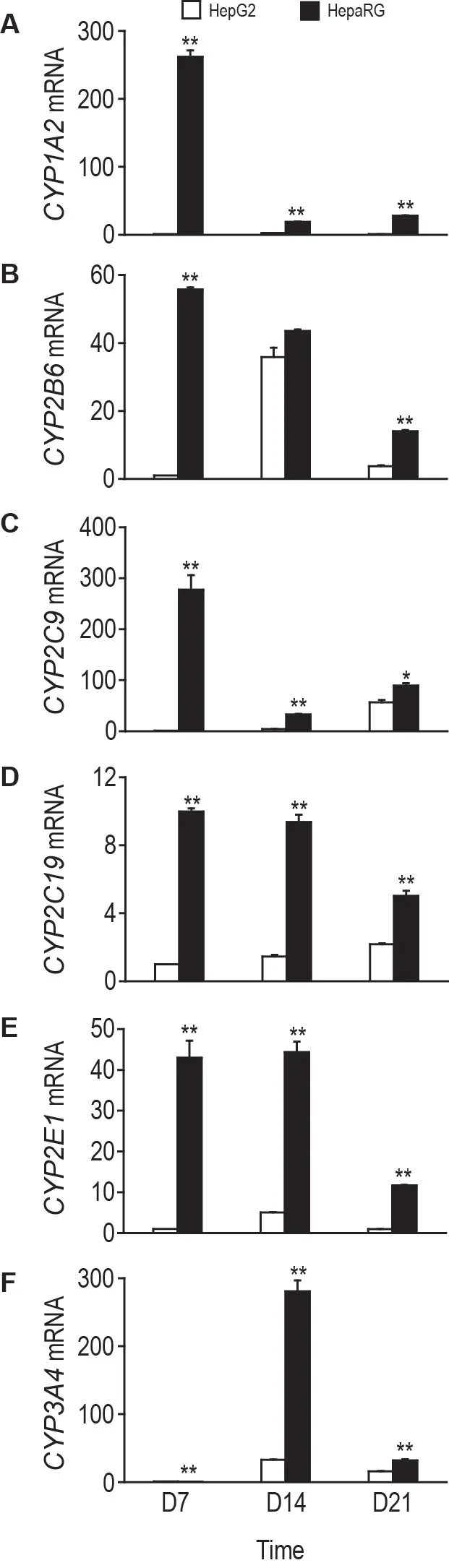
Fig.2 Relative expressions of CYP1A2(A),CYP2B6(B),CYP2C9(C),CYP2C19(D),CYP2E1(E)and CYP3A4(F)mRNA in HepaRG and HepG2 spheroids by qRT-PCR. CYP mRNA expression level was expressed as the relative expression fold based on the mRNA expression(2-ΔΔCt)of HepG2 cell spheroids on D7.±s,n=3.*P<0.05,**P<0.01,compared with HepG2 group at the same time.
2.3 HepaRG和HepG2细胞聚球体CYP450酶蛋白表达水平
荧光染色结果(图3和表2)表明,培养第10 天HepaRG细胞聚球体CYP1A2,CYP2B6,CYP2C9,CYP2C19,CYP2E1 和CYP3A4 蛋白表达水平均高于同期HepG2 细胞聚球体,分别为后者的2.1,1.6,1.9,1.6,1.6和2.3倍(P<0.05,P<0.01)。
2.4 HepaRG和HepG2细胞聚球体白蛋白mRNA和蛋白表达水平
实时荧光PCR 结果(图4A)表明,接种后第7天时,HepaRG细胞聚球体白蛋白mRNA表达明显上调;第14天达峰值,为基础对照值的3.9倍,高于同期HepG2 细胞聚球体表达(P<0.01);第21 天时,2 种聚球体白蛋白mRNA 表达无明显差别。Western 蛋白印迹法结果(图4B)表明,接种后第10 天,HepaRG 聚球体白蛋白蛋白表达显著高于HepG2聚球体,约为后者的1.9倍(P<0.01)。
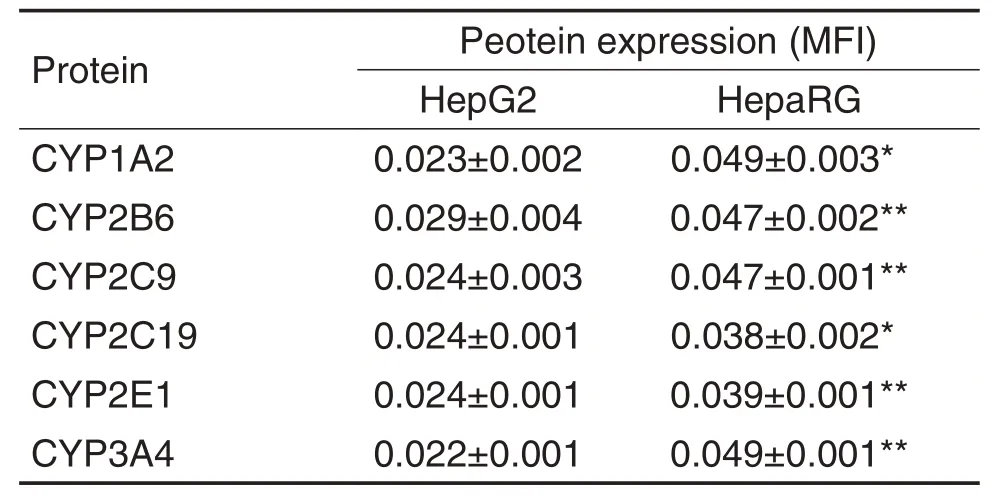
Tab.2 Protein expression of CYP450s in HepaRG and HepG2 spheroids by immunofluorescence staining
2.5 HepaRG和HepG2细胞聚球体对药物肝毒性的敏感性
在受试浓度范围内单次给药,7 种药物中除苯溴马隆和奈法唑酮外,其余5 种对HepaRG 和HepG2细胞聚球体细胞存活的抑制作用均未达到半数抑制水平。同样浓度范围下重复给药3 次,在HepaRG细胞聚球体,6 种阳性对照药对细胞存活均有抑制作用,其IC50值见表3;在HepG2细胞聚球体,对乙酰氨基酚和环磷酰胺对细胞存活的抑制作用均未达到半数抑制水平。
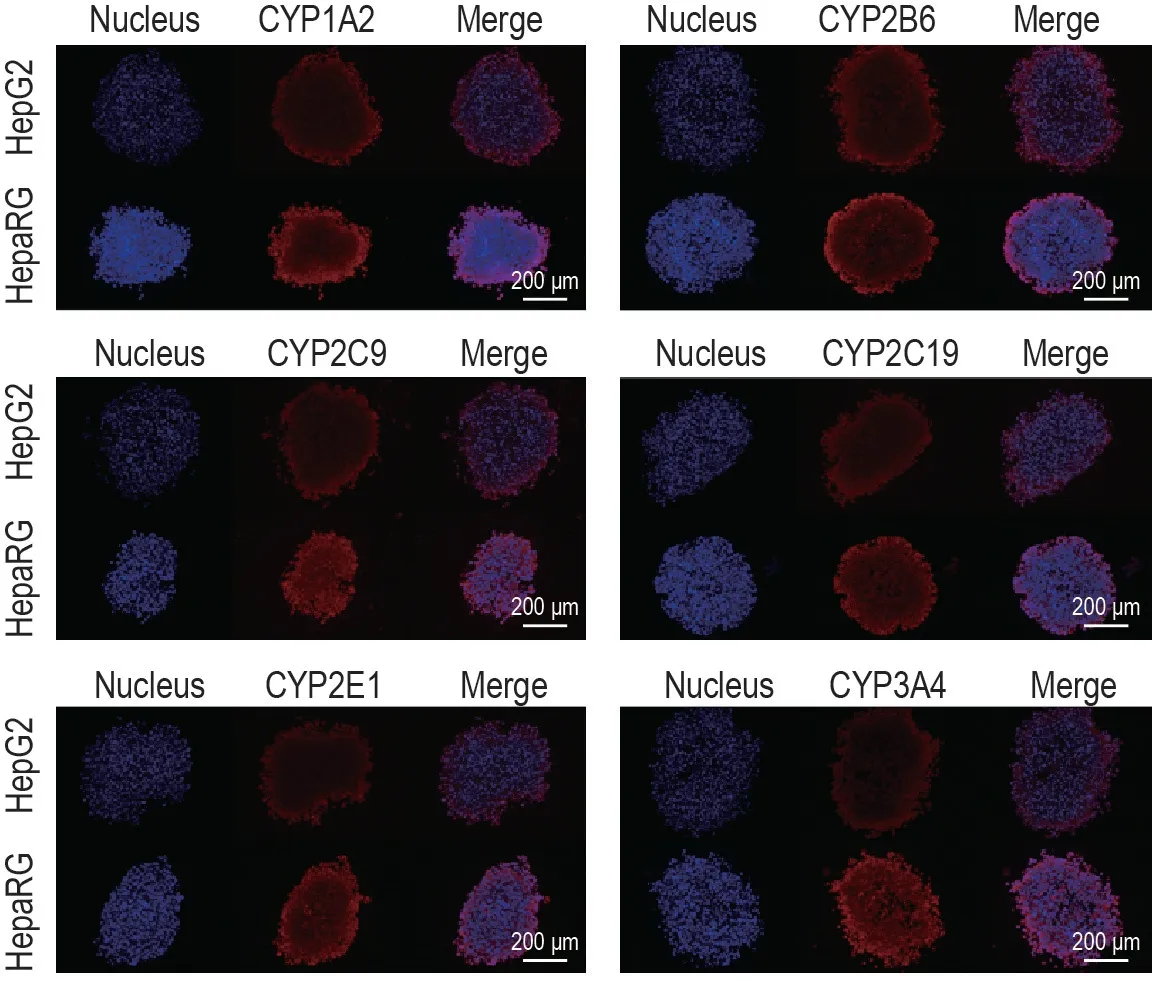
Fig.3 Protein expression of CYP450s in HepaRG and HepG2 spheroids by immunofluorescence staining.HepaRG and HepG2 spheroids were stained with 4′,6-diamidino-2-phenylindole and secondary antibodies and detected on D10.

Fig.4 Albumin mRNA and protein expressions in HepaRG and HepG2 spheroids by qRT-PCR(A)and Western blotting(B).HepaRG and HepG2 spheroids were detected on D7,D14,and D21 by qRT-PCR and on D10 by Western blotting,respectively.B2 was the semi-quantitative result of B1.IA:integral absorbance.±s,n=3.**P<0.01,compared with HepG2 group of the same time.
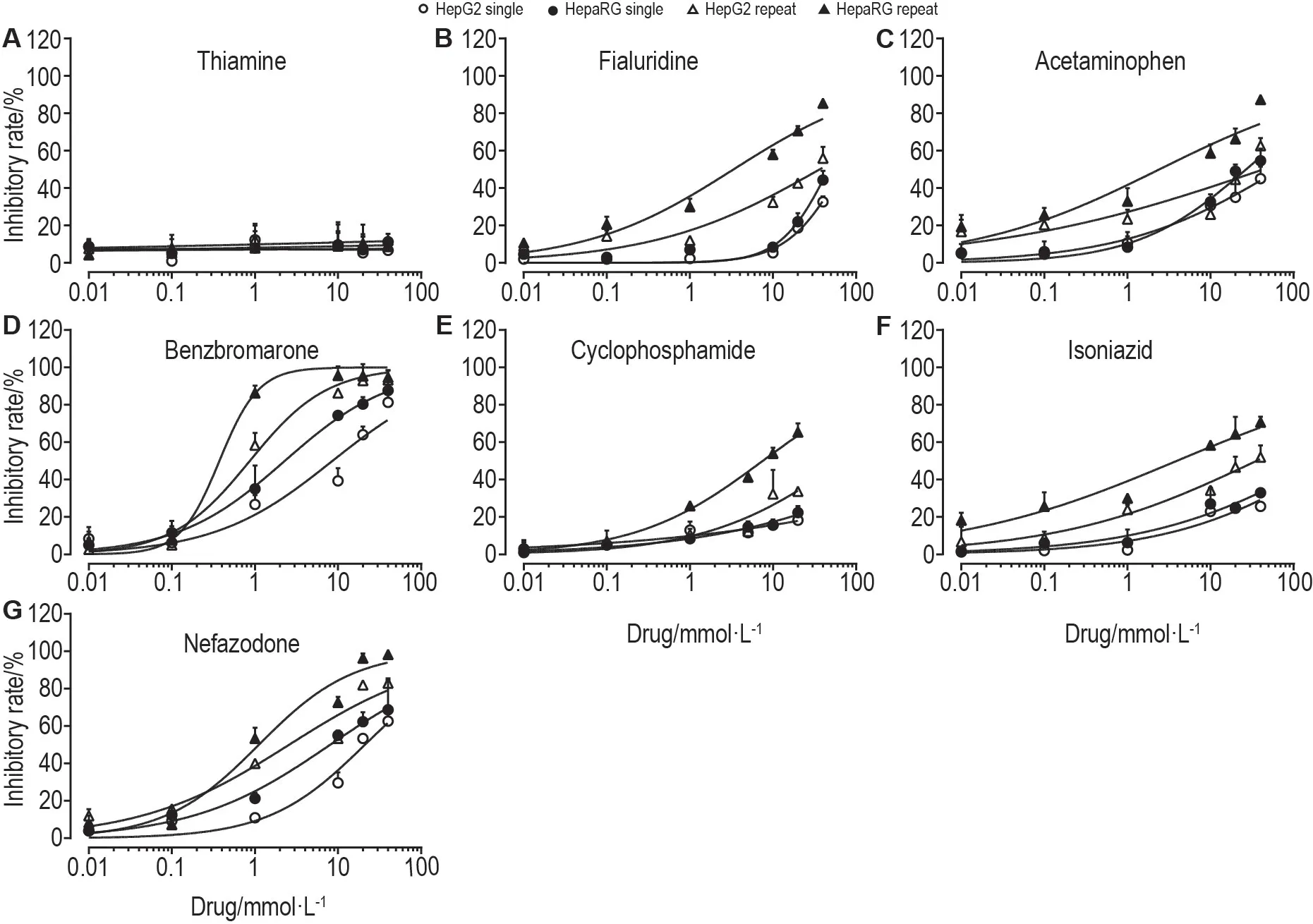
Fig.5 Hepatotoxicity of thiamine(A),fialuridine(B),acetaminophen(C),benzbromarone(D),cyclophosphamide(E),isoniazid(F)and nefazodone(G)with single and repeated administration in HepaRG and HepG2 spheroids by CCK-8 assay.HepaRG and HepG2 spheroids were incubated with different concentrations of each drug for 24 h once(single administration)or 3 times at 24 h intervals(repeated administration).Inhibitory rate(%)=(cell control group A450 nm-experiment group A450 nm)/cell control group A450 nm×100%.±s,n=3.
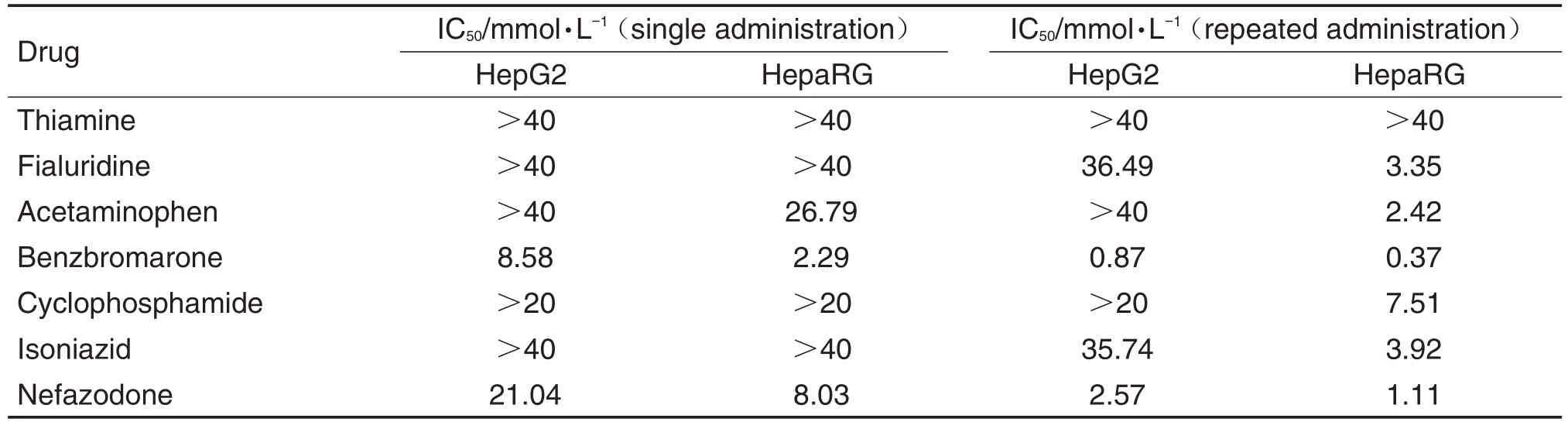
Tab.3 lC50 values of drugs in HepaRG and HepG2 spheroids
3 讨论
HepaRG 细胞具有肝样-胆管样细胞双向分化性,国外研究倾向于在培养初期(2 周内)添加二甲基亚砜、奥美拉唑和糖皮质激素进行诱导[10-11],以促进细胞快速分化成熟。然而诱导剂的反复添加存在如下问题:①2 种模型培养条件不统一,结果对比可信度下降;②不同批次样本间差异度增大,质控难度提高;③建模的成本增加,操作工作量上升。出于上述考虑,本课题组在模型的构建上采取了不添加诱导剂的方式。结果显示,在无诱导剂添加的条件下接第14天,HepaRG细胞聚球体多种功能蛋白均有高水平表达,并明显高于同期HepG2细胞聚球体。表明不添加诱导剂的HepaRG 细胞聚球体构建方法相比于诱导法更加经济、简便、实用,具有一定普适性,且在功能上优于HepG2 细胞聚球体。
文献报道,为保证模型内部供能供养均匀且充足,聚球体参考直径在200~300 μm 较为合适[11]。本研究以此范围为细胞聚球体质量控制的标准。结果显示,在接种后第3~14天,HepG2细胞聚球体快速生长、体积持续增大,超出参考直径范围较为明显;而HepaRG 细胞聚球体直径持续稳定在约300 μm,形态紧致,相比于HepG2细胞聚球体具有一定的形态优势。接种后第21 天,HepaRG和HepG2细胞聚球体直径均≥400 μm,HepG2 细胞聚球体细胞间黏附作用明显下降,而HepaRG细胞聚球体亦存在少量崩散现象,表明二者均存在能量供应障碍。以上结果提示,为防止体积过大形成过多坏死区域而影响聚球体建模效果,以接种后7~14 d进行后续实验为宜。
文献报道,对CYP1A2,CYP2B6,CYP2C9,CYP2C19,CYP2E1和CYP3A4的检测可覆盖80%以上临床药代相关Ⅰ相酶,具有一定代表性和参考价值,而白蛋白生成能力的高低亦是评价肝细胞模型优劣的重要指标[6,8]。Yokoyama等[8]研究表示,2D培养状态下,HepaRG细胞的多种CYP450酶mRNA表达均明显高于HepG2细胞。本研究结果表明,3D培养状态下,HepaRG细胞聚球体亦保持了CYP450 酶的基因层面高表达的优势。蛋白表达检测结果与实时荧光PCR 结果与文献报道趋势一致[3]。值得指出的是,由实时荧光PCR结果可知,HepaRG 细胞聚球体功能蛋白基因的高表达主要集中在接种后第7 和14 天,第21 天时明显下降。推测与聚球体体积过大导致内部细胞能量供应不足有关。为兼顾聚球体形态保持和功能蛋白表达,以保证实验效果,选择接种后第10 天的聚球型进行后续的药物毒性评价。
细胞毒性实验中,本课题组参考临床药物DILI评级[1]和美国国立卫生研究院LiverTox 网站信息[12]选择了6种阳性对照药(其中环磷酰胺的DILI评级为肝毒性弱相关,其余5种为肝毒性强相关)和1 种阴性对照药,具有很好的药物代表性[13-21]。实验结果显示,阴性对照药硫胺素未检测出明显细胞毒性,其余6 种阳性药物均对细胞存活有不同程度的抑制。单次给药条件下,除苯溴马隆和奈法唑酮外,其余药物对HepaRG和HepG2细胞聚球体细胞存活的抑制作用均未达到半数抑制水平。重复给药条件下,6 种阳性药物对2 种细胞聚球体抑制效果明显增强,除对乙酰氨基酚和环磷酰胺对HepG2 细胞聚球体外,均达到半数抑制水平。通过对比浓度-细胞抑制率曲线和IC50值可知,重复给药下HepaRG细胞聚球体对药物毒性比HepG2细胞聚球体更为敏感,6种阳性药物IC50值在0.3~8 mmol·L-1,较HepG2 细胞聚球体更低。提示HepaRG 细胞聚球体以重复给药的方式应用于体外药物肝毒性的检测筛选可以达到较为理想的效果。
在模型进一步应用方面,高通量高内涵检测技术近年来在化合物的检测筛选上应用逐步成熟,可通过不同荧光探针的标记,对肝聚球体模型的细胞核形态、线粒体膜电位变化、细胞骨架损伤程度、胆盐转运状态和脂质堆积变性等情况进行综合分析,可更好地研究药物肝毒性分子机制[22-23],这是本课题下一步重点研究的课题。
综上所述,本研究应用体外HepaRG和HepG2细胞聚球体模型,探讨了二者在生长规律、形态保持及CYP450酶和白蛋白表达方面的差异,并通过6种药物的细胞毒性实验对比其体外对药物肝毒性敏感度的差异。结果显示,对比HepG2 细胞聚球体,HepaRG 细胞聚球体体积控制更小,形态保持更加稳定,CYP450酶和白蛋白基因和蛋白表达均明显高于HepG2细胞聚球体,并对药物的体外肝毒性反应更为敏感,更符合体外3D 肝细胞模型构建标准,作为药物评价筛选模型具有一定优势,是更加理想的体外3D肝细胞模型。
