Cry1Ia蛋白的表达与纯化
2019-06-01郭小琴钱红梅高佳丽张义茹高建华王兴春
郭小琴,钱红梅,郭 星,高佳丽,张义茹,高建华,王兴春
(1.山西农业大学生命科学学院,山西 太谷 030801;2.山西农业大学农业生物工程研究所,山西 太谷 030801)
革兰氏阳性菌苏云金芽孢杆菌(Bacillus thuringiensis,Bt)在自然界中分布广泛,如在土壤、植物、昆虫、污水、储藏物和灰尘中都可以分离得到[1-2]。Bt 能够表达特异性杀虫蛋白,包括杀虫晶体蛋白(insecticidal crystal proteins,ICPs)[3]、营养期杀虫蛋白(vegetative insecticidal proteins,VIPs)[4]及分泌型杀虫蛋白(secreted insecticidal proteins,SIPs)[5]。其中,杀虫晶体蛋白分为Cry(Crystal Protein,晶体毒素)和Cyt(Cytolitic Protein,细胞裂解素)2 种,而Cry1I 类蛋白是Cry 蛋白家族的一个特殊分支[6-7],含有 Cry 蛋白典型的 N 端 3 个结构域(I,II 和 III),这3 个结构域具有不同的功能。其中,结构域I 用于形成跨膜通道;结构域II 和III 负责受体的识别与结合[8-10]。
通常,具有经典3 个结构域的Cry 蛋白有2 种大小[6]。其中,一类是在结构域的C 端存在几乎与之等长的长肽,这类Cry 蛋白的分子量约135 ku,比如Cry1A,Cry9 等;另一类Cry 蛋白不具有C 端长肽,分子量远小于前者,比如Cry1I 蛋白等,Cry1I 蛋白分子量约81 ku,可以分为7 个亚类(Cry1Ia,Cry1Ib,Cry1Ic,Cry1Id,Cry1Ie,Cry1If 和 Cry1Ig 等),每种亚类中,又包括若干种蛋白,比如Cry1Ia 包括约 38 种已知蛋白(Cry1Ia1~Cry1Ia38)。
Cry1I 是Cry 蛋白中少有的分泌型蛋白,其跨膜分泌由N 端分泌信号肽介导。该蛋白在天然宿主Bt 细胞中表达后,不形成伴孢晶体[11]。
Cry1I 蛋白对鳞翅目和鞘翅目部分昆虫具有杀虫活性[12],具有良好的应用潜力。比如Cry1Ie 蛋白对小菜蛾(Plutella xylostella)[13]、棉铃虫(Helicoverpa armigera)[14]、亚洲玉米螟(Ostrinia furnacalis)[15]等具有较好的杀虫活性,表达Cry1Ie 的转基因烟草[16]、玉米[16]和棉花[17]等也相继报道。
本研究将一种cry1Ia 基因接入pET28aDel 载体[17],构建表达质粒,并利用该质粒在大肠杆菌中表达Cry1Ia,旨在对Cry1Ia 蛋白的表达条件进行摸索,并与Bt 细胞的表达进行比较,建立Cry1Ia 蛋白的纯化条件,为进一步研究Cry1I 类蛋白奠定基础。
1 材料和方法
1.1 试验材料
研究涉及的菌株为大肠杆菌(Escherichia Coli)TG1 菌株 Tp304-1Ia 和 Bt 菌株 Bp304-1Ia。2 种菌株均含有 304-P1IaT 质粒[18]。
研究涉及的分子生物学试剂包括:Takara Premix Taq(货号 RR003A,用于 PCR 反应)、Takara pMD19 载体(货号 6013,用于 TA 克隆)、Axygen 质粒小量制备试剂盒(货号AP-MN-P-50);Axygen DNA 纯化回收试剂盒(货号AP-GX-50);金斯瑞Ni-NTA 亲和层析介质(货号L00250)。
1.2 试验方法
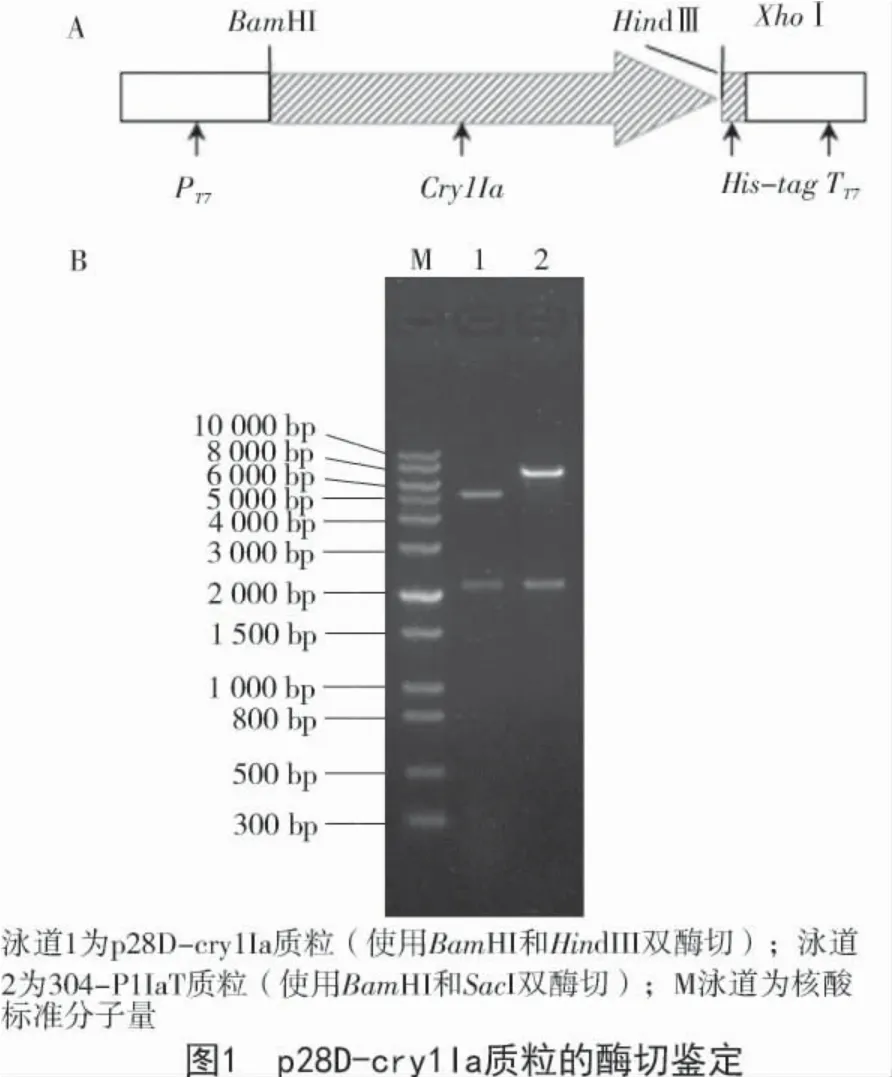
1.2.1 表达载体的构建 将Tp304-1Ia 菌株在37 ℃,200 r/min 条件下过夜培养。分别取2 mL 菌液至离心管,12 000 r/min 离心3 min,收集细胞沉淀,并提取质粒,作为PCR 的模板。使用引物1Ia-bbF(5′-GG ATCCACCATGAAACTAAAGAATCAAGATAAG)和1Ia-petR(5′-GCAAGCTTCATGTTACGCTCAATATG GAGTTG)进行PCR 反应,获得Cry1Ia 的编码序列,并进行TA-克隆。测序正确后,将目的片段用BamHI和HindIII 切出,接入pET28aDel 质粒相应的位点。将正确的质粒命名为p28D-cry1Ia。将构建好的表达质粒转入BL21(DE3)star 菌株,获得BLp28D-cry1Ia 菌株。
1.2.2 Cry1Ia 蛋白的表达与SDS-PAGE 分析 挑取BLp28D-cry1Ia 菌株的单克隆,在液体LB 培养基中培养 12 h(含 50 μg/L 的卡那霉素,37 ℃,200 r/min)后,按 1∶100(V∶V)的比例转接至 200 mL 液体培养基,继续培养至OD600值为0.6~1.0。加入终浓度为 1 mmol/L 的 IPTG,在 28 ℃诱导表达 4,8 h。
将上述培养液离心,收集细胞,弃上清。将细胞沉淀用 20 mL 预冷的 PBS 缓冲液(137 mmol/L NaCl,2.7 mmol/L KCl,10 mmol/L Na2HPO4和 2 mmol/L KH2PO4,pH 值为 7.4)重悬,超声波处理 30 min,12 000 r/min 离心20 min,将上清与沉淀分离。将沉淀用等体积的PBS 缓冲液重悬。分别取160 μL 上清和沉淀重悬液,加入 40 μL 的 5×Loading Buffer,混匀后,沸煮 10 min。12 000 r/min 离心 5 min,上样,进行SDS-PAGE 检测。
将Bp304-1Ia 菌株划板,挑取单克隆。在含有25 μg/L 红霉素的 LB 培养基中培养 72 h(25 ℃,200 r/min)。取2 mL 菌液离心,分离上清和细胞沉淀。然后制备SDS-PAGE 样品,并进行电泳分析。
1.2.3 Cry1Ia 蛋白的纯化 按照说明书的步骤,将大肠杆菌表达产物的可溶部分,通过Ni-NTA 层析介质,并用含有不同浓度咪唑的洗脱缓冲液依次洗脱,收集穿过液,并进行SDS-PAGE 检测。
2 结果与分析
2.1 cry1Ia基因的表达载体构建
对p28D-cry1Ia 质粒进行双酶切(BamHI 和HindIII)鉴定,结果显示,目的基因大小与304-P1I-aT 质粒中的 cry1Ia 基因相同(BamHI 和 SacI),说明载体构建正确(图1)。
2.2 Cry1Ia蛋白的表达
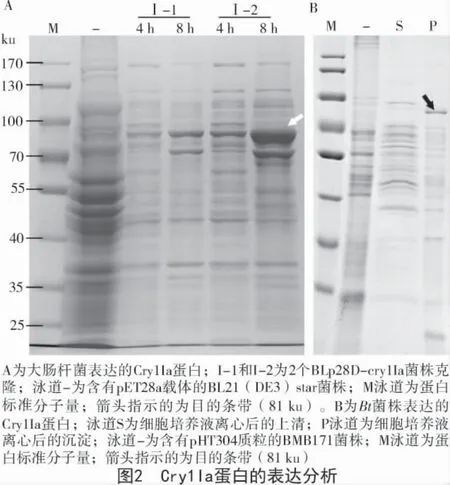
在不同的时间点,BLp28D-cry1Ia 均能够诱导表达Cry1Ia 蛋白,但是,8 h 的表达产物积累更多,尤其是2 号克隆(图2-A)。SDS-PAGE 结果显示,Bt 菌株也可表达Cry1Ia 蛋白,但是主要以不可溶的形式表达,上清中未观察到相应的条带(图2-B)。另外,大肠杆菌中的表达产物明显高于Bt 菌株。
2.3 Cry1Ia蛋白的纯化
选择BLp28D-cry1Ia 菌株2 号克隆的表达产物,取可溶部分使用Ni-NTA 进行纯化,结果显示(图3),成功纯化到Cry1Ia 蛋白,该蛋白在含有60 mmol/L 咪唑的洗脱液中开始从固定相上脱落,但是比例较小;90 mmol/L 以上的咪唑浓度能够更好地洗脱Cry1Ia 蛋白,其中,250 mmol/L 的咪唑浓度是Cry1Ia 蛋白的最优洗脱浓度。

3 结论与讨论
本研究构建了Cry1Ia 蛋白的表达载体,用于在大肠杆菌中表达这种蛋白质,初步研究发现,在大肠杆菌中该蛋白能够获得较好的表达,且随着表达时间的延长,表达量增加。
Bt 细胞中Cry1Ia 蛋白的产量相对较少。由于Cry1Ia 属于分泌蛋白,因此,可能有部分表达产物翻译后分泌至胞外,从而导致细胞内积累较少。Cry1Ia 蛋白分泌后,会迅速被蛋白酶消化,主要以60 ku 抗消化核心的形式存在[12]。因此,要获得表达量可观且序列完整的Cry1Ia 蛋白,革兰氏阴性菌如大肠杆菌是较理想的选择。
本研究通过对Cry1Ia 蛋白纯化条件的摸索,结果发现,该蛋白在稍低的咪唑浓度(60 mmol/L)下就能够被洗脱,但此时的非特异性条带依然较多;而通过稍高浓度咪唑(90,125 mmol/L)的洗脱能够进一步去杂;利用250 mmol/L 的咪唑能够将大部分靶标蛋白洗脱。因此,在后期纯化时,可以直接用30 mmol/L 的咪唑充分洗脱去杂;然后用90 mmol/L的咪唑进一步洗脱去杂;最后用250 mmol/L 的咪唑收集Cry1Ia 蛋白。
本研究构建了Cry1Ia 蛋白的表达体系,并探索了该蛋白的纯化条件,为进一步研究这类杀虫蛋白奠定了基础。
