银北盐渍化土壤中6种耐盐植物根际细菌群落结构及其多样性
2019-05-31代金霞田平雅苏建宇
代金霞,田平雅,张 莹,苏建宇
宁夏大学生命科学学院, 银川 750021
土壤盐碱化问题是目前全球最严重的环境问题之一。开发和利用大面积的盐碱土壤,不仅是增加农业可利用土地资源的需要,也是改善生态环境、增加绿色植被、提高森林覆盖率的需要[1]。宁夏银北盐碱区属我国5大盐碱土区的西北半干旱盐碱土区,蒸发量远远高于降水量,水资源缺乏。土壤盐碱化已成为影响宁夏农业生产和经济发展的限制性因素之一[2]。近年来,以耐盐植物种植为核心的盐碱地改良利用技术逐渐被重视起来。但盐碱地特殊的土壤性质会导致植物出现成活率低、保存率低等现象,成为限制这一技术发展的瓶颈[3]。
根际微生物作为土壤-根系间养分转化和转运的调节器,是受植物影响最大的土壤微生物群体[4]。已有的资料表明,根际微生物在其生命活动过程中通过产生大量的有机酸、不断释放土壤养分、有效改善盐碱土壤的理化性质和土壤结构等提高土壤肥力,对通过植被恢复改良盐碱地起到一定的作用[5- 7]。但目前盐碱地生物改良措施的研究大多是耐盐植物品种的选育和改良,针对盐碱土壤中微生物群落结构、优势种群、微生物-植物-盐碱土壤之间的交互作用等研究尚不系统[8]。因此,开展盐碱土壤中不同植物根际微生物群落组成和多样性研究,不仅有助于认识微生物群落功能调节并发掘新的功能类群,而且对加强盐生植物资源的开发和利用以及改良盐碱土壤都具有十分重要的意义。
本研究通过高通量测序和分离培养方法,对宁夏银北地区盐渍化土壤中的6种耐盐植物根际细菌的群落结构和遗传多样性进行了分析,以期为加速植被恢复改良盐碱地提供依据,也为开展盐碱区土壤微生物资源的开发和利用研究奠定基础。
1 材料和方法
1.1 材料
1.1.1研究区概况
宁夏银北地区属我国5大盐碱土区的西北半干旱盐碱土区,该地区年均蒸发量2444 mm,年均降雨量只有292 mm,为中温干旱气候,常年干旱少雨且蒸发量大,富水性差,主要土壤为盐碱土,植被类型以耐盐碱植物为主[9]。
1.1.2土壤样品采集
于2017年5—7月份在银北西大滩盐碱地(38°50′ 23.8″ N,106°23′ 54.1″ E)采集6种耐盐碱植物根际土壤。其中枸杞Lyciumbarbarum、苜蓿Medicagosativa、柳枝稷Panicumvirgatum为该区盐碱地改良中人工种植4年的植被,苦豆子Sophoraalopecuroides、柽柳Tamarixchinensis和芨芨草Achnatherumsplendens为该区主要分布的野生植被。采用五点取样法,每个样点各选取3棵植株,用铁铲去除植株根部周围枯落物和土壤,在距地表20—30 cm深处,待根部露出后收集根上附着的土壤置于灭菌的50 mL离心管中,将不同样点的土壤混匀,根据植被种类将土壤样品编号后,置于冰盒立即带回实验室,部分新鲜土样用于DNA提取和菌株分离,剩余部分风干过筛后根据《土壤农业化学分析方法》测定土壤理化性质[10]。
1.2 方法
1.2.1土壤基因组提取和16S rRNA基因V3—V4区片段扩增
按照美国Omega biotek公司土壤基因组提取试剂盒(D5625 Soil DNA Kit)操作说明提取不同植物各3个重复根际土壤基因组。经1%琼脂糖凝胶电泳检测后,测定DNA纯度和浓度。用灭菌去离子水将适量的DNA样品稀释至1 ng/μL,以其为模板,扩增16S rRNA基因的V3—V4区,使用带 Barcode 的特异引物对515F(5′-GTGCCAGCMGCCGCGGTAA- 3′)和806R(5′-GGACTACHVGGGTWTCTAAT- 3′)。扩增结束后将同种植物根际土壤的3个PCR产物进行等量混样,充分混匀后用2%的琼脂糖凝胶电泳进行检测,使用QIAamp DNA Micro Kit(QIAGEN公司)回收目的条带产物。
1.2.2文库构建、高通量测序和数据分析
PCR回收产物委托北京诺禾致源公司进行文库构建和高通量测序,采用Illumina HiSeq测序平台。通过对测序结果进行拼接和质控,得到有效序列,基于有效序列利用Uparse pipeline (v7.0.1001)对所有样品的全部有效标签序列聚类,以97%的一致性将序列聚类成为OTUs(Operational Taxonomic Units),获得OTUs聚类代表序列,利用RDP classifier(V2.2)[11]软件进行物种注释、丰度和多样性指数分析,同时在各个分类水平上对物种注释结果进行群落结构的统计分析。采用Spearman相关性分析(SPSS 19.0软件)对根际细菌群落组成和环境因子的相关性进行分析。
1.2.3根际可培养细菌的生物学活性和盐碱耐受性测定
用无菌称量纸分别称取上述6种根际土壤样品10 g于200 mL的LB培养液中,28℃条件下150 r/min培养30 min,取1 mL土壤悬液梯度稀释至10-3后吸取200 μL涂布于LB平板上,28℃恒温箱中培养48 h,挑取单菌落划线5次纯化,镜检后将纯化菌株接种于LB培养液中28℃培养48 h,取50 μL菌液点接于含有(Ca3(PO4)2)的PKO检测平板上,28℃培养7—10 d,根据菌落周围产生的透明溶磷圈的大小检测菌株的解磷能力[12]。将菌株分别接种到阿须贝无氮培养基和以ACC为唯一氮源的ADF培养基上,连续转接5次都能正常生长的菌株视为具备固氮活性和产ACC脱氨酶活性[13- 14]。
在LB培养基中加入NaCl使其质量分数为6%—15%,以含1% NaCl的LB平板作为对照,将菌悬液点接于平板用于检测菌株的耐盐性;用l mol/L的NaOH将高压灭菌的LB培养基调节pH值为9.0、10.0、11.0、12.0共4个梯度后倒平板,以pH 7.0的LB平板作为对照检测菌株的耐碱性。每株菌设置3个重复,置恒温培养箱中28℃培养2—3 d,观察平板上菌的生长情况。
1.2.4根际可培养细菌的多样性及其系统发育分析
观察菌落和菌体形态,结合菌株的生物学特性,选取代表菌株提取其基因组DNA,采用通用引物27F(5′-AGAGTTTGATCCTGGCTCAG- 3′)/1492R(5′-TACGGYTACCTTGTTACGACTT- 3′)进行16S rRNA基因的扩增和序列测定。序列在GenBank中进行BLAST同源性比较(http://www.ncbi.nlm.nib.gov/),用Clustal X进行多重比对,运用MEGA7.0[15]软件,采用Neighbor-Joining 法构建系统树,对菌株进行分子鉴定和系统发育分析。
2 结果和分析
2.1 不同植物根际土壤理化性质
研究区6种耐盐植物根际土壤理化性质见表1。土壤pH在8.16—9.25之间,呈碱性,有机质含量较低,总氮磷钾的含量在不同植物根际变化幅度不大。
2.2 根际土壤样品的OTU聚类和Alpha 多样性分析
由 MiSeq测序所得样品数据经质控后,各分类水平上分别获得较多的有效序列(图1),在不同土壤样品中有效序列数目为枸杞>苦豆子>苜蓿>芨芨草>柳枝稷>柽柳,即枸杞根际土壤获得的有效序列最多,柽柳根际最少。序列长度均大于400 bp,满足分析要求。对完成质控并去除嵌合体之后的有效序列以97%的一致性聚类成为OTUs,统计得到各个样品在不同 OTU 中的丰度信息。结果表明,6种土壤样品分别产生1571—2100个 OTU(表2),文库覆盖度在0.985—0.991之间,说明测序深度已经基本覆盖到样品中所有的物种,样本所建立的细菌文库能够比较有效地反映其多样性。不同根际土壤中物种丰富度指数(Chao 1指数和ACE指数)和多样性指数(Shannon指数和Simpson指数)存在明显差异,根际细菌物种多样性在各样品间表现为芨芨草>柽柳>苜蓿>柳枝稷>枸杞>苦豆子,芨芨草和柽柳根际细菌多样性较高,苦豆子最低;而丰富度则体现为苜蓿>芨芨草>苦豆子>柳枝稷>柽柳>枸杞,说明苜蓿和芨芨草根际土壤的细菌丰富度要高于其他植物根际土壤。
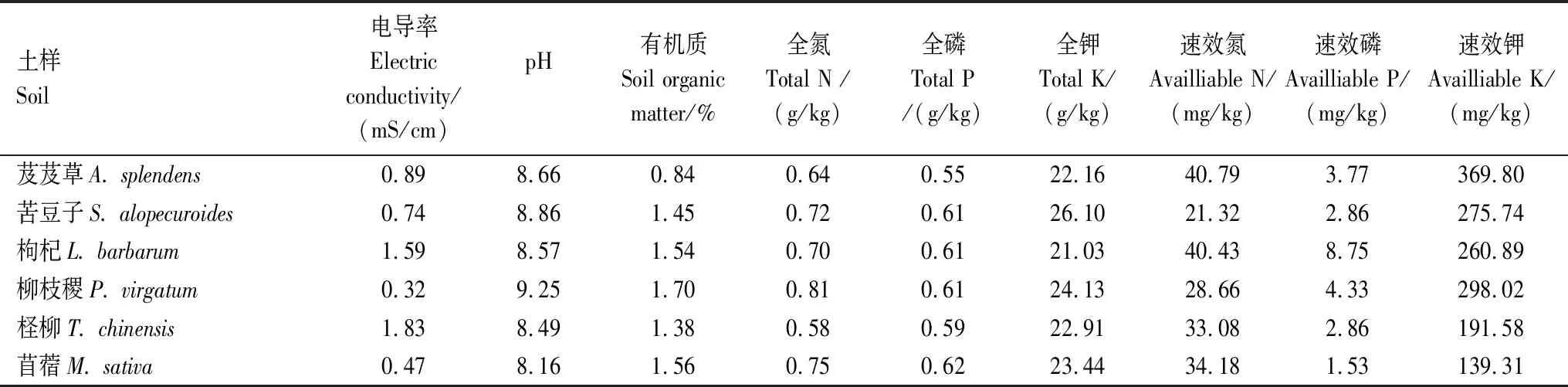
表1 不同耐盐植物根际土壤理化性质
ACE:基于丰度覆盖的估算,Abundance Coverage-based Estimator
2.3 6种植物根际细菌的群落结构组成分析
测序结果通过物种注释,6种根际土壤共获得31门67纲253科400属土壤细菌,选取每个样品在门水平丰度前十的物种,以Weighted Unifrac距离矩阵构建样品的UPGMA(unweighted pair-group method with arithmetic means,非加权组平均法)聚类树,并将聚类结果与各样品的物种相对丰度整合来研究不同样品间的相似性(图2)。由图2可以看出,厚壁菌门(Firmicutes,26.50%—62.33%)、变形菌门(Proteobacteria,16.54%—29.06%)和放线菌门(Actinobacteria,7.74%—21.15%)是根际土壤的优势菌群,相对丰度最高,其次是拟杆菌门(Bacteroidetes,4.84%—12.26%)、芽单胞菌门(Gemmatimonadetes,2.68%—6.69%)和酸杆菌(Acidobacteria,1.46%—3.97%),而疣微菌门(Verrucomicrobia)、绿弯菌门(Chloroflexi)、热微菌门(Thermomicrobia)和 单糖菌门(Saccharibacteria) 都以较低丰度分布在土壤中。在不同土壤样品中厚壁菌门相对丰度依次为苦豆子>枸杞>柳枝稷>苜蓿>芨芨草>柽柳,在苦豆子根际土壤中高达62.33%,为绝对优势类群。变形菌门相对丰度依次为柽柳>芨芨草>柳枝稷>枸杞>苜蓿>苦豆子,在柽柳根际变形菌门丰度(29.06%)略高于厚壁菌门(26.50%),其余5种植物根际均以厚壁菌门占优势。放线菌门丰度在各土壤中表现为芨芨草>柽柳>苜蓿>枸杞>柳枝稷>苦豆子。通过聚类图可以看出,在门水平上6种根际土壤细菌的群落结构组成表现为芨芨草和柽柳相似,柳枝稷、苜蓿和枸杞相似,苦豆子则与另外5种差别最大。

图2 基于非加权组平均法的门水平聚类图Fig.2 The clustering map at phylum level based on unweighted pair-group method
选取每个样品在纲和属水平上最大丰度前十的物种,生成物种相对丰度柱形图(图3、图4)。6种根际土壤中都以芽孢杆菌纲(Bacilli)占优势,相对丰度为17.67%—57.71%,在各土壤中依次表现为苦豆子>枸杞>柳枝稷>苜蓿>柽柳>芨芨草,是苦豆子根际的绝对优势菌纲。其次为α-变形菌纲(Alphaproteobacteria,6.39%—15.37%),在枸杞根际丰度最高,苦豆子根际最低,其丰度依次为枸杞>柽柳>芨芨草>柳枝稷>苜蓿>苦豆子;γ-变形菌纲(Gammaproteobacteria,4.17%—9.69%)、梭菌纲(Clostridia,0.89%—8.72%)、酸微菌纲(Acidimicrobiia,3.54%—7.86%)和放线菌纲(Actinobacteria,1.95%—7.82%)等在不同样品中丰度略有差异。在属水平上以芽孢杆菌属(Bacillus)为绝对优势属(15.57%—53.85%),在6种根际土壤中其丰度依次为苦豆子>枸杞>柳枝稷>苜蓿>柽柳>芨芨草;其余各属丰度均远低于芽孢杆菌,在不同土壤中占比不同,如鞘氨醇单胞菌属(Sphingomonas,1.32%—3.72%)在柳枝稷根际丰度略高,不动杆菌属(Acinetobacter,0.14%—3.21%)在芨芨草、苦豆子和苜蓿根际丰度相当,节杆菌属(Arthrobacter,0.24%—2.51%)、乳酸乳球菌属(Lactococcus,0.71%—2.43%)、腈基降解菌属(Nitriliruptor,0.21%—2.35%)等都以较低丰度分布于不同土壤样品中,说明植物种类会影响其根际微生物的群落组成和多样性。

图3 纲水平上的物种相对丰度图Fig.3 Relative abundance of species at class level

图4 属水平上的物种相对丰度图Fig.4 Rrelative abundance of species at genus level
2.4 根际细菌群落组成与环境因子的相关性分析
用Spearman秩相关来研究环境因子与根际优势菌群丰度之间的相互变化关系,得到两两之间的相关性热图(图5)。从图中可以看出,在相对丰度前十的优势类群中,厚壁菌门与土壤pH、总氮(TN)和总磷(TP)呈现正相关,和电导率、速效氮呈负相关;变形菌门、放线菌门和拟杆菌门则与土壤pH、有机质、总氮磷钾都呈现负相关,与电导率、速效氮呈正相关,但相关性都不显著;仅酸杆菌门与土壤有机质(SOM)显著正相关,热微菌门与速效氮极显著正相关,与总钾含量显著负相关; 单糖菌门(Saccharibacteria)与速效磷显著负相关;在相对丰度<0.1的菌群中,绿菌门(Chlorobi)与土壤有机质和总氮含量极显著正相关,硝化螺旋菌门(Nitrospirae)与总钾含量极显著正相关,与速效氮显著负相关;装甲菌门(Armatimonadetes)与总氮和总钾含量显著正相关,与电导率(EC)显著负相关。多数菌群组成与土壤理化因子之间相关性不显著。

图5 细菌群落组成与土壤理化因子的spearman 相关性分析Fig.5 Spearman correlation analysis among soil physico-chemistry characteristics and rhizobacteria communityEC:电导率,electric conductivity;pH:酸碱度,potential hydrogen;SOM:土壤有机质,soil organic matter;TN:总氮,total nitrogen;TP:总磷,total phosphorus;TK:总钾,total potassium;AN:速效氮,availliable nitrogen; AP:速效磷,availliable phosphorus;AK:速效钾,availliable potassium
2.5 可培养根际细菌的生物学特性和系统发育分析
从6种根际土壤中共分离出细菌110株,其中自苜蓿和柽柳根际分离菌株数较多,分别为30株和26株,分离自芨芨草根际的细菌数量最少,仅有10株(表3)。许多菌株具有一种以上生物学活性,其中23株菌在含有(Ca3(PO4)2)的平板上能够形成明显的解磷圈,具有溶解无机磷的能力;在阿须贝和ADF培养基上转接5次仍能正常生长的菌株分别有37和46株。多数菌株具备较强的耐盐碱性,所有菌株都能在含6% NaCl的培养基中生长,70株菌可以耐受10% 的NaCl,其中20株在含15% NaCl的培养基中仍能生长。所有菌株在pH 9.0的条件下都能正常生长,74个菌株在pH 12.0的条件下仍然长势良好,其中分离自柽柳、芨芨草和柳枝稷根际土壤的菌株盐碱耐受性普遍较强。

表3 6种耐盐植物根际土壤中活性菌株数量
ACC:1-氨基环丙烷- 1-羧酸,1-aminocyclopropane- 1-carboxylate

图6 基于 16S rRNA 基因序列构建的部分根际细菌的系统发育树Fig.6 Phylogenetic tree of partial rhizobacteria isolates based on the 16S rRNA gene sequences
通过菌落和菌体形态的初步归类,结合菌株的生物学活性,选取其中50个具有较强盐碱耐受性(耐受10% 的NaCl或pH 12.0),或具备解磷、固氮或产ACC脱氨酶能力的代表菌株进行16S rRNA基因序列分析。结果表明,这些菌株隶属于5个属,在属水平上多样性单一,芽孢杆菌属和假单胞菌属(Pseudomonas)是6种根际土壤的共有属,其中31个菌株与芽孢杆菌属细菌有99%—100%的序列同源性。选取部分菌株序列构建的系统树如图6,其中代表菌株LZJ12、JJC11与B.subtilissubsp.inaquosorum的序列同源性为99%,CL11、LZJ13与B.atrophaeus、LZJ4与B.sonorensis分别有100% 的序列同源性,这5株菌都可以耐受15% 的NaCl,也可在pH 12. 0的条件下生长,同时具备2种以上活性。KDZ12和KDZ4则与B.cereus和B.thuringiensis有99%的相似性,表明芽孢杆菌在种水平上的多样性较为丰富。有12株菌隶属于假单胞菌属,其中分离自枸杞和苦豆子根际的各4株,苜蓿根际2株,柽柳和柳枝稷根际各1株,分别与P.fluorescens、P.brassicacearum和P.corrugata有99%—100%的序列同源性;4株隶属于鞘氨醇杆菌属(Sphingobacterium),分别与S.faecium和S.kitahiroshimense有98%的序列同源性,这些菌株可耐受pH 12. 0的条件,但NaCl耐受性相对较弱,不能在高于8% NaCl 的盐浓度中生长;分离自苜蓿根际的菌株MX7与其他菌株在形态上完全不同,经16S rRNA序列鉴定隶属于节杆菌属Arthrobacter,与该属菌株A.humicola有100%的序列同源性;MX11和MX15同时具备固氮和解磷能力,与中华根瘤菌Sinorhizobiummeliloti有99%的序列同源性。与其他5种根际土壤相比,苜蓿根际可培养细菌的多样性较丰富,包括了鉴定出的所有菌属。将所测菌株的16S rDNA序列提交至Genbank,获得序列登陆号为MG735362-MG735411。
3 讨论
根际微生物是土壤-根系间养分转化和转运的调节器,也是受植物影响最大的土壤微生物群体[4]。作为土壤生态系统中最为活跃的构成因子,根际细菌参与了土壤中各种生物学和生物化学过程,对植物的生长发育和环境适应性产生重要的影响[16- 18]。
银北盐渍化土壤中6种耐盐植物根际细菌的群落结构分析表明,不同植物根际细菌群落在各水平上组成相似,物种多样性和相对丰度都因植物种类而不同。总体上看,根际细菌的多样性呈现为芨芨草>柽柳>苜蓿>柳枝稷>枸杞>苦豆子,而丰富度则呈现为苜蓿>芨芨草>苦豆子>柳枝稷>柽柳>枸杞。微生物的群落结构存在生境异质性,生态环境的不同造成微生物群落结构的组成和优势类群的相对丰度不同,而生态环境相似的地区土壤微生物结构较为相似[19]。本研究中6种耐盐植物根际细菌群落结构整体表现为野生的芨芨草和柽柳相似,而人工种植的柳枝稷、苜蓿和枸杞更为相似,苦豆子则明显区别于其他根际。这一结果的产生主要是由于3种人工种植的植物一直有着相同的田间管理措施,在一定空间尺度下具有相似的环境条件,明显不同于自然生长在盐碱荒地中的芨芨草和柽柳,而苦豆子主要分布在研究区土壤含水量较高的沟旁和田边地头低湿处,土壤因子可能对其根际细菌群落结构产生了较大的影响。
植被类型和土壤性质是影响植物根际细菌结构组成和多样性的重要因素之一[20]。杜滢鑫等[8]对大庆盐碱地九种植物根际土壤微生物群落结构的研究表明,酸杆菌门 、变形菌门是根际土壤优势菌群;李靖宇等[21]研究了沙坡头地区不同植物群落的土壤微生物多样性、刘洋等[22]比较了黄土高原4种乔木林土壤细菌的群落组成,结果都显示变形菌门、放线菌门和酸杆菌门等丰度较高,为土壤优势类群;而在银北盐渍化土壤中,厚壁菌门为绝对优势菌群,其相对丰度远高于其他研究,且酸杆菌门的丰度也远远低于变形菌门和放线菌门。微生物群落组成与环境因子的相关性分析表明,特定的菌群与特定的土壤因子相关,如绝对优势类群厚壁菌门与土壤pH值、总氮和总磷正相关,次优势类群变形菌门、放线菌门和拟杆菌门则与电导率、速效氮呈正相关,与土壤pH和有机质等呈现负相关,这与Nacke等的研究一致[23],表明银北盐渍化土壤中优势菌群在很大程度上受土壤pH值的影响。植物与土壤微生物之间通过凋落物和根系分泌物建立起密切的联系。因此植物种类不同,其凋落物的数量和根系分泌物的种类会对植物根际土壤理化性质产生影响,而特定的土壤性质又会引起功能微生物类群在根际的富集。很多厚壁菌可以产生芽孢,能够抵抗脱水,适应干旱和极端环境的能力极强;变形菌在植物根际能够快速地增长;放线菌是降解木质素与纤维素的主要功能菌群。这些富集于植物根际的功能微生物可以直接表征土壤营养转化及微生物的环境适应性[24]。银北地区土壤盐碱化程度较高,常年干旱少雨,营养物质匮乏,其土壤微生物群落可能是在长期的逆境胁迫下,经过自然选择而适应生态环境的表现。
土壤中的绝大多数微生物由于受生长条件和培养基选择性的限制是无法培养的,因此仅用传统的分离方法不能真实和准确的反应出土壤中微生物的结构组成和多样性[25]。高通量测序技术的成熟,使我们能够通过对环境微生物直接进行深度测序,从而较为全面和准确地在微生物群落水平分析物种的遗传多样性和相对丰度,并能较为客观地反映其中低丰度的重要功能微生物[26]。在6种耐盐植物根际细菌的高通量测序结果中,很多相对丰度较高的类群如鞘氨醇单胞菌属、不动杆菌属、乳酸乳球菌属等细菌,可能由于培养条件的限制并未通过培养方法获得。而一些相对丰度较低的菌属,如假单胞菌、鞘氨醇杆菌、节杆菌和中华根瘤菌能够分离培养获得,而且其中多数菌株具备较强的盐碱耐受性,同时还具有解磷、固氮或产ACC脱氨酶等一种或多种生物活性。解磷菌通过溶解土壤中难溶性的磷来促进植物对磷的吸收利用,固氮菌能够将空气中的氮素固定为化合态氮供植物利用,产ACC脱氨酶细菌通过抑制植物体内乙烯的积累而减轻逆境下乙烯对植物的伤害,同时提高植物抗盐碱和干旱等逆境胁迫。菌株分离结果显示芽孢杆菌属是分离频率最高的类群,许多芽孢杆菌不仅具有多种生物学功能,还可以有效抵御外界的有害因子,具有极强的抗逆性强;鞘氨醇杆菌有着极强的生命力和耐贫营养能力;假单胞菌属、节杆菌等也是土壤中常见的根际促生菌,许多菌株被报道可以分泌多种抗生素或生长激素,能有效抑制病原菌、显著提高植物的抗病性和促进植物的生长,是优良的根际促生菌类群[27- 28]。在营养物质匮乏的银北盐碱地中,这些定殖在根际土壤中的功能细菌可能通过代谢作用适应其所处的环境而得以存活并发挥着一定的作用。因此建议在今后开展盐碱地微生物群落多样性研究中,有必要将传统的分离方法和新一代测序技术结合起来,这样既能真实和准确地反映出土壤中微生物的结构组成和多样性,也能分离获得促生耐盐碱的生态功能菌株,为丰富盐碱区微生物资源、有效利用植物根际促生菌改良盐碱土奠定基础。
