5种条件下桉树焦枯病菌MAPK基因的表达
2019-05-30杨泽慧李丽红江仲鹏冯锦秀冯丽贞
杨泽慧,陆 芝,李丽红,江仲鹏,冯锦秀,冯丽贞
(福建农林大学林学院,福建福州350002)
丽赤壳属(Calonectriaspp.)真菌可侵染近100科寄主植物,造成多种病害[1].其中,C.reteaudii是澳大利亚、南美洲以及东南亚等地区桉树焦枯病(Cylindrocladium)最重要的致病菌,主要危害巨桉、圆角桉、白桉、赤桉等众多桉树品种,病树叶片焦枯脱落、嫩枝梢枯腐烂,甚至树冠秃顶和整株死亡,桉树人工林生产量明显下降[2].据估计,福建省每年因该病害造成的经济损失达0.518亿元,严重制约着桉树产业的发展[3].我国桉树焦枯病的病原菌至少有7种,其中C.pseudoreteaudii是福建省最早发现、分布最广且致病力最强的病原菌株[4].对该菌致病调控机理进行研究,可为设计药剂提供靶位点,为制定持久有效的防治策略奠定基础.
MAPK是一类丝氨酸/苏氨酸蛋白激酶,它与MAPK KK(MAPK kinase kinase)、MAPKK(MAPK kinase)等组成的MAPK级联途径是一条高度保守的信号转导途径,在真核生物的各项生命活动中具有重要调控作用[5-7].研究[8]表明,植物病原真菌中至少存在3条典型的MAPK级联途径.酵母Fus3/Kss1类同源基因在植物病原真菌中主要调控交配、附着胞或其他侵染结构的形成、菌丝侵入生长和毒力;Slt2-MAPK级联通路主要参与植物病原真菌的细胞壁完整性;Hog1-MAPK主要应答植物病原真菌细胞的渗透压胁迫,通过调节细胞内膨压维持细胞渗透压的稳定[9-11].3条通路间既相互独立又互相协作,使病原真菌积极响应环境变化和寄主的防卫反应.
植物在受到病菌侵染时会爆发活性氧,产生不利于病原菌的生存环境,以抵御病菌的侵入[12];也会产生病程相关蛋白(几丁质酶和1,3-葡聚糖酶),瓦解病菌的细胞壁[13].运用杀真菌剂(腐霉利、异菌脲、咯菌腈)防治病原菌时可能会激活Hog1-MAPK通路,导致病原菌不受控制地积累甘油等成分,最终病菌过度吸水肿胀而破裂,因此,病原菌的抗逆性在其侵染过程中十分重要[14].而孢子萌发产生的芽管是病原菌侵入植物的关键步骤.
鉴于此,本研究运用qPCR技术分析桉树焦枯病菌C.pseudoreteaudii(YA51)与酵母Fus3/Kss1、Slt2、Hog1和Ime2类基因同源的4个MAPK基因CpKss1、CpSlts、CpHog1和CpIme2在盐胁迫、氧胁迫、细胞壁干扰物质胁迫、桉树组织诱导以及不同发育时期5个条件下的表达情况,预测其功能.为该病菌的致病机制、抗逆性机制研究,以及寻求控制该病害的有效途径奠定基础.
1 材料与方法
1.1 供试材料
桉树焦枯病菌C.pseudoreteaudiiYA51、桉树抗焦枯病品系尾细桉M1(Eucalyptus urophylla×E.tereticornis)叶片由福建农林大学森林保护研究所提供.YA51基因组已上传至美国国立生物技术信息中心(National Center for Biotechnology information,NCBI, https://www.ncbi.nlm.nih.gov/),编号为 MOCD01000000.琼脂糖(BIOWEST)、PCR 引物(华大基因提供)、β-巯基乙醇、Tris-Hcl、EDTA、NaCl、无水乙醇均为国产分析纯、Taq PCR Master Mix(2×)(Promega)、0.5×TBE缓冲液、多糖多酚植物总RNA提取试剂盒、Talent荧光定量检测试剂盒(SYBR Green)、FastQuant cDNA第1条链合成试剂盒(FastQuant RT Kit)均采购自天根生化科技(北京)有限公司.
1.2 方法
将焦枯病菌接种于马铃薯葡萄糖琼脂(Potato Dextrose Agar,PDA)培养基上,然后放入28℃恒温箱中培养7 d.将培养后的平板刮掉菌丝,24 h后用无菌水清洗PDA平板并制成孢子悬浮液(106个·mL-1)或从菌落边缘打取6 mm菌碟.
1.2.1 NaCl胁迫处理 将15 mL孢子悬浮液接种于分别含有0、0.1、0.2、0.3、0.4 mol·L-1NaCl的酵母浸出粉胨葡萄糖(yeast extract peptone dextrose medium,YPD)培养基中,置于恒温振荡器(28℃,150 r·min-1)中培养12 h.用4层纱布滤下菌丝,用锡箔纸包裹后液氮速冻,-80℃保存.
1.2.2 干扰细胞壁完整性处理 分别将2个菌碟接种于含0、100、150、200 μg·mL-1荧光增白剂(Calcofluor White,CFW)的100 mL羧甲基纤维素钠(CMC)培养基中,置于恒温振荡器(28℃,150 r·min-1)中培养24 h.用4层纱布滤下菌丝,用锡箔纸包裹后液氮速冻,-80℃保存.
1.2.3 氧胁迫处理 分别将2个菌碟接种于含有0、4、6、8 mmol·L-1H2O2的150 mL CMC培养基中,置于恒温振荡器(28℃,150 r·min-1)中培养24 h.用4层纱布滤下菌丝,用锡箔纸包裹后液氮速冻,-80℃保存.
1.2.4 桉树组织诱导处理 取2 g桉树叶片加入2 mL无菌水研磨成浆,离心后取上清液,用细菌过滤器过滤上清液,置于100 mL PDA培养基,摇匀;待凝固后铺上玻璃纸,在平板中加入100 μL上述孢子悬浮液(106个·mL-1),并用涂布器均匀涂布.以马铃薯葡萄糖液体(potato dextrose broth,PDB)培养基接入焦枯病菌静置培养作为对照组.分别在12和24 h后,用锡箔纸将菌丝及玻璃纸一同包裹后液氮速冻,放入-80℃冰箱中保存,备用.
1.2.5 不同发育时期样品收集 离心收集孢子用锡箔纸包裹后液氮速冻;将15 mL孢子悬浮液接种于150 mL YPD培养基中,置于恒温振荡器(28℃,150 r·min-1)中,待芽管的长度为孢子长度的1/2时收集萌发菌丝,待培养12和24 h时收集成熟菌丝,用锡箔纸包裹后液氮速冻,-80℃保存.
1.2.6 总RNA提取及反转录 根据RNAprep Pure Plant Kit(TIANGEN)试剂盒说明书提取不同胁迫条件下的桉树焦枯病菌.采用超微量分光光度仪检测总RNA浓度及D260nm/D280nm,凝胶电泳检测总RNA带型.
以mRNA为模板,根据FastQuant cDNA第1条链合成试剂盒(TIANGEN)说明书进行反转录PCR.第1轮反应体系:5×gDNA Buffer 2 μL,Total RNA 3 μL,RNase-Free ddH2O 补足到 10 μL,加样后于 42 ℃孵育3 min,再冰浴.接着向 PCR 管中加入事先配置好的 Mix:10×Fast RT Buffer 2 μL、RT Enzyme Mix 1 μL、FQRT Primer Mix 2 μL、RNase-Free ddH2O,补足到10 μL.反应程序:42 ℃,15 min;95 ℃,3 min,置于-20 ℃冰箱中保存.
1.2.7 荧光定量PCR 以cDNA为模板,根据TransStart Tip Green RT-qPCR SuperMix(TRANSGEN)说明书进行荧光定量 PCR.反应体系:2×Talent qPCR PreMix 10 μL,Forward Primer 0.6 μL,Reverse Primer 0.6μL,cDNA 0.3 μL,50×ROX×Reference Dye 0.4 μL,RNase-Free ddH2O 补足20 μL.反应程序:95 ℃ 3 min,95℃ 5 s,60 ℃ 15 s,30 个循环.
采用Beacon Designer7软件设计引物,由上海生工生物工程公司合成(表1).陈慧洁等[15]研究发现,在桉树焦枯病菌C.pseudoreteaudiiYA51中相同的内参基因在不同试验条件下的稳定性存在差异.因此本研究对不同条件下的内参基因进行了筛选,最终分别以β-tubulin(氧胁迫)、α-tubulin-2(桉树组织诱导)、Ubiquitin(细胞壁干扰物质胁迫及盐胁迫)、β-actin(不同发育时期)为内参基因,计算表达量(Q):
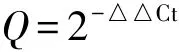
每个处理设3个重复.采用SPSS Statistics 19对各基因在相同指标、不同水平下的差异性进行单因素方差分析(P<0.05).

表1 荧光定量PCR引物Table1 Primers for RT-PCR
2 结果与分析
2.1 高渗透压胁迫下桉树焦枯病菌MAPK基因的表达情况
利用qPCR检测了桉树焦枯病菌MAPK基因在不同水平的高渗透压处理下的表达情况,结果如图1所示.从图1可知:4个MAPK基因受盐胁迫的表达量整体呈现出一个线性增长的表达模式;随着胁迫强度的增强,表达量增加.其中CpHog1和CpKss1,在NaCl处理浓度为0.1 mol·L-1时显著上调表达;当NaCl处理浓度为0.4 mol·L-1时,上调表达量最大,分别为8.36和6.28倍,且不同水平处理之间均呈显著性差异.CpSlt2在NaCl处理浓度为0.3 mol·L-1时,才表现出与对照的显著性差异,呈现出表达量增长的趋势,此时的相对表达量为2.77,在此之后相对表达量变化趋于平缓,稳定在对照的2.7倍左右.对于CpIme2,当处理浓度为0、0.1、0.2 mol·L-1时,相对表达量变化不大;当NaCl处理浓度为0.3 mol·L-1时,CpIme2的表达量最大,比对照上调了6.97倍;随着处理浓度的增大,表达量表现出降低趋势,但较对照显著增大.综上所述,不同浓度NaCl处理均有利于MAPK基因的上调表达,CpHog1和CpKss1相对表达量整体高于CpSlt2和CpIme2,其中CpHog1相对表达量上调最大.
2.2 氧胁迫下桉树焦枯病菌MAPK基因的表达情况
通过qPCR检测不同水平H2O2处理的桉树焦枯病菌MAPK基因表达量的变化,结果如图2所示.从图2可知:从整体上看4个MAPK基因受不同浓度氧胁迫下的表达量,呈现出不同的变化趋势;CpKss1在不同水平H2O2处理下的表达量变化无显著差异,相对表达量为对照的1.39~1.61倍;CpSlt2的表达量表现出一个线性增长的表达模式,随着胁迫强度的增大,表达量增加.当H2O2处理浓度为6 mmol·L-1时,CpSlt2开始发生显著性上调表达,此时表达量比对照上调了2.76倍.当H2O2处理浓度为8 mmol·L-1时,CpSlt2上调表达量最大,相对表达量为4.29.CpHog1在H2O2处理浓度为4 mmol·L-1时发生显著下调,此时的相对表达量为对照的0.63倍.在H2O2处理浓度为6和8 mmol·L-1时,CpHog1相对表达量变化趋于平缓,稳定在对照的1.3倍左右,但与对照无显著差异.CpIme2受氧胁迫的表达量呈现出一个抛物线的增长表达模式,随着胁迫强度的增强,在某一浓度达到高诱导表达,随后表达量减少.当H2O2处理浓度为6 mmol·L-1时,CpIme2表现出显著上调,比对照上调了2.09倍,随后表达量降低为对照的1.69倍.
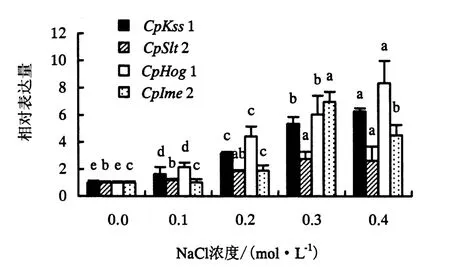
图1 不同浓度NaCl胁迫下桉树焦枯病菌MAPK基因的表达量(P<0.05)Fig.1 Expression levels of MAPK genes in C.pseudoreteaudii under different concentrations of NaCl
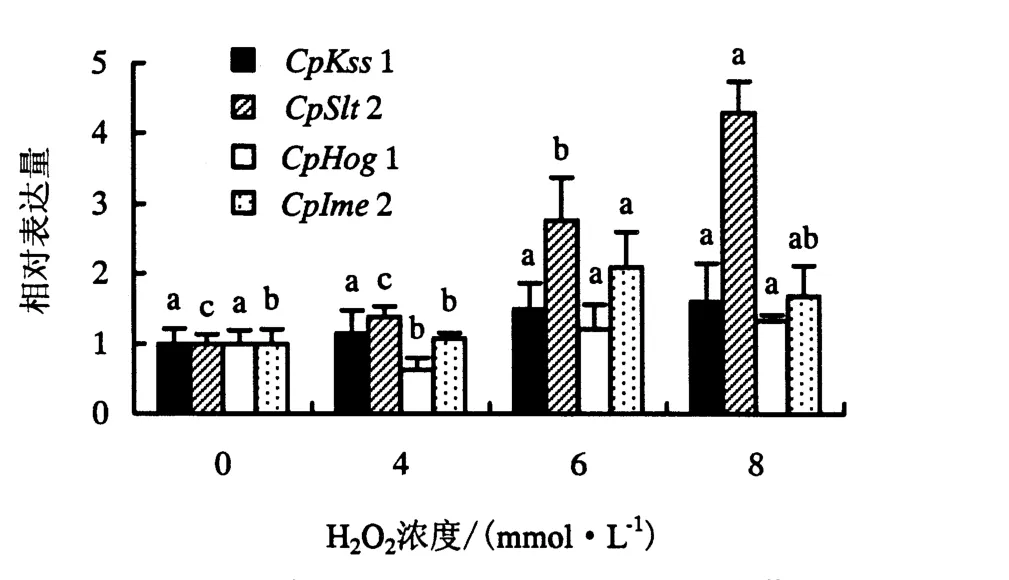
图2 不同浓度H2O2胁迫下桉树焦枯病菌MAPK基因的表达量(P<0.05)Fig.2 Expression levels of MAPK genes in C.pseudoreteaudii under different concentrations of H2O2
2.3 细胞壁干扰物质胁迫下桉树焦枯病菌MAPK基因的表达情况
桉树焦枯病菌MAPK基因在不同水平CFW处理下的表达量变化如图3所示.从图3可知:从整体上看4个MAPK基因受不同浓度CFW胁迫下的表达量呈现出不同的变化趋势;CpKss1的表达量随CFW胁迫强度的增大呈现出先上调后下调的变化趋势.当CFW处理浓度为100 μg·mL-1时,CpKss1的相对表达量发生显著上调,此时的相对表达量为对照的1.18倍;当CFW处理浓度为150和 200 μg·mL-1时,CpKss1 相对表达量变化趋于平缓,稳定在对照的0.8倍左右.CpSlt2表达量表现出一个线性增长的表达模式,随着胁迫强度的增大,表达量增加;当CFW处理浓度为150 μg·mL-1时,CpSlt2开始发生显著上调表达,此时比对照上调了2.10倍.当CFW处理浓度为200 μg·mL-1时,CpSlt2上调表达量最大,相对表达量为4.53.CpHog2在不同水平CFW处理下的表达量呈轻微下调,但表达量变化无显著差异,相对表达量为对照的0.78~0.86倍.CpIme2的表达量呈现出线性下降的表达模式,随着胁迫强度的增大,表达量降低;在CFW处理浓度为100 μg·mL-1时出现显著下调表达,此时的表达量是对照的0.65倍.当CFW处理浓度为200 μg·mL-1时,下调表达量最低,为对照的0.49倍.
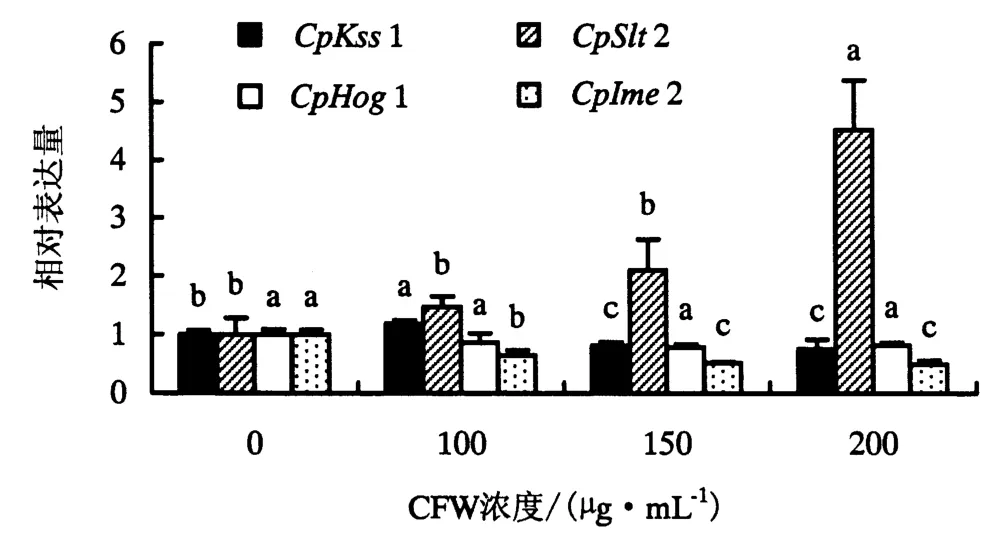
图3 不同浓度CFW胁迫下桉树焦枯病菌MAPK基因的表达量(P<0.05)Fig.3 Expression levels of MAPK genes in C.pseudoreteaudii under different concentrations of CFW
2.4 桉树组织诱导下焦枯病菌MAPK基因的表达情况
桉树焦枯病菌MAPK基因的表达量受桉树组织诱导时间影响的结果如图4所示.从图4可知,从整体上看,不同侵染时间下4个MAPK基因在侵染条件下的表达量变化趋势不一,有的呈现出上调的变化趋势,有的呈现出下调的变化趋势.其中,CpKss1受诱导的表达量呈现线性增长,随着侵染时间的推移,表达量增大.侵染12 h时,表达量显著上调,达到2.45;侵染24 h时,CpKss1表达量是对照的3.20倍.不同侵染时期,CpSlt2表达量轻微上调,但差异不显著,相对表达量为对照的1.20和1.63倍.CpHog1在侵染条件下发生显著下调,侵染12 h的表达量为对照的0.54倍;侵染时间增加到24 h时,CpHog1的表达量较12 h时轻微上调,但是较对照依然是显著下调,表达量为0.68.CpIme2的表达量变化情况与CpHog1相似,侵染12 h后的表达量为对照的0.47倍,下调幅度较CpHog1大;当侵染时间增加到24 h时,CpIme2的表达量是对照的0.51倍.
2.5 不同发育时期桉树焦枯病菌MAPK基因的表达情况
不同发育时期桉树焦枯病菌MAPK基因的表达量变化如图5所示.从图5可知,从整体上看4个MAPK基因的表达量在不同发育时期的变化趋势较为一致,在孢子时期的表达量较低,在萌发时期的表达量最低,在菌丝1时期的表达量较高,在菌丝2时期的表达量最高.在萌发时期CpKss1的表达量是孢子时期的0.29倍,表达量变化较其他3个基因大;而CpHog1表达量为0.48.但所有MAPK基因表达量与孢子时期均无显著差异.在菌丝1时期,4个MAPK基因的表达量均呈上升趋势;除CpHog1的表达量与孢子时期无显著差异外,其他3个基因的表达量均在5.7以上,且与孢子时期的表达量表现出显著差异.随着菌丝发育时间的推移,在菌丝2时期4个MAPK基因的表达量均大于菌丝1时期,且与孢子时期和菌丝1时期均表现出显著差异,其中CpIme2表达量增加到20.40.
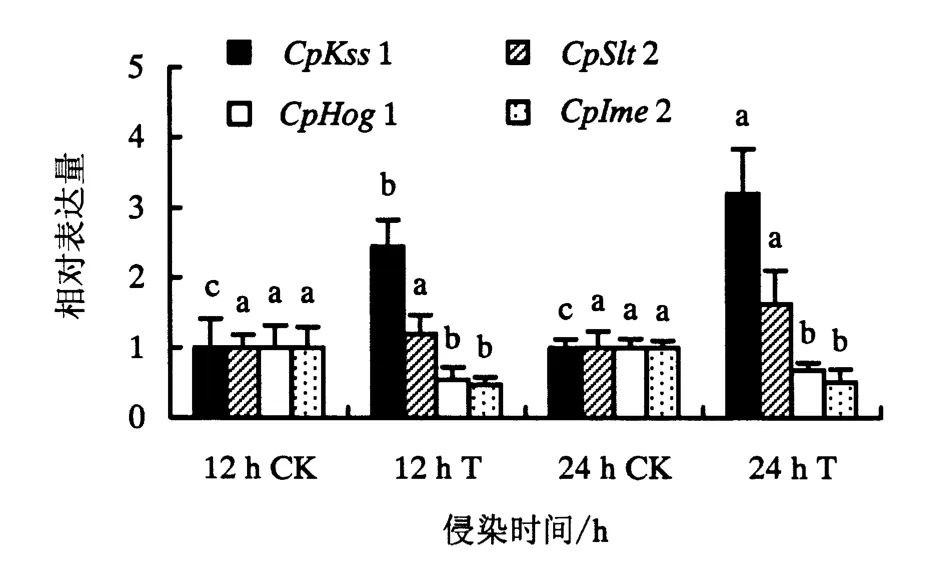
图4 不同侵染条件下桉树焦枯病菌MAPK基因的表达量(P<0.05)Fig.4 Expression levels of MAPK genes in the infected C.pseudoreteaudii
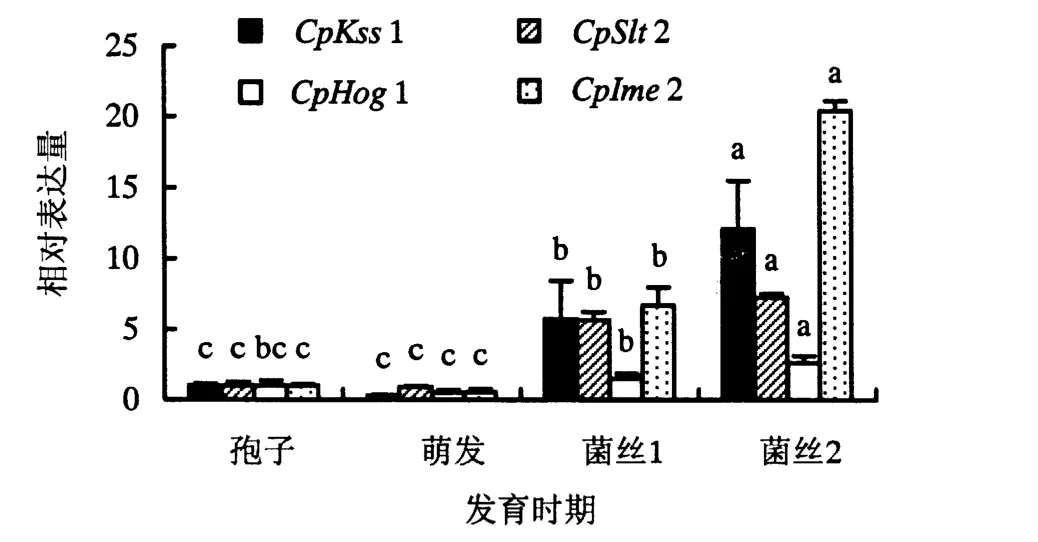
图5 不同发育时期桉树焦枯病菌MAPK基因的表达量(P<0.05)Fig.5 Expression levels of MAPK genes in C.pseudoreteaudii at different developmental stages
3 小结与讨论
MAPK级联途径在细胞过程中广泛发挥作用,常参与病菌的致病过程.CpKss1是酵母Fus3/Kss1类同源基因,在盐胁迫下受诱导的表达量随胁迫强度的增大持续上调表达,由此可见CpKss1在桉树焦枯病菌抵御高渗环境中起重要作用;在氧胁迫下表达量无显著性变化,表明CpKss1对氧胁迫不敏感;在细胞壁干扰物质胁迫下表现出表达量下调的趋势,表明CpKss1的表达受到CFW的抑制;在桉树组织液诱导下随诱导时间的增加,CpKss1的表达量持续增加,表明其可能在桉树焦枯病菌致病过程中发挥重要作用;CpKss1在菌丝发育阶段表达量最高,且随菌丝生长时间的推移表达量增加,推测该基因可能参与调控菌丝的生长发育.因此,CpKss1在桉树焦枯病菌中可能参与调控致病性、菌丝生长、高渗胁迫反应等.研究[17]表明,在玉米黑粉病菌(Ustilago maydis)中有2个酵母Fus3/Kss1类同源基因Kpp2和Kpp6,其双敲除突变体不能交配且不致病.在黄瓜炭疽病菌[18]和玉米黑粉病菌[17]中,Fus3/Kss1-MAPK均被证实与附着胞形成有关.这与本文研究结果一致.但有研究表明Fus3/Kss1对附着胞的形成无影响.不形成附着胞的病菌敲除Fus3/Kss1同源基因后,禾生球腔菌不能穿透气孔[19],小麦叶斑病菌不能产生侵染结构[20],间接调控病菌的致病性.
CpSlt2是酵母Slt2类同源基因,在盐胁迫下表达量轻微上调,但无明显规律.在氧胁迫下随H2O2浓度的增大,CpSlt2表达量呈直线上升,表明其可能在桉树焦枯病菌抵御氧胁迫环境中起重要作用.在细胞壁干扰物质胁迫下,CpSlt2受诱导的表达量呈现出持续增长的表达模式,说明该基因可能参与调控细胞壁的完整性.在桉树组织诱导下CpSlt2的表达量无明显变化,表明其可能与致病性无关;在病菌的不同发育阶段,CpSlt2在菌丝发育阶段表达量最高,该基因可能与菌丝的生长发育有关.总而言之,CpSlt2在桉树焦枯病菌中可能参与调控氧胁迫反应、细胞壁完整性和菌丝生长发育等.研究[21]表明,酵母Slt2类同源基因在禾谷镰刀菌、稻瘟病菌和禾生球腔菌中,都与病菌的细胞壁强度有关.白菜黑斑病菌的酵母Slt2类同源基因被破坏后,菌丝生长缓慢,说明该基因对菌丝生长有一定影响[22].上述研究与本研究结果具有一致性.在黄瓜炭疽病菌中Slt2类同源基因MAF1调节早期侵入步骤,缺失MAF1突变体的芽管无法产生附着胞[23],这与本文研究结论存在偏差,可能是由于Slt2类同源基因作用在不同病菌中存在差异[24].
CpHog1是酵母Hog1类同源基因,在盐胁迫下受诱导的表达量呈现出持续增长的表达模式,随着胁迫强度的增大,表达量持续显著上调,推测CpKss1在桉树焦枯病菌抵御高渗环境中起重要作用.在氧胁迫和细胞壁干扰物质胁迫下,CpHog1的表达量无显著性变化,表明其可能与抵御氧胁迫反应和调控壁细胞完整性无关;在桉树组织诱导下,CpHog1表达量表现出下调趋势,表明CpHog1的表达受到桉树组织的抑制;在桉树焦枯病菌的不同发育时期,CpHog1在孢子萌发时期表达量最低,在菌丝时期表达量较高,但无明显规律.因此,CpHog1在桉树焦枯病菌中可能参与病菌抵御高渗环境反应.研究[25-26]表明,该基因在板栗疫病菌和稻平脐蠕孢中均与病菌抵御高渗透压胁迫有关.与此同时,有研究发现Hog1同源基因在禾生球腔菌中还与致病性有关[27].上述研究与本研究结论一致.
CpIme2是酵母Ime2类同源基因,在盐胁迫中表现出抛物线型的表达模式,在NaCl浓度较低的情况下CpIme2的表达量持续上升,但在浓度较大时的表达量较之前略微下降,表明CpIme2在一定程度上参与病菌的高渗胁迫反应.在氧胁迫的条件下,CpIme2的表达量无明显变化,可能其与病菌抵御氧胁迫反应无关.在细胞壁干扰物质胁迫下,CpIme2的表达量呈现出持续降低的表达模式,表明该基因在CFW胁迫下的表达受到抑制.在桉树组织诱导培养基上CpIme2的表达量受到抑制.在桉树焦枯病菌的不同发育时期,CpIme2在菌丝时期的表达量显著增加,随菌丝发育时间的延长,其表达量也显著增加,推测该基因在菌丝发育方面发挥显著作用.因此,CpIme2在桉树焦枯病菌中可能参与病菌的高渗胁迫反应和菌丝的生长发育.酵母Ime2类同源基因在玉米黑粉病菌中影响菌丝的形成和交配,并间接与致病性相关[28],这与本研究结论相一致.但研究[28]也发现,Ime2同源基因在真菌中不仅调控减数分裂,也调控各种生理过程,包括子囊孢子形成、假菌丝生长和有性繁殖.
综上所述,在高渗透压胁迫下,CpHog1和CpKss1的表达量先表现出显著增加,但CpHog1增加的幅度明显大于CpKss1,CpIme2的表达量在胁迫浓度较大时才表现出显著增加.在细胞壁干扰物质胁迫下,CpKss1、CpHog1和CpIme2的表达量受到显著抑制,其中对CpIme2的抑制程度最大,而对CpHog1和CpKss1的抑制程度相当.在侵染条件下,CpHog1和CpIme2的表达量受到显著抑制,CpIme2的表达量受抑制程度更大.在不同发育时期条件下,桉树焦枯病菌4个MAPK基因均在孢子萌发阶段表达量最低,在孢子时期表达量较低,在菌丝阶段表达量最高.其中,CpIme2的表达量变化倍数最大,CpHog1的表达量变化倍数最小.
