茉莉花MVD基因及其启动子的克隆与表达
2019-05-30王鹏杰郑玉成郑知临陈桂信叶乃兴
陈 笛,王鹏杰,郑玉成,林 浥,郑知临,陈桂信,叶乃兴
(福建农林大学园艺学院/茶学福建省高校重点实验室,福建福州350002)
茉莉花[Jasminum sambac(L.)Ait]为木犀科多年生常绿灌木,既是茶用、香料植物也是药用植物[1-2].茉莉花植株各组织部位的化学成分主要有挥发油类成分及脂肪类、糖苷类、黄酮类、萜类化合物等,均有药用价值,其中,萜类化合物在茉莉花挥发油中广泛存在,在根和叶中也可检测到[3-4].在植物中,萜类化合物是通过质体中的2-C-甲基-D-赤藓糖醇-4-磷酸(2-C-methyl-D-erythritol-4-phosphate,MEP)途径和胞质中的甲羟戊酸(mevalonate,MVA)途径合成,而甲羟戊酸焦磷酸脱羧酶(mevalonate pyrophosphate decarboxylase,在已报道的文献中简写为MDC、MDD、MVD、MPD或DPMDC,本文简写为MVD)为MVA途径上游限速酶中的最后一个酶,能催化异戊烯基焦磷酸的生成,是一种ATP和Mg2+的依赖酶,且属于GHMP激酶超家族[5].目前,MVD基因已从多种植物中分离出来.在灵芝(Ganoderma lucidum)中,其MVD基因的表达与三萜化合物的含量呈正相关,并受外源茉莉酸甲酯的诱导,且MVD基因过量表达会显著增加灵芝中三萜化合物的含量[6].金钗石斛(Dendrobium nobile)为一种名贵药材,其MVD基因的表达受到菌根真菌的影响,且茎中MVD基因的表达量于接菌后期显著高于对照[7].张晓东等[8]从滇龙胆(Gentiana rigescens)中克隆出MVD基因,并进行原核表达和组织特异性表达分析,结果显示其主要在根中大量表达.对MVD基因启动子的克隆和分析发现,其启动子序列含有大量光响应元件,故推测光照是调控其表达的重要因素[9].研究还表明,MVD基因的表达具有组织特异性[10-11],并被生物和非生物因素诱导[5,12].
目前,对茉莉花的研究主要集中在茉莉花开放过程中香气物质含量的变化及一些香气合成相关酶基因的克隆与表达分析[13-14],而对其他组织部位和JsMVD基因的研究尚未见报道.本试验根据茉莉花花瓣转录组中的JsMVD基因序列设计上下游特异引物,采用RT-PCR技术从茉莉花中扩增出JsMVD基因,并进行序列分析和启动子克隆分析;采用实时荧光定量PCR技术检测JsMVD基因在茉莉花植株不同组织及不同激素处理下的表达量,旨在为进一步有效调控茉莉花香气中萜类物质的合成及茉莉花释香时间和强度的调控提供依据.
1 材料与方法
1.1 材料
1.1.1 植物材料 以双瓣茉莉花为供试材料.
1.1.2 试剂 多糖多酚植物总RNA提取试剂盒购自百泰克生物技术(北京)有限公司;Easyscript Onestep gDNA Removal and cDNA synthesis superMix试剂盒和Transstart®Tip Green qPCR superMix试剂盒购自全式金生物有限公司;Genome Walking kit试剂盒购自TaKaRa公司.
1.2 试验设计
于2018年8月选取成熟茉莉花花苞挂牌标记,分别用100 mg·L-1IAA、GA和ABA喷洒茉莉花苞,处理时间分别为0、2、4、6、9和12 h,并以清水(H2O)喷洒茉莉花苞作为对照.摘取上述4种处理茉莉花的根、茎、叶、花蕾及成熟花,采集3次生物学重复的样本,液氮速冻后保存在冰箱(-80℃)中.
1.3 RNA的提取及cDNA的合成
按照多糖多酚植物总RNA提取试剂盒说明书的方法提取茉莉花植株不同组织的总RNA及不同激素处理下花朵的总RNA,对RNA进行浓度和完整性等质量检验.参照Easyscript One-step gDNA Removal and cDNA synthesis superMix试剂盒说明书的方法合成cDNA用于RT-PCR和实时荧光定量PCR检测.
1.4 JsMVD基因的克隆
在前期茉莉花转录组测序的数据库中,根据序列注释的信息,从中筛选出相关的MVD基因编码的EST序列,将大小超过1 000 bp的片段采用NCBI Blast比对,选择具有完整开放阅读框(open read frame,ORF)的MVD基因序列,并根据此序列在 ORF两端设计全长序列扩增引物(上游引物:AAATGGCAGAAGAGAACGGG,下游引物:TCGCCCTCTTCACTTGGGAA),进行RT-PCR扩增,验证全长序列的准确性.RT-PCR 扩增体系:2.5 μL 10×TransTaq HiFi BufferⅡ、2 μL dNTPs、 0.5 μL 引物、0.2 μL HiFi Polymerase、1 μL 模板,用 ddH2O 补至25 μL.扩增程序:95 ℃预变性 5 min; 95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸2 min,35个循环;最后于72℃延伸10 min.将RT-PCR扩增产物进行回收,并参照姚雪倩等[15]的方法进行连接转化并挑取阳性克隆送至北京六合华大基因科技有限公司测序.
1.5 JsMVD基因启动子的分离
根据所得序列,利用Primer Premier 5.0软件从起始密码子ATG下游500 bp内设计3条巢式特异引物[特异引物1(SP1):AGGCAAAACCAGCAGCAGATGAAG,特异引物2(SP2):TGACGGCGACAGAAGTGGTAGT,特异引物3(SP3):TTTTCGTCCCTCTTACCCCAATAC],引物方向为需要扩增的未知方向,且SP2的位置应设计在SP1的内侧,SP3位于SP2的内侧.以提取的茉莉花花瓣的基因组DNA为模板,依据Genome Walking kit试剂盒说明书程序与试剂盒中的随机AP引物进行3轮热不对称PCR扩增.
1.6 JsMVD生物信息学分析
通过NCBI Blast在线查找所得cDNA全长序列ORF并进行同源性分析,用DNAMAN软件进行氨基酸多序列比对,用MEGA7.0软件构建系统进化树;用ProtParam、SignalP4.1、WOLF PSOR和Inter ProScan等在线软件分别对JsMVD保守区所编码的蛋白质进行理化性质、信号肽、亚细胞定位和结构功能域分析;用SOPME软件预测基因编码蛋白质的二级结构;通过PlantCare网站在线进行启动子顺式作用元件预测分析.
1.7 JsMVD基因实时荧光定量PCR检测
以茉莉花植株不同组织和不同激素处理的花朵的cDNA为模板,根据JsMVD基因全长序列用Primer Premier 5软件设计实时荧光定量PCR扩增引物(上游引物:ATAGCAAGGCAAGGTTCAGG,下游引物:GAGGTCATCCCAATGTTTCT),以茉莉花Actin为内参基因,按照Transstart®Tip Green qPCR superMix试剂盒说明书的方法进行实时荧光定量PCR扩增,试验数据设置3个生物学重复.数据通过Excel软件用2-ΔΔCt法进行定量分析,用SPSS软件在不同显著水平(P<0.01,P<0.05)上进行统计分析.
2 结果与分析
2.1 JsMVD基因的克隆及序列分析
以茉莉花花瓣cDNA为模板,经RT-PCR扩增出一条长度约为1 500 bp的单一目的条带(图1),与预期目标相符.测序拼接后显示MVD基因具有完整的ORF.Blast比对结果表明,MVD基因序列编码完整的MVD蛋白,与其他植物MVD氨基酸序列的相似度极高,因此确定MVD基因为JsMVD基因.将JsMVD基因序列提交至Gen-Bank,获得的登录号为MH311041.1.

图1 茉莉花JsMVD基因PCR的扩增结果Fig.1 PCR amplification of JsMVD gene
2.2 JsMVD生物信息学分析
测序所获得的MVD基因全长序列的长度为1 500 bp,其编码的JsMVD蛋白含有422个氨基酸,蛋白分子式为C2057H3271N573O627S19,分子质量为46.7 ku,理论等电点为6.57,不稳定系数为39.71,亲水性为-0.296,故推测该JsMVD蛋白为亲水稳定性蛋白.信号肽经SignalP4.1软件预测显示,JsMVD蛋白的N端存在信号肽的可能性较低,且亚细胞定位预测结果显示其位于细胞质中,故推测JsMVD基因在细胞质内合成后直接催化甲羟戊酸5-焦磷酸(MVAPP)在C5处脱羧,合成萜类化合物共同前体物质——异戊烯焦磷酸(IPP).
所得序列经Blast比对显示,JsMVD编码的氨基酸序列与野生油橄榄(Olea europaeavar.sylvestris,XP_022889972.1)、牵牛花(Ipomoea nil, XP_019191905.1)、长春花(Catharanthus roseus, ADR65112.1)和葡萄(Vitis vinifera,XP_002266399.1)等植物有较高的相似性,相似系数分别达到88%、86%、85%和84%.结构域经Inter ProScan软件分析显示,JsMVD蛋白含有位于第116~174氨基酸处的GHMP激酶N-端保守区域和第203~420氨基酸处的GHMP激酶C-端保守区域.JsMVD氨基酸序列含有9个与ATP结合有关的氨基酸及11个保守的氨基酸[16],第313位保守的天冬氨酸是决定催化活性大小的关键氨基酸[17].蛋白质的二级结构经SPOMA软件分析显示,JsMVD蛋白主要以α-螺旋、无规则卷曲、延长链和β-折叠构成,分别占37.68%、17.54%、4.74%和4.27%(图2).
为进一步研究JsMVD基因与其他植物同源基因的亲缘关系,分别选取不同植物MVD基因编码的氨基酸序列,采用邻近连接法构建系统进化树.结果(图3)显示:JsMVD基因与野生油橄榄、丹参、假马齿苋聚为一类,表明这些植物之间的亲缘关系较近;与野生油橄榄的亲缘关系最近,可能由于两者同为木犀科植物,但仅以43%的自展值连接,这可能与野生油橄榄的发源地更偏为地中海气候地区有关.
2.3 JsMVD基因启动子的分离及其顺式作用元件分析
以茉莉花基因组DNA为模板,经3轮巢式扩增后获得长度为893 bp的JsMVD基因启动子序列(图4).经PlantCare网站在线分析显示,JsMVD基因启动子序列包含启动子核心元件TATA-box和启动子增强元件CAAT-box,符合启动子的特征.该区域含有多种激素响应元件,如脱落酸响应元件ABRE,赤霉素响应元件GARE和TATC-box,生长素响应元件TGA-box;还含有多个光响应元件,如Box I、Sp1、G-box和I-box等;此外,还含有干旱胁迫响应元件MBS、胚乳表达调控元件Skn-1和生物钟调控元件Circadian(表1).

图2 JsMVD与其他植物MVD的同源比对Fig.2 Homology comparison on JsMVD protein with other plants

图3 JsMVD与其他植物MVD氨基酸序列的系统进化树Fig.3 Phylogenetic analysis of JsMVD and MVD in other plants

图4 JsMVD基因上游启动子序列Fig.4 The sequence of upstream promoter element of JsMVD

表1 JsMVD基因启动子区域顺式作用元件Table 1 List of cis-acting elements in the upstream promoter element of JsMVD
2.4 JsMVD基因mRNA水平的表达量
2.4.1 不同组织的表达量 采用实时荧光定量PCR技术检测茉莉花植株根、茎、叶、花蕾及成熟花等不同组织中JsMVD基因的表达量.结果(图5)显示,JsMVD基因在各组织中均有表达,在根中的表达量最低,在成熟花中的表达量最高,为根中表达量的20倍左右.
2.4.2 不同激素处理下的表达量 植物激素是植物体内的重要信号分子,可参与植物次生代谢过程.GA、IAA和ABA喷施茉莉花苞后,JsMVD基因在3种植物激素下均可被诱导表达,且ABA处理的表达量上升幅度最大;GA处理2 h后的表达量最大;IAA和ABA处理4 h后的表达量最大,随后呈下降趋势,但表达量仍高于对照组(图6).

图5 不同组织JsMVD基因的表达量Fig.5 Expression levels of JsMVD in different tissues
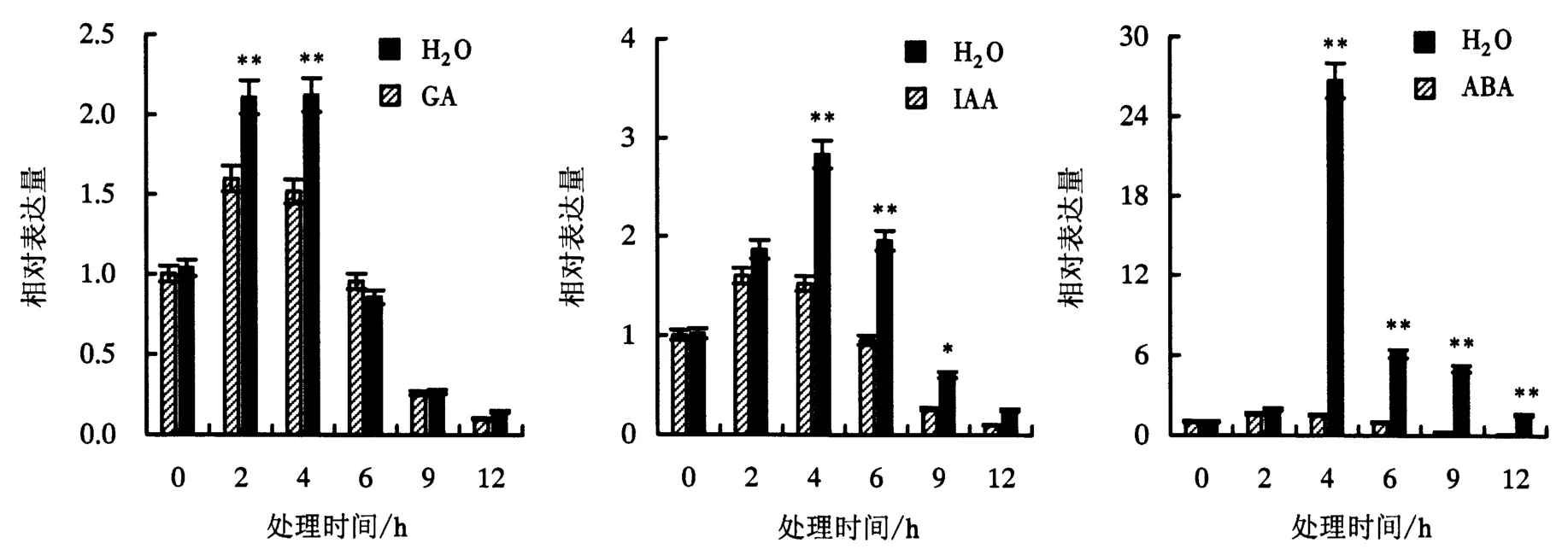
图6 GA、IAA和ABA诱导下JsMVD基因的表达量Fig.6 Expression levels of JsMVD induced by GA,IAA,and ABA
3 讨论
MVD作为甲羟戊酸途径中的最后一个催化酶,参与生物体内类异戊二烯化合物的合成代谢,其在生物体内的表达水平影响类异戊二烯化合物的生成[17].本试验从茉莉花中克隆得到JsMVD基因,定位于细胞质中,含有GHMP超激酶家族中典型的GHMP超激酶N-端和C-端保守结构域.NCBI同源比对结果显示,JsMVD基因编码的氨基酸序列与其他植物的相似性极高,其中与野生油橄榄的相似性达到88%,且含有与其他物种共有的保守氨基酸序列,这说明MVD基因在进化过程中是相对保守的.MVD蛋白含有一个保守氨基酸残基天冬氨酸,为催化活性高低的关键位点,但在不同生物中该活性位点不同,如在表皮葡萄球菌中,其MVD蛋白的保守位点为第283位氨基酸[18];在滇龙胆中,其MVD蛋白相应的保守氨基酸残基位于第315位;而在JsMVD蛋白中,该氨基酸残基位于第313位,这说明MVD蛋白具有类似的催化机制.
本试验首次成功分离了JsMVD基因的启动子序列,该序列包含Box I、Sp1、G-box和I-box等4种光响应元件,包含8个调控位点,表明光照可能是调控JsMVD基因表达的要素之一.李志栋等[9]研究表明,刺五加(Eleutherococcus senticosus)中的MVD基因启动子序列包含2个茉莉酸甲酯响应元件;而Jin et al[19]研究表明,喷施适当浓度的Me-JA后,刺五加中的皂苷类化合物明显升高;Shi et al[6]用不同浓度Me-JA处理灵芝,高浓度(150 μmol·L-1)的Me-JA可促进灵芝MVD基因的表达,而低浓度(100 μmol·L-1)的Me-JA则抑制其表达.在JsMVD基因启动子序列中并未发现Me-JA响应元件,却含有生长素和赤霉素响应元件,这可能是茉莉花与刺五加亲缘关系较远的缘故.在JsMVD基因启动子序列中还含有与生殖有关的顺式作用元件,如胚乳表达元件Skn-I,在刺五加MVD基因启动子序列中同样含有[9],但在灵芝中未发现[6].
前人在研究茉莉花萜类化合物合成相关基因的表达模式时多以茉莉花开放时间为对象[13-14],而对其表达空间少有研究.本试验在茉莉花植株的不同组织中均检测到JsMVD基因的表达,但表达量存在显著差异,在花瓣中大量表达,这与邢朝斌等[11]的“MVD基因具有组织特异性表达”的研究结果相符.Shi et al[6]在灵芝MVD基因上游启动子序列中发现了Me-JA顺式作用元件,并用Me-JA处理灵芝,证明了其对灵芝MVD基因的诱导表达.在JsMVD启动子序列中发现IAA、GA和ABA等植物激素响应元件,茉莉花花苞喷施IAA、GA和ABA后,JsMVD基因的表达量均显著高于对照组,这说明JsMVD基因的表达受这3种植物激素的诱导.IAA和GA作为促进生长的激素,可明显诱导基因的表达,但ABA作为一种生长抑制剂,多参与植物逆境胁迫活动,却能诱导茉莉花萜类化合物合成基因的表达,这可能与萜类化合物具有多种生理作用相关[20].
本试验首次克隆了JsMVD基因全长cDNA序列,并成功分离出其上游启动子区域,证实JsMVD基因在不同器官和不同生长发育时期均有表达,但表达量存在显著差异.本试验结果可为阐明MVD基因表达对茉莉花萜类化合物合成的影响提供参考.
